Documente Academic
Documente Profesional
Documente Cultură
Silabo Termodinamica
Încărcat de
jhon0 evaluări0% au considerat acest document util (0 voturi)
66 vizualizări2 paginisilabo
Titlu original
silabo termodinamica
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentsilabo
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
66 vizualizări2 paginiSilabo Termodinamica
Încărcat de
jhonsilabo
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 2
VIII.
SISTEMA DE EVALUACIN: UNIVERSIDAD NACIONALJos Faustino Snchez Carrin
t
FACULTAD DE INGENIERA QUMICA Y METALRGICA
El sistema de evaluacin del estudiante en la asignatura es integral y permanente.
8.1. Criterios: se considera competencias cognitivas, procedimentales y actitudinales. Slabo de la Asignatura
Capacidad para el trabajo educativo. TERMODINMICA PARA INGENIERA METALURGICA
8.2. Procedimientos: evaluacin escrita, expositiva y/o demostrativa. I. DATOS GENERALES:
8.3. Instrumentos: Pruebas de ensayo y pruebas estructuradas, trabajos de investigacin
1.1 Escuela Acadmica Profesional : Ingeniera Metalrgica
y/o de ejecucin, individuales y/o grupales.
1.2 Nivel Acadmico : Ciclo VII
8.4. Requisitos de aprobacin: Nota Final Aprobatoria mayor o igual a ONCE (11). El
1.3 Condicin : Obligatorio
criterio del medio punto o fraccin superior a favor del estudiante, slo ser tomado en
1.4 Crditos Acadmicos : 04 (Cuatro)
cuenta para obtener la Nota Final del Curso: La acumulacin del 30 % de inasistencias
1.5 Duracin y Distribucin Horaria : 17 Semanas / Semestre 2016-II
a clases se considerar Desaprobado por Inasistencia (Nota Final Cero).
1.5.1Teora : 03 Horas / semana
El Promedio Final PF del curso, segn Art. N 127 del Reglamento Acadmico,
1.5.2Prctica : 02 Horas / semana
R.C.U. N 0105-2016-CU-UNJFSC, se obtiene:
1.6 Pre-requisito : Fisicoqumica II
1 + 2 1.7 Profesor responsable :
=
2 Mg. Ing. Ronald Fernando Rodrguez Espinoza (DNU 302)
P1: Es el promedio simple de Primera Evaluacin Escrita, la Evaluacin Oral y el Reg. CIP N 95579 E-mail: ronaldferd@gmail.com
Trabajo Acadmico. P2: Es el promedio simple de Segunda Evaluacin Escrita, la
Evaluacin Oral y el Trabajo Acadmico. II. FUNDAMENTACIN:
El Examen Sustitutorio es slo para los estudiantes que tengan un promedio no menor El profesional de ingeniera Metalrgica y de Ingeniera en genera necesita conocer los
de 07 (Siete), reemplaza a P1 P2. El promedio Final para dichos alumnos no exceder principios fundamentales de la termodinmica para aplicarlos en su ejercicio profesional.
la Nota Doce (Art. N 138 del Reglamento Acadmico). An cuando dichos principios sean los mismos sin importar la disciplina en que se
apliquen, sin embargo para una mayor comprensin de los conceptos, en este curso se
IX. BIBLIOGRAFIA: plantearn problemas aplicados al campo de accin de la metalurgia.
[1]Bureau International des Poids et Mesures. (2006). The International System of III. OBJETIVO:
units (SI). 8th edition. Francia. Proporcionar al alumno os principios fundamentales y aplicaciones al campo de la
[2] CENGEL, Y. y BOLES, M. (2012). Termodinmica. 7ma Ed. Mxico: Editorial metalurgia de los conceptos bsicos de la termodinmica.
McGraw-Hill. IV. COMPETENCIAS:
[3]CEMIC, Ladislav. (2005). Thermodynamics in mineral sciences. New York:
Editorial Springer. 4.1. Cognitivas: (Saber)
Conocer los mecanismos y los factores de incidencia de las leyes termodinmicas en
[4]GASKELL, D. R. Introduccin a la termodinmica Metalrgica. Editorial
la metalurgia.
McGraw-Hill.
Conocer las leyes que rigen la termodinmica y su aplicacin a los diferentes
[5]IIGUEZ, Jos C. (2002). Introduccin a la termodinmica de las reacciones sistemas.
qumicas. Mxico: Editorial El Sol. Conocer los principios fundamentales del equilibrio.
[6]KLOTZ, I. y ROSENBERG, R. (2008). Chemical Thermodynamics. 7th Ed. New 4.2. Procedimentales / Instrumentales: (Saber hacer)
York: Editorial John Wiley & Sons. Saber realizar balances de energa.
[7]KUBASCHEWSKI, E. y ALCOCK, C. (1979). Metallurgical termochemistry. Saber cuantificar los cambios que se producen en los procesos.
New York: Editorial Pergamon Press. Saber evaluar termodinmicamente los procesos y determinar si son factibles que
[8]PRAUSNITZ, J. et al. (2002). Termodinmica molecular de los equilibrios de ocurran.
4.3. Actitudinales / valores: (Saber ser)
fases. 3ra Ed. Madrid: Editorial Prentice Hall.
Tener la capacidad de analizar y sistematizar la informacin adquirida.
[9]UPADHYAYA, G. y DUBE, R. (1997). Problems in Metallurgical
Tener habilidad para el manejo de software de anlisis y clculo termodinmico.
Termodynamics and Kinetics. Editorial Pergamon Press. Tener capacidad y motivacin para trabajar en equipo.
V. PROGRAMA INSTRUCCIONAL: VI. ESTRATEGIA DIDACTICAS:
Objetivo: Analizar los efectos trmicos en Semana 11:
I UNIDAD TEMTICA: las reacciones qumicas. La ecuacin de Clausius Clapeyron y su 6.1. MTODOS:
Referencias: [3], [4], [5], [6], [7], [9]. aplicacin a cambios de fase: vaporizacin, Se usar el mtodo Heurstico como
PRIMERA LEY DE LA
Semana 06: sublimacin, fusin, etc. Regla de Trouton resultado de la experiencia para obtener
TERMODINMICA Objetivo: Aplicar correctamente la ecuacin una solucin que se ajuste a casos
El concepto de entropa, reversibilidad.
Semana 01: de Clausius Clapeyron a los cambios de reales. Adems, se complementar con
Formulacin de la segunda ley de la
Conceptos bsicos y definiciones. El fase. los mtodos: inductivo, deductivo,
termodinmica. Cambios de entropa para
sistema y sus alrededores, propiedades Referencias: [3], [4], [5], [6], [7], [8]. [9]. analtico y sinttico.
unProceso. Ejemplos y problemas.
extensivas e intensivas. Clasificacin de Objetivo: Aplicar el balance simultneo de Semana 12: 6.2. PROCEDIMIENTOS:
fronteras. materia, energa y entropa a sistemas bajo Aplicacin de la termodinmica a los Actividad Docente: Promover y
Objetivo: Revisar definiciones y conceptos cualquier condicin. diagramas de equilibrio de fases: diagramas orientar la actividad dinmica de los
bsicos. Referencias: [2], [4], [7], [9]. de kellog. Regla de fases de Gibbs. alumnos en el proceso enseanza
Referencias: [1],[2],[4],[7]. Diagramas de equilibrio.
Semana 07: aprendizaje; selecciona medios y
Semana 02: Objetivo: Aplicar los diagramas de Kellog materiales educativos, actividades
Aplicacin de la segunda ley de la para determinar la estabilidad de los acadmicas de investigacin.
Comportamiento PVT de las sustancias termodinmica a las reacciones qumicas. compuestos y realizar los clculos
puras. Diagramas P-V, P-T y V-T. Tablas Cambios de entropa y su variacin con la termodinmicos en condiciones de equilibrio. Actividad del Alumno:
de propiedades de las sustancias puras. Los temperatura. Ejemplos y problemas. Referencias: [3], [4], [5], [6], [7], [8]. [9]. Participar activamente en todas las
datos tabulares y el anlisis de energa. Objetivo: Analizar los criterios de actividades de aprendizaje indicadas.
Objetivo: Analizar una sustancia pura y sus espontaneidad de las reacciones qumicas Interactuar con el docente en torno a
diferentes diagramas. basados en la entropa. III UNIDAD TEMTICA: integracin y desarrollo de contenidos
Referencias: [1], [2], [4], [7], [8]. Referencias: [3], [4], [5], [6], [7], [9]. TERMODINMICA DE SOLUCIONES del curso, y sus diversas aplicaciones.
Semana 03: Semana 08: Exposiciones de Trabajos, y Realizar investigaciones documentales
Semana 13:
El concepto de trabajo, calor, entalpa, en biblioteca y en bases electrnicas de
Unidades de concentracin. Diluciones. Ley
capacidad calorfica. Principio de la PRIMER EXAMEN PARCIAL(P1) diferentes revistas internacionales.
de Raoult. Soluciones ideales y no ideales.
conservacin de la energa. Formulacin Desarrollar los trabajos y prcticas
II UNIDAD TEMTICA: Actividades y coeficiente de actividad. Ley
de la primera ley de la termodinmica. de Henry. asignadas, con enfoque investigativo
Objetivo: Analizar como aprovechar las TERMODINMICA Y EQUILIBRIO para reportar resultados, en forma
Objetivo: Analizar el comportamiento de las
diferentes formas de energa. Semana 09: soluciones. individual y/o grupal.
Referencias: [1], [2], [3], [4], [7]. La energa libre. Criterios de Referencias: [3], [4], [8], [9]. 6.3.TCNICAS: Expositiva. Desarrollo de
espontaneidad. Cambios de energa libre. tcnicas demostrativas con Dinmica
Semana 04: Semana 14: grupal. Observacin y anlisis de los
Funciones termodinmicas. Ecuacin de
Aplicacin de la primera ley de la Gibbs-Helmholtz. Ejemplos y problemas. Propiedades termodinmicas de soluciones. eventos, interrelacin con el
termodinmica a sistemas de flujo Objetivo: Analizar los criterios de Presin de vapor. Variacin de la entalpa, fundamento terico para una
estacionario y a sistemas de flujo uniforme. espontaneidad basados en la energa libre. entropa y energa libre de Gibbs de mezclas. explicacin apropiada
Ejemplos y problemas. Referencias: [3], [4], [5], [6], [7], [8], [9] Objetivo: Aplicacin de la termodinmica al
Objetivo: Aplicar el balance simultneo de estudio de las soluciones. VII. MEDIOS Y MATERIALES DE
materia y de energa a sistemas bajo Semana 10: Referencias: [3], [4], [8], [9]. APRENDIZAJE:
cualquier condicin. Constante de equilibrio. Principio de Le 7.1. Medios: Audiovisuales, equipos de
Referencias: [1], [2], [3], [4], [7]. Semana 15:
Chatelier. Constante de equilibrio en fase laboratorio, instrumentos varios, etc.
Seminario de problemas y Exposiciones de
gaseosa. Reacciones heterogneas. 7.2. Materiales: Textos bsicos y de la
Semana 05: Trabajos.
Dependencia de la energa libre y la
Termoqumica. Ley de Hess. Reacciones especialidad, revistas, separatas,
constante de equilibrio con la temperatura. Semana 16:
exotrmicas y endotrmicas. Cambio de Objetivo: Aplicar el criterio de equilibrio a SEGUNDO EXAMEN PARCIAL (P2) material PAD diverso, pizarra, mota,
entalpa con la temperatura. Temperatura las reacciones qumicas. plumones, lapiceros y otros.
mxima de reaccin. Semana 17:
Referencias: [3], [4], [5], [6], [7], [8], [9]
EXAMEN SUSTITUTORIO
Entrega de notas finales.
S-ar putea să vă placă și
- Termodinámica clásica. Protocolos experimentales sobre primera y segunda leyes, y sobre potenciales selectosDe la EverandTermodinámica clásica. Protocolos experimentales sobre primera y segunda leyes, y sobre potenciales selectosÎncă nu există evaluări
- Analisis Volumetrico CuDocument13 paginiAnalisis Volumetrico CuDevis WillÎncă nu există evaluări
- Termodinámica y estadística: aplicada a los gasesDe la EverandTermodinámica y estadística: aplicada a los gasesÎncă nu există evaluări
- Primer Parcial CineticaDocument8 paginiPrimer Parcial CineticaJeff CoriÎncă nu există evaluări
- El Magnesio en La Industria MonografiaDocument49 paginiEl Magnesio en La Industria MonografiaLobsang Gallegos Benavente100% (2)
- Termodinámica UNSA: Principios y aplicacionesDocument5 paginiTermodinámica UNSA: Principios y aplicacionesJosué ItusacaÎncă nu există evaluări
- Silabus Por Competencias Metalografia 2017 BDocument9 paginiSilabus Por Competencias Metalografia 2017 BDasu Tirate Un PaseÎncă nu există evaluări
- Eh Vs PH Excel Con GraficoDocument12 paginiEh Vs PH Excel Con GraficoJoseph Ayma cutiÎncă nu există evaluări
- 1er.. Consolidado-B-Taller Tesis 2021-IIDocument3 pagini1er.. Consolidado-B-Taller Tesis 2021-IIalejandroÎncă nu există evaluări
- Investigacion y Desarrollo SostenibleDocument12 paginiInvestigacion y Desarrollo SostenibleRodrigo SaldañaÎncă nu există evaluări
- Universidad Nacional de Ingeniería Escuela Profesional de Ingeniería MetalúrgicaDocument3 paginiUniversidad Nacional de Ingeniería Escuela Profesional de Ingeniería MetalúrgicaJimmyVargasÎncă nu există evaluări
- SILABO Tecnología Del Gas Natural GLP - GNVDocument3 paginiSILABO Tecnología Del Gas Natural GLP - GNVricardoÎncă nu există evaluări
- Química de La Fundición Del OroDocument2 paginiQuímica de La Fundición Del OroLuis Angel Palomino100% (1)
- 1 Tecsup Termodinamica de La Cianuracion 777777Document36 pagini1 Tecsup Termodinamica de La Cianuracion 777777Gianfranco Ampuero VillavicencioÎncă nu există evaluări
- Cuantificacion de ManganesoDocument10 paginiCuantificacion de ManganesoyuzurijaÎncă nu există evaluări
- Desti Laci OnDocument33 paginiDesti Laci OnGabriel LVÎncă nu există evaluări
- Copia de LibroPiro PDFDocument172 paginiCopia de LibroPiro PDFjorjais123Încă nu există evaluări
- Silabo Análisis Químico de Minerales y Gestión de La Calidad en Laboratorios Iso 17025nuevoDocument5 paginiSilabo Análisis Químico de Minerales y Gestión de La Calidad en Laboratorios Iso 17025nuevoJoel Martines SCÎncă nu există evaluări
- Diagrama de Kellog UltimoDocument11 paginiDiagrama de Kellog UltimoYelitsa RoViÎncă nu există evaluări
- TECNOLOGÍAS ALTERNATIVAS PARA CONCENTRADOS COMPLEJOS DE PLOMODocument5 paginiTECNOLOGÍAS ALTERNATIVAS PARA CONCENTRADOS COMPLEJOS DE PLOMOismael1806Încă nu există evaluări
- MSP 1 PanoramaDocument21 paginiMSP 1 PanoramaAlejandro Salinas ZegarraÎncă nu există evaluări
- Electro - MetalurgiaDocument38 paginiElectro - MetalurgiaItalo Perez AvelloÎncă nu există evaluări
- 1EP OPTIMIZACIÓN 2020 - II-villalba Contreras Alex PDFDocument4 pagini1EP OPTIMIZACIÓN 2020 - II-villalba Contreras Alex PDFAlex ContrerasÎncă nu există evaluări
- Hilario Interfases Curvas - Ec Young Laplace Sin VideoDocument18 paginiHilario Interfases Curvas - Ec Young Laplace Sin VideoDante MontañezÎncă nu există evaluări
- Grupo 1 Del Viernes Laboratorio Analisis Mineral CuantitativoDocument13 paginiGrupo 1 Del Viernes Laboratorio Analisis Mineral CuantitativoEdison Guillermo Jairo Bazan ChavezÎncă nu există evaluări
- Practica N 5 FiltracionDocument4 paginiPractica N 5 FiltracionRonald Alarcon RomaniÎncă nu există evaluări
- 1º Ley de La Termodinamica - DiapositivasDocument21 pagini1º Ley de La Termodinamica - DiapositivasYanbal Cindy VeritoÎncă nu există evaluări
- Tarea Analisis Inst. Ayte Alvarez Franszua PDFDocument4 paginiTarea Analisis Inst. Ayte Alvarez Franszua PDFFRANSZUA AYTE ALVAREZÎncă nu există evaluări
- Modalidad No Presencial: Silabo Por Competencias Curso: Termodinámica para MetalurgiaDocument10 paginiModalidad No Presencial: Silabo Por Competencias Curso: Termodinámica para MetalurgiaMelek CuevaÎncă nu există evaluări
- Termodinamica Ii - Syllabus VirtualDocument8 paginiTermodinamica Ii - Syllabus VirtualIngeniero Alfonzo Díaz GuzmánÎncă nu există evaluări
- 8.5 Analizadores de ProcesosDocument14 pagini8.5 Analizadores de ProcesosSoany M. Alanoca CoaquiraÎncă nu există evaluări
- Pirometalurgia Del HierroDocument2 paginiPirometalurgia Del HierroHarold L. García RamírezÎncă nu există evaluări
- Ejercicios PrácticosDocument5 paginiEjercicios PrácticosRobinsonÎncă nu există evaluări
- Termodinamica de La Tostacion ResumenDocument3 paginiTermodinamica de La Tostacion ResumenValentina M. CortésÎncă nu există evaluări
- Ficha de Cuestionario 07 (CHAVEZ INCHE, Mark Anthony Kriss)Document4 paginiFicha de Cuestionario 07 (CHAVEZ INCHE, Mark Anthony Kriss)Mark ChavezÎncă nu există evaluări
- Tesis Lixiviacion de Galena Con Cloruro FerricoDocument188 paginiTesis Lixiviacion de Galena Con Cloruro Ferricojuan navarro gracia100% (1)
- FundentesDocument26 paginiFundentesAlberto ZepedaÎncă nu există evaluări
- Unidad Teoria Del Valor y Flujos Ejercicios ResueltosDocument25 paginiUnidad Teoria Del Valor y Flujos Ejercicios ResueltosAngelBlancoPoma100% (1)
- Cinetica y ReactoresDocument6 paginiCinetica y ReactoresMarcos Condorí PacoÎncă nu există evaluări
- Informe N 2 Celdas GalvanicasDocument10 paginiInforme N 2 Celdas GalvanicasDaniel DanielÎncă nu există evaluări
- 1-Diseño para Reacciones Simples PDFDocument32 pagini1-Diseño para Reacciones Simples PDFSergio100% (1)
- Taller de Estequiometria 4Document2 paginiTaller de Estequiometria 4LauraÎncă nu există evaluări
- Cap I Pmi 07Document19 paginiCap I Pmi 07JesusMedinaSalasÎncă nu există evaluări
- BBBBBBBBBBBBBBDocument75 paginiBBBBBBBBBBBBBBJordan anthonyÎncă nu există evaluări
- Informacion Tierras Raras Metodo de ObtenciónDocument12 paginiInformacion Tierras Raras Metodo de ObtenciónDiego MuñozÎncă nu există evaluări
- Balance de Materia y EnergiaDocument1 paginăBalance de Materia y EnergiaJesus NoriegaÎncă nu există evaluări
- Informe 2 Planta de Producción Del EstirenoDocument31 paginiInforme 2 Planta de Producción Del EstirenoBrandon RodriguezÎncă nu există evaluări
- El Aire y La Industria QuímicaDocument140 paginiEl Aire y La Industria QuímicaKatz MiguelÎncă nu există evaluări
- 2° Parte BAL - ENERGIA. TLR ZNS - 2 - LlenoDocument19 pagini2° Parte BAL - ENERGIA. TLR ZNS - 2 - LlenoJORDAN LEONCIO OLIVARES SEGOVIAÎncă nu există evaluări
- PhemmDocument197 paginiPhemmisabel mancillaÎncă nu există evaluări
- Aleaciones Especiales AcabadoDocument10 paginiAleaciones Especiales AcabadoErick Montenegro100% (1)
- Curvas de PolarizaciónDocument47 paginiCurvas de PolarizaciónChristian0% (1)
- Informe 4 - Grupo 2 - Intro - UniendoDocument20 paginiInforme 4 - Grupo 2 - Intro - UniendomiriamÎncă nu există evaluări
- Diagrama de PrecipitacionDocument6 paginiDiagrama de Precipitacionnoe vilcahuaman quispeÎncă nu există evaluări
- Mendez y V Correc Iqi Operaciones Ii 2020 IiDocument4 paginiMendez y V Correc Iqi Operaciones Ii 2020 IiJaneth MPÎncă nu există evaluări
- Guia de Practica de Electrometalurgía 2020 - IDocument9 paginiGuia de Practica de Electrometalurgía 2020 - IYuli QlÎncă nu există evaluări
- Pilas ElectroquimicasDocument12 paginiPilas ElectroquimicassamÎncă nu există evaluări
- IM - 0313 - 2017 Termodinamica I - UCR PDFDocument4 paginiIM - 0313 - 2017 Termodinamica I - UCR PDFGeorge PineÎncă nu există evaluări
- Silabo TermodinamicaDocument12 paginiSilabo TermodinamicaComite Educacion Medica ContinuaÎncă nu există evaluări
- Plan de Curso Fisica General IIDocument11 paginiPlan de Curso Fisica General IIapi-26022024Încă nu există evaluări
- Termodinamca Corrosion FinalDocument16 paginiTermodinamca Corrosion FinaljhonÎncă nu există evaluări
- Foltacion de MineralDocument100 paginiFoltacion de MineraljhonÎncă nu există evaluări
- Trabajo de Termodinamica Apa Final1Document26 paginiTrabajo de Termodinamica Apa Final1jhonÎncă nu există evaluări
- TermoquimicaDocument30 paginiTermoquimicajhonÎncă nu există evaluări
- Trabajo de Termodinamica Apa Final1Document26 paginiTrabajo de Termodinamica Apa Final1jhonÎncă nu există evaluări
- 01 Principios Fundamentales de La AceraciónDocument11 pagini01 Principios Fundamentales de La AceraciónChristian Huerta SolanoÎncă nu există evaluări
- Sider 7Document9 paginiSider 7jhonÎncă nu există evaluări
- 01 Principios Fundamentales de La AceraciónDocument11 pagini01 Principios Fundamentales de La AceraciónChristian Huerta SolanoÎncă nu există evaluări
- Silabo TermodinamicaDocument2 paginiSilabo TermodinamicajhonÎncă nu există evaluări
- SiderlurfkkfkffDocument15 paginiSiderlurfkkfkffjhonÎncă nu există evaluări
- Inspeccion VisualDocument23 paginiInspeccion VisualjhonÎncă nu există evaluări
- SiderlurfkkfkffDocument15 paginiSiderlurfkkfkffjhonÎncă nu există evaluări
- Arco SumergidoooDocument89 paginiArco SumergidooojhonÎncă nu există evaluări
- Silabo TermodinamicaDocument2 paginiSilabo TermodinamicajhonÎncă nu există evaluări
- Formas de Corrosión LocalizadaDocument30 paginiFormas de Corrosión LocalizadajhonÎncă nu există evaluări
- Monografía - Mechero de Bunsen - 2014 IDocument10 paginiMonografía - Mechero de Bunsen - 2014 ICarlos Fernandez RamosÎncă nu există evaluări
- Trabajo de Termodinamica Apa Final1Document26 paginiTrabajo de Termodinamica Apa Final1jhonÎncă nu există evaluări
- Examen de TermodinamicaDocument1 paginăExamen de TermodinamicajhonÎncă nu există evaluări
- Examen de TermodinamicaDocument1 paginăExamen de TermodinamicajhonÎncă nu există evaluări
- Examen de TermodinamicaDocument1 paginăExamen de TermodinamicajhonÎncă nu există evaluări
- Balance de Energia PDFDocument21 paginiBalance de Energia PDFnardomecanicaÎncă nu există evaluări
- Introducción Al Analisis PinchDocument170 paginiIntroducción Al Analisis PinchLopez777100% (1)
- Bomba Calorimetrica UniersalDocument5 paginiBomba Calorimetrica UniersalPUMA CONDOR DANIEL STHYPÎncă nu există evaluări
- Codigos de Errores AADocument64 paginiCodigos de Errores AAroque roldanÎncă nu există evaluări
- Práctica N°1 - Ley de Joule - Equivalente Mecánico Del CalorDocument1 paginăPráctica N°1 - Ley de Joule - Equivalente Mecánico Del CalorJulian Ayala PeñaÎncă nu există evaluări
- Examen IntercambiadoresDocument17 paginiExamen IntercambiadoresSofía Ariadna Castro GonzálezÎncă nu există evaluări
- Secador de CharolasDocument14 paginiSecador de CharolasJahzeel MuñozÎncă nu există evaluări
- Conductividad TermicaDocument15 paginiConductividad TermicaBeery CotrinÎncă nu există evaluări
- Guia 2 Unidad I - Fundamentos y TemperaturaDocument3 paginiGuia 2 Unidad I - Fundamentos y TemperaturaEver EucedaÎncă nu există evaluări
- 5 - Construcción de Trayectorias HipotéticasDocument8 pagini5 - Construcción de Trayectorias HipotéticasAgustín MartzÎncă nu există evaluări
- Ayudantía 3Document2 paginiAyudantía 3fabrizzioÎncă nu există evaluări
- Confort TermicoDocument12 paginiConfort TermicoAyde GradosÎncă nu există evaluări
- Gino Dutan - Leccion 1 - HVAC HospitalDocument5 paginiGino Dutan - Leccion 1 - HVAC HospitalGinoÎncă nu există evaluări
- Manual Balance Mat EnergS2 PDFDocument85 paginiManual Balance Mat EnergS2 PDFKevin CarlosÎncă nu există evaluări
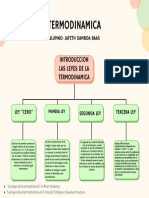
- Cuadro Sinóptico-Mapa Conceptual Unidad 4 Jafeth Gamboa BaasDocument1 paginăCuadro Sinóptico-Mapa Conceptual Unidad 4 Jafeth Gamboa BaasDarksoul 2703Încă nu există evaluări
- Presentación GibbsDocument6 paginiPresentación GibbsANDRES FABIAN HERNANDEZ CAROÎncă nu există evaluări
- Resumen Gas IdealDocument3 paginiResumen Gas Idealmargarita canoÎncă nu există evaluări
- Generalidades 2022-2Document54 paginiGeneralidades 2022-2Jose Maria Forero MartinezÎncă nu există evaluări
- Guia #5 Ciencias Sociales - Grado 4to Segundo PeriodoDocument4 paginiGuia #5 Ciencias Sociales - Grado 4to Segundo Periodomaria guerreroÎncă nu există evaluări
- Práctica Dirigida CICLOS TERMODINÁMICOS Y SISTEMAS ABIERTOSDocument11 paginiPráctica Dirigida CICLOS TERMODINÁMICOS Y SISTEMAS ABIERTOSteofilo serva veranoÎncă nu există evaluări
- Unidad 4 Carlculo de Cargas 3 PDF FreeDocument35 paginiUnidad 4 Carlculo de Cargas 3 PDF FreeEmiliano Puc CastroÎncă nu există evaluări
- Unidad 4 de LaboratorioDocument27 paginiUnidad 4 de LaboratoriomarthaÎncă nu există evaluări
- Investigacion Termodinamica - Keila Madai Sulvaran FernandezDocument8 paginiInvestigacion Termodinamica - Keila Madai Sulvaran Fernandez231u0541Încă nu există evaluări
- NTP 18Document24 paginiNTP 18Juan Carlos Elias YoveraÎncă nu există evaluări
- Primera Prueba de Avance de Ciencias Naturales - Primer A+ o de Bachillerato - 2015Document12 paginiPrimera Prueba de Avance de Ciencias Naturales - Primer A+ o de Bachillerato - 2015Aldo ReyesÎncă nu există evaluări
- Ejercicio Balance de EnergíaDocument2 paginiEjercicio Balance de EnergíaAndrès Monge -JEANMIXER-Încă nu există evaluări
- 04sem - Espec Di FisDocument3 pagini04sem - Espec Di FisKevin Kenjy Coaquira MezaÎncă nu există evaluări
- Física II: Calorimetría y cambios de faseDocument26 paginiFísica II: Calorimetría y cambios de faseYOSVIN KEVIN GONZALES ANTICONAÎncă nu există evaluări
- Ladrillos refractarios aislantes UA-26Document1 paginăLadrillos refractarios aislantes UA-26Andres MoralesÎncă nu există evaluări