Documente Academic
Documente Profesional
Documente Cultură
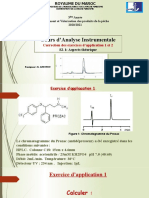
TP Spécialité 13 - Dosage Du Fer
Încărcat de
Mourad RabahTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
TP Spécialité 13 - Dosage Du Fer
Încărcat de
Mourad RabahDrepturi de autor:
Formate disponibile
TP de Spcialit no 13
Dosage du fer dans leau
On trouve le fer dans les eaux naturelles sous forme Terminer en ajoutant la pipette gradue 1,0 mL
dions Fe2+(aq) et Fe3+(aq), de lordre de 0, 5 mg.L1 . Ce fer dun colorant, la 1,10-phnantroline 1, 0 g.L1 , qui
est artificiellement retir des eaux embouteilles car les va former avec les ions fer (II) un un ion polyato-
ions ne sont pas stables, et lapparition dun dpt nui- mique color, et ce tant que le pH reste compris entre
rait laspect du produit commercialis. Quant leau 3,5 et 5,5.
potable au robinet, le seuil de potabilit, de 0, 2 mg.L1 ,
est bas sur des aspects esthtique (la prsence de fer Sur votre compte rendu
colore leau et provoque des taches sur le linge), gusta- a. Calculer les concentrations en ions fer (II) des solu-
tif (une eau riche en fer a un got affreux) et bactrien tion 1 6. Donner pour les solutions 7 10 le facteur
(une eau riche en fer peut favoriser le dveloppement de dilution.
de ferrobactries dans le rseau de distribution). b. Pourquoi est-il important que toutes les solutions
aient le mme volume ?
Le fer est un lment essentiel dans lalimentation, sur-
tout pour les femmes. Les besoins moyens sont de 2 Spectre dabsorption de la solution
lordre de 10 mg/jour, pour la synthse de lhmoglo-
bine. Ces besoins doivent tre couverts par lalimenta- Pour chaque solution 1 10, transvaser quelques mil-
tion : viande, fruits et lgumes. lilitres dans une cuve spectrophotomtrie.
On va doser les ions fer (II) contenus dans les eaux, par Pour la solution talon la plus concentre, la solution
spectrophotomtrie. 6, tracer le spectre dabsorption.
1 Gamme dtalonnage Sur votre compte rendu
c. Sur le spectre dabsorption, reprer le maximum
laide de fioles jauges de 50 mL, prparer les so- dabsorbtion max pour lespce colore considre.
lutions suivantes :
Tables 1 6 : solutions base dune solution talon 3 Courbe dtalonnage
dions fer (II) de concentration massique en fer de
t0 = 0, 1 g.L exact, verser dans la fiole laide Se placer au maximum dabsorbance max 510 nm.
dune pipette gradue, selon les volumes suivants : Effectuer le blanc avec la solution 10.
Table no 1 2 3 4 5 6 Mesurer les absorbances A des solutions 1 9.
V (mL) 0,5 1,0 1,5 2,0 4,0 8,0 Sur votre compte rendu
complter jusquau trait de jauge avec de leau d. Tracer le graphique reprsentant lvolution de lab-
distille. sorbance A en fonction de la concentration massique
Table 7 : remplir la fiole jauge dHydroxydase , c en fer (II) des solutions talon 1 6 prpares.
une eau vendue en pharmacie pour les cures ther- e. Modliser le graphique trac ; la linarit entre lab-
males domicile. Utiliser une pipette simple pour sorbance et la concentration est-elle vrifie ? Est-ce
ajuster au trait de jauge. grave ?
Table 8 : remplir la fiole jauge deau de Gimeaux,
petit bled proche de Riom o lon trouve des rsur- 4 Rsultats
gences de sources ptrifiantes. Utiliser une pipette f. Dterminer par lecture graphique sur la courbe
simple pour ajuster au trait de jauge. dtalonnage, la concentration massique en fer (II)
Solutions supplmentaires : no 9 : fiole jauge rem- des chantillons 7 et 8 tudis.
plie deau du robinet ; no 10 : fiole jauge remplie g. laide du facteur de dilution trouv prcdem-
deau distille, qui sera utilise comme blanc . ment, en dduire la concentration massique initiale
Rserver toutes ces solutions dans des bchers nu- des eaux tudies.
mrots de 1 10. h. Les eaux naturelles peuvent aussi contenir des ions
Dans chacun des bchers, introduire la pipette jau- fer (III). Proposer une mthode pour doser la quan-
ge 20,0 mL de solution tampon ion actate/acide tit totale dions fer contenus dans leau.
actique, ce qui va fixer le pH de la solution 5 en- i . Justifier lappelation dosage par talonnage
viron. donn au dosage ralis.
S-ar putea să vă placă și
- TP 5 STDocument2 paginiTP 5 STABDelpari SeraicheÎncă nu există evaluări
- Systéme HACCPDocument100 paginiSystéme HACCPMourad Rabah100% (8)
- Memotech Genie Energetique - OCRDocument168 paginiMemotech Genie Energetique - OCRamii100% (3)
- Guide Pretique de La ConstructionDocument46 paginiGuide Pretique de La ConstructionClaude Fregeau0% (1)
- TP Chimie de L Eau Duret de L EauDocument2 paginiTP Chimie de L Eau Duret de L Eauayoub dahbi50% (2)
- TP3-acide CinnamiqueDocument12 paginiTP3-acide CinnamiqueDenisaÎncă nu există evaluări
- TP Dosage DakinDocument3 paginiTP Dosage DakinMATHS SCIENCESÎncă nu există evaluări
- Preparation Solutions TamponsDocument4 paginiPreparation Solutions TamponsAbde Tam100% (2)
- Correct EX APL1 2Document9 paginiCorrect EX APL1 2Fatima IrjdalnÎncă nu există evaluări
- Calcul Des ChaudiéresDocument5 paginiCalcul Des ChaudiéresMourad Rabah100% (3)
- Chaine de ProductionDocument9 paginiChaine de ProductionMourad Rabah100% (3)
- Os Chimie Corrige Ch6Document52 paginiOs Chimie Corrige Ch6Said SouhassouÎncă nu există evaluări
- Plantes Toxiques À Usage Médicinal Du Pourtour MéditerranéenDocument391 paginiPlantes Toxiques À Usage Médicinal Du Pourtour Méditerranéencoolsvp100% (7)
- TP N°°°05 ManganimétrieDocument6 paginiTP N°°°05 Manganimétrieroumaissa bhÎncă nu există evaluări
- TP de Dosage Par Precipitation (Méthode de Mohr)Document4 paginiTP de Dosage Par Precipitation (Méthode de Mohr)Sïãnā JõëllęÎncă nu există evaluări
- Série N°4Document6 paginiSérie N°4Aliouat Roumaissa100% (2)
- 10 ComplexometrieDocument4 pagini10 Complexometrieرضاك ابي واميÎncă nu există evaluări
- Les Solutios TomponDocument19 paginiLes Solutios Tomponmed100% (1)
- tp1 Dosage Spectro Du PhosphoreDocument2 paginitp1 Dosage Spectro Du PhosphoreAbdou aziz fall100% (1)
- Compte Rendu 1Document11 paginiCompte Rendu 1hadil100% (1)
- TP AnalytiqueDocument7 paginiTP AnalytiqueRoubio Hiba100% (1)
- TP ConductimetrieDocument5 paginiTP ConductimetriePedro Assassi100% (1)
- C02 Durete Eau Corr PDFDocument2 paginiC02 Durete Eau Corr PDFmohÎncă nu există evaluări
- Exercices N 5 Et 6Document7 paginiExercices N 5 Et 6ahlemmÎncă nu există evaluări
- MANGANIMÉTRIEDocument2 paginiMANGANIMÉTRIEDiallo100% (1)
- Tp9 Suivi Reaction SpectrophotometrieDocument5 paginiTp9 Suivi Reaction Spectrophotometrieالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- TP 1 Preparation Solution 2020 2021 1Document6 paginiTP 1 Preparation Solution 2020 2021 1BillarjohnÎncă nu există evaluări
- TP03 TaDocument12 paginiTP03 TaManelÎncă nu există evaluări
- Compte Rendu 2 RésolutionDocument5 paginiCompte Rendu 2 Résolutionchouchou baÎncă nu există evaluări
- TP Dosage Complexometrie1Document4 paginiTP Dosage Complexometrie1Sellam AnisÎncă nu există evaluări
- Corr de TP (1) - AmsadakmariemDocument18 paginiCorr de TP (1) - Amsadakmariemmiri100% (1)
- Compte Rendu de tp1 Chimie de L'eauDocument9 paginiCompte Rendu de tp1 Chimie de L'eauOUMAIMA SAKHIÎncă nu există evaluări
- Dosage Volumétrique Par Précipitation: 1) Principe 1.1Document1 paginăDosage Volumétrique Par Précipitation: 1) Principe 1.1don yen100% (2)
- TP Dosage PH MétriqueDocument2 paginiTP Dosage PH MétriqueAbidine CHAHIR100% (2)
- TP La Potentiométrie À Intensité NulleDocument6 paginiTP La Potentiométrie À Intensité NulleHakim KhenicheÎncă nu există evaluări
- Aspirine TitrageDocument3 paginiAspirine TitragessgÎncă nu există evaluări
- Dosage Du SelDocument5 paginiDosage Du SelKonan Richard Kouassi100% (2)
- 95p3w td1Document4 pagini95p3w td1abdellah elghebouli100% (1)
- Correction TP3 Dosage Ions ChlorureDocument4 paginiCorrection TP3 Dosage Ions ChlorureYancouba BadjiÎncă nu există evaluări
- TPDosage Vinaigre CorDocument3 paginiTPDosage Vinaigre CorCamille LegaveÎncă nu există evaluări
- Chapitre 3 CPG SMDocument11 paginiChapitre 3 CPG SMALIÎncă nu există evaluări
- CHAP - 02 ACT - EXP Dosage ChlorureDocument3 paginiCHAP - 02 ACT - EXP Dosage ChlorureChikh Mourad0% (1)
- TitrationDocument3 paginiTitrationbounegab100% (1)
- Dosage Par ManganimetrieDocument4 paginiDosage Par ManganimetrieLouve MystiqueÎncă nu există evaluări
- Chimie AnalytiqueDocument71 paginiChimie Analytiquemejri amalÎncă nu există evaluări
- Chapitre 2Document19 paginiChapitre 2islam oo100% (1)
- TP3 - Dosage de Fe2+ Par Du Permanganate de Potassium - CorrDocument15 paginiTP3 - Dosage de Fe2+ Par Du Permanganate de Potassium - CorrLawrence Mundene-timotheeÎncă nu există evaluări
- TP SpectroscopieDocument8 paginiTP SpectroscopieMohammed Ben AliÎncă nu există evaluări
- TP3 Titrage Argentimétrique 2022-2023Document5 paginiTP3 Titrage Argentimétrique 2022-2023abderrahmane lalaouiÎncă nu există evaluări
- TP Chimie 1Document24 paginiTP Chimie 1saidi chaouki100% (2)
- TP1 Durete EauDocument3 paginiTP1 Durete Eauayoub dahbiÎncă nu există evaluări
- TP 2 Synthèse de BenzyleDocument14 paginiTP 2 Synthèse de BenzyleDhiab ArtÎncă nu există evaluări
- Vérification de La Loi de Beer-LambertDocument4 paginiVérification de La Loi de Beer-LambertMERi BÎncă nu există evaluări
- Colon NeDocument2 paginiColon NeNabilDouadiÎncă nu există evaluări
- Exposé Sur DosageDocument30 paginiExposé Sur DosageFaiçalEssabery100% (2)
- Compte Rendu ChromatographieDocument10 paginiCompte Rendu ChromatographieRim ElmoutaoukkilÎncă nu există evaluări
- Titrage-Acides AminésDocument2 paginiTitrage-Acides Aminéslmd200950% (2)
- Dosage Des Chlorures Par La Méthode de Charpentier - Volhard: Application Au Contrôle Du Soluté Massif de NaclDocument19 paginiDosage Des Chlorures Par La Méthode de Charpentier - Volhard: Application Au Contrôle Du Soluté Massif de NaclAbdelhamid ABDENNOURIÎncă nu există evaluări
- Sujet Dexamen Chimie Analytique Et Corrige 2013-2014Document4 paginiSujet Dexamen Chimie Analytique Et Corrige 2013-2014elhidhab2014100% (2)
- TP 2 Dosage Par Etalonnage de L Eau de Dakin EleveDocument5 paginiTP 2 Dosage Par Etalonnage de L Eau de Dakin Elevekarim maziz100% (3)
- TP 4 Dosage Des Ions ChlorureDocument6 paginiTP 4 Dosage Des Ions ChlorureSali0% (2)
- TP PH Metre ATHIR - New1Document8 paginiTP PH Metre ATHIR - New1samibenhabileÎncă nu există evaluări
- TP 1Document2 paginiTP 1lili0% (1)
- Imp PDFDocument13 paginiImp PDFChimiste ChimisteÎncă nu există evaluări
- TP Chimie N°7 Dosage OxydoreductionDocument1 paginăTP Chimie N°7 Dosage OxydoreductionSerge.Omisos367767% (3)
- Applications de la spectrophotomérie en phytochimie: sciencesDe la EverandApplications de la spectrophotomérie en phytochimie: sciencesÎncă nu există evaluări
- 16 Resine EchangeuseDocument3 pagini16 Resine Echangeuseincocc nnuuÎncă nu există evaluări
- CondenseurDocument6 paginiCondenseurMourad RabahÎncă nu există evaluări
- Pe - Traitdes EauxDocument156 paginiPe - Traitdes EauxMourad RabahÎncă nu există evaluări
- Calcul Des Chaudiéres2Document5 paginiCalcul Des Chaudiéres2Mourad Rabah100% (1)
- Infp 0706Document68 paginiInfp 0706Mourad RabahÎncă nu există evaluări
- ThermoDocument135 paginiThermotitebinÎncă nu există evaluări
- Os Chimie Corrige Ch6Document82 paginiOs Chimie Corrige Ch6Mourad RabahÎncă nu există evaluări
- TD Structure de LewisDocument9 paginiTD Structure de LewisMourad RabahÎncă nu există evaluări
- Analyses Physico-Chimiques Des Eaux de Process Et Des Boissons de SARL IFRI PDFDocument74 paginiAnalyses Physico-Chimiques Des Eaux de Process Et Des Boissons de SARL IFRI PDFMourad Rabah100% (1)
- Cinetique IIDocument2 paginiCinetique IIMourad RabahÎncă nu există evaluări
- TP n5 Le YogourtDocument5 paginiTP n5 Le YogourtMourad RabahÎncă nu există evaluări
- Manuel Des Protocoles D'échantillonnage Pour L'analyse de La Qualité de L'eau Au CanadaDocument219 paginiManuel Des Protocoles D'échantillonnage Pour L'analyse de La Qualité de L'eau Au CanadaMourad RabahÎncă nu există evaluări
- Qualité D EauDocument107 paginiQualité D EauMourad RabahÎncă nu există evaluări
- Etude de La Qualite Des Eaux Souterraines PDFDocument47 paginiEtude de La Qualite Des Eaux Souterraines PDFMourad RabahÎncă nu există evaluări
- Etude de La Qualite Des Eaux Souterraines PDFDocument47 paginiEtude de La Qualite Des Eaux Souterraines PDFMourad RabahÎncă nu există evaluări
- PARAMETRES PHYSICO-CHIMIQUES DES EAUX Mesures in SituDocument55 paginiPARAMETRES PHYSICO-CHIMIQUES DES EAUX Mesures in SituMourad RabahÎncă nu există evaluări
- Le Lait CamelinDocument5 paginiLe Lait CamelinMourad RabahÎncă nu există evaluări
- Détermination Des Paramètres Physicochimiques Et Des Métaux LourdsDocument33 paginiDétermination Des Paramètres Physicochimiques Et Des Métaux LourdsMourad RabahÎncă nu există evaluări
- Terminologie MetauxDocument20 paginiTerminologie MetauxMourad RabahÎncă nu există evaluări
- Hal 00928916Document12 paginiHal 00928916Mourad RabahÎncă nu există evaluări
- TP Vitamin EcDocument1 paginăTP Vitamin EcMourad RabahÎncă nu există evaluări
- 7 - Chromatoraphie QuantitativeDocument20 pagini7 - Chromatoraphie QuantitativeMourad RabahÎncă nu există evaluări
- Dosage de La Vitamine CDocument2 paginiDosage de La Vitamine CMourad Rabah0% (1)
- Operations Unitaires Plan PDFDocument19 paginiOperations Unitaires Plan PDFMourad Rabah100% (1)
- Ba1 PDFDocument150 paginiBa1 PDFMourad Rabah100% (1)
- TD1 MetabolismeDocument1 paginăTD1 MetabolismeyvesÎncă nu există evaluări
- Tour Refroidissement LegionelloseDocument40 paginiTour Refroidissement LegionelloseAdnen GuedriaÎncă nu există evaluări
- ST C10-A10Document7 paginiST C10-A10mohamed0167Încă nu există evaluări
- Cours 1 de Chimie Des Solutions Chapitre 1 ConductimétrieDocument47 paginiCours 1 de Chimie Des Solutions Chapitre 1 ConductimétrieRaouia MakhloufÎncă nu există evaluări
- Corrosion Mémoire016870532149513518823Document39 paginiCorrosion Mémoire016870532149513518823Youcef seddik RokbaÎncă nu există evaluări
- TP Genieenz ImmobDocument4 paginiTP Genieenz ImmobNassimaÎncă nu există evaluări
- AérogelDocument5 paginiAérogelchristopheÎncă nu există evaluări
- Devoir Nc2b01 2s Isf ModifieDocument2 paginiDevoir Nc2b01 2s Isf ModifieRoon proÎncă nu există evaluări
- Le VerreDocument26 paginiLe Verremikhailbotkine100% (1)
- Module de Formation Sur Les Bonnes Pratiques de Laboratoire 2023Document38 paginiModule de Formation Sur Les Bonnes Pratiques de Laboratoire 2023NYANDWI DIDIER100% (3)
- Pages Extraites de 1BAC CC2 CONTROLS 1bacDocument5 paginiPages Extraites de 1BAC CC2 CONTROLS 1bacTarik OuabrkÎncă nu există evaluări
- Devoir de Synthèse N°2 2ème Semestre - Sciences Physiques - 1ère AS (2018-2019) MR BARHOUMI EzedineDocument2 paginiDevoir de Synthèse N°2 2ème Semestre - Sciences Physiques - 1ère AS (2018-2019) MR BARHOUMI EzedinewalidÎncă nu există evaluări
- Type de LentillesDocument39 paginiType de Lentillesmaryam100% (1)
- Catalogue Sirmel 2015Document249 paginiCatalogue Sirmel 2015Céline LuttiÎncă nu există evaluări
- Rapport Du PfeDocument65 paginiRapport Du PfealiÎncă nu există evaluări
- Influence de La Température Sur Le Jeune Âge de BétonDocument119 paginiInfluence de La Température Sur Le Jeune Âge de BétonMohammed BoucherbaÎncă nu există evaluări
- 15 08 10cours D Electricite 3e P 2010Document64 pagini15 08 10cours D Electricite 3e P 2010hadrifaÎncă nu există evaluări
- Tableau Périodique Des Éléments - Courbis, LEDocument1 paginăTableau Périodique Des Éléments - Courbis, LECarly ngassamÎncă nu există evaluări
- LES HUILES LUBRIFIANTES-additifDocument5 paginiLES HUILES LUBRIFIANTES-additifEmilien HAINGONIRINAÎncă nu există evaluări
- Medecine-Intro Genetique MonohybridismeDocument23 paginiMedecine-Intro Genetique MonohybridismedzsergioÎncă nu există evaluări
- (Sources Chrétiennes 067) Origene - Origène - Entretien Avec Héraclide PDFDocument66 pagini(Sources Chrétiennes 067) Origene - Origène - Entretien Avec Héraclide PDFBogdan Nicolae100% (1)
- Cours - 9b - Les Liants (Mode de Compatibilité) BisDocument29 paginiCours - 9b - Les Liants (Mode de Compatibilité) BisMouhamed DIOUFÎncă nu există evaluări
- Eric C09 4.synthese de L'aspirineDocument4 paginiEric C09 4.synthese de L'aspirinebahijmalak4Încă nu există evaluări
- 4 Suivi D'une Transrormation ChimiqueDocument19 pagini4 Suivi D'une Transrormation ChimiqueMfO HaCkEr ViPÎncă nu există evaluări
- TD Oxydo-RedDocument4 paginiTD Oxydo-RedNesrıne BoumazaÎncă nu există evaluări
- DS 5Document4 paginiDS 5Houssam BenkerroumÎncă nu există evaluări