Documente Academic
Documente Profesional
Documente Cultură
Unidad II Cartas Entalpia Concentracion
Încărcat de
Lixy DaquilemaDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Unidad II Cartas Entalpia Concentracion
Încărcat de
Lixy DaquilemaDrepturi de autor:
Formate disponibile
UNIDAD II
CARTAS ENTALPIA CONCENTRACION
2017
MATERIA
INGENIERIA DE PROCESOS
NOVENO
NIVEL
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
UNIDAD II CARTAS ENTALPIA CONCENTRACION
2.1. INTRODUCCIÓN
Las cartas o gráficos de entalpia – concentración es un método grafico
adecuado para representar los datos de entalpia de una mezcla binaria. Si
existen disponibles, tales gráficos son útiles para los cálculos de balance
simultáneos de masa y energía, en las Operaciones Unitarias de Destilación,
Cristalización y todo tipo de aplicaciones de mezclado y separación, son
igualmente importantes.
En lo operativo, puede darse el caso que deban realizarse cálculos repetitivos
de balance simultaneo de masa y energía sobre un sistema binario dado, en
tal caso sería pertinente utilizar una carta de entalpia – concentración para el
sistema en mención.
Cuando no se disponen, la pregunta es., ¿En qué forma procedería a construir
dicha grafica?
2.2. CONSTRUCCIÓN DE UNA GRAFICA DE ENTALPÍA - CONCENTRACIÓN
Se sugiere seguir los siguientes pasos:
Elegir una base de cálculo, alguna cantidad dada de la mezcla, por lo
general 1 lb., o 1 lb-mol.
Elegir una temperatura de referencia. (ΔH0 = 0 a t0)
Suponiendo que la base de cálculo es 1 lb., describir un balance de energía
para soluciones de varias composiciones a diferentes temperaturas, así
tenemos:
∆Hmezcla= xA .∆HA + x B .∆HB + ∆H mezclado Ec. (1)
Donde:
∆Hmezcla entalpia de 1 lb., de mezcla.
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
∆HA, .∆HB entalpias de los componentes puros en relación con la
temperatura de referencia. (TrA ≠ TrB)
∆H mezclado calor de mezclado de la solución a la temperatura de
cálculo dado.
Para el caso común en el que ∆H mezclado se conoce a una sola
temperatura. (Usualmente 77 oF), se puede aplicar un procedimiento
modificado para determinar ∆Hmezcla.
2.3. CALCULO DE LA ENTALPÍA DE LA MEZCLA
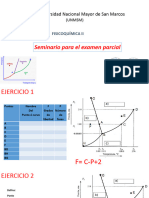
En base a la representación genérica de una Carta entalpia – concentración
fig., 2.3., para el cálculo de la entalpia de la mezcla, se debe proceder como:
La elección de la temperatura de referencia para los componentes A y B
del sistema de mezcla, ubican el dato de Entalpía Cero a cada lado del
diagrama de equilibrio.
Figura: 2.3. Diagrama de entalpia – concentración
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
De las tablas de entalpia, así como de las tablas de vapor o encontrando:
𝑇=77°𝐹
∆𝐻𝐴 − ∆𝐻𝐵 = ∫𝑇𝑜 𝐶𝑝𝐴. 𝑑𝑡 Ec. (2)
Se puede obtener ∆HA y ∆HB a 77 oF. Ahora se ubican los puntos A y B.
Si uno de los componentes es el agua, se elige 32 oF como t0, para utilizar
las tablas de vapor.
Cuando tenemos ∆HA y ∆HB a 77 oF, podemos calcular ∆Hmezcla a
77 oF con la Ec. (1).
Para varias mezclas, así como: 10% A y 90%B; 20% A y 80%B; etc.,
graficar el Hmezcla calculada como se muestra por los puntos C, D, E, y
así sucesivamente y conéctese esos puntos con unas línea continua.
Se puede determinar el Hmezcla a cualquier otra temperatura t, una
vez que se haya trazado la Isoterma de 77°F, haciendo de nuevo un
balance de entalpia, se tiene:
𝑇
∆Hmezcla a cualquier t = ∆𝐻𝑚𝑒𝑧𝑐𝑙𝑎 𝑎 77°𝐹 + ∫77°𝐹 𝐶𝑝𝑥. 𝑑𝑡 Ec. (3)
Dónde:
Cpx es la Capacidad Calorífica de la solución a la concentración x. (estas
capacidades deben determinarse en forma experimental, o también estimar).
Los puntos F, G, H, etc., se pueden determinar de esta manera para una
composición dada y luego cálculos adicionales a otras concentraciones
fijas darán puntos suficientes de tal forma que todas las ISOTERMAS se
puedan trazar hasta la línea del Punto de Burbuja para la mezcla a 1 at.,
de presión.
Para incluir la Región de Vapor en el diagrama se requiere de la siguiente
información:
El calor de vaporización de los componentes puros. (Para obtener los
puntos J y K)
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
La composición del vapor en equilibrio con una composición dada de
líquido. (Para obtener la línea de unión L-N; N-O, etc.)
Las temperaturas del Punto de Roció del vapor. (Para obtener las
Isotermas en la región del vapor)
Los calores de mezclado en la región del vapor, por lo regular
despreciables. (Para fijar los puntos M, O, etc., por medio de la ec., (1))
NOTA: En forma, alternativa, el calor de vaporización de una composición
dada podría utilizarse para fijar los puntos M, O, etc.
2.4. APLICACIÓN
En un proceso de Dilución Química, 100 lb., de una solución acuosa de NaOH
al 73 % en peso y medida a 350 °F. Se desea diluir hasta obtener una solución
del mismo electrolito, medido al 10 % en peso y 80°F ¿Cuántas lb., de agua
líquida a 80°F y sólida a 32°F se requieren, si de antemano en el sistema no se
dispone de un sistema de enfriamiento?
NOTA: Utilizar las tablas de vapor y la gráfica de entalpia-concentración, para
el sistema NaOH-H2O.
H2O liquida
B
Sol-acuo Sol-acuo
NaOH A PROCESOD D NaOH
350°F DILUCIÓN QUÍMICA 80°F
73% peso 10% peso
C
H2O solida
(Hielo)
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
Datos Adicionales:
De la Carta ΔH - concentración:
Sol-acuo T Ref. H
NaOH (°F) (BTU/lb)
% peso
73 350 468
10 80 42
De las Tablas de Vapor:
H 80°F = 48 BTU/lb. Agua liquida
H 32°F = -143 BTU/lb. Agua sólida.
Si aplicamos Balance de Masa al proceso, se tiene:
General: A+B+C = D
Si: B = C 100 lb + B = D
Referido a composición: A. xA = D. xD
100 lb x 0.73 = 0,10 x D D = 730 lb-sol acuo.
B Total H2O = (730 – 100) lb = 630 lb.-agua
Si aplicamos Balance de Energía al proceso, se tiene:
A. HA + B. HB + C. HC= D. HD
Si x = C Cantidad de agua solida
B = (630 – x) Cantidad de agua liquida
Remplazando datos en la ec., de balance se tiene:
𝐵𝑇𝑈 𝐵𝑇𝑈 𝐵𝑇𝑈 𝐵𝑇𝑈
100 𝑙𝑏 (468 ) + (630 − 𝑥) (48 ) + 𝑥 (−143 ) = 730 𝑙𝑏 (42 )
𝑙𝑏 𝑙𝑏 𝑙𝑏 𝑙𝑏
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
Resolviendo la igualdad, se tiene:
x = C = 243 lb. H2O-solida
B = (630 – 243) lb. = 387 lb. H2O-liquida
2.5. APLICACION
Para un proceso de Mezclado a 600 lb., de una solución acuosa de NaOH al
10% el peso y medida a 200°F, se adicionan exactamente 400lb., de una
solución acuosa de NaOH al 50% en peso y medida a la T de ebullición de la
misma.
Determinar:
a). La Temperatura final de la solución.
b). La Concentración final de la solución., y
c). La Cantidad de agua evaporada en el proceso.
De la Carta de entalpia – concentración para el sistema NaOH-H2O.
La T ebullición = T BURBUJA = 220 oF.
Sol-acuo A
NaOH
200°F 600 lb.
10% peso C
PROCESO T final=?
MEZCLADO % peso=?
Sol-acuo 400 lb.
NaOH
T ebullición
B
50% peso
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
Datos Adicionales:
De la Carta ΔH - concentración: para x = 0,5 la T ebullición = T burbuja es 220 oF
Sol-acuo T Ref. H
NaOH (°F) (BTU/lb)
% peso
10 200 152
50 220 290
Componente: Sol., al 10 % peso Sol., al 50 % peso Sol., final
Sol. A + Sol. B Sol. C
Soluto(NaOH) 60 lb. 200 lb. 260 lb. 26 % peso
Solvente(H2O) 540 lb. 200 lb. 740 lb.
600 lb. 400 lb. 1000 lb.
Concentración de la sol., final C = 26 % peso. (b)
Si aplicamos Balance de Energía al proceso, se tiene:
A. HA + B. HB = C. HC
Remplazando datos en la ec., de balance se tiene:
𝐵𝑇𝑈 𝐵𝑇𝑈
600 𝑙𝑏 𝑥 (152 ) + (400𝑙𝑏) 𝑥 (290 ) = 1000 𝑙𝑏 𝑥 ∆𝐻𝑐
𝑙𝑏 𝑙𝑏
𝐵𝑇𝑈
∆𝐻𝑐 = 207,2
𝑙𝑏
Sobre la gráfica entalpia – concentración para el sistema NaOH –H2O, para una
solución de:
x = 0,26 y
𝐵𝑇𝑈
ΔH = 207,2
𝑙𝑏
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
Encontraría que solo puede existir una mezcla de 2 fases de (1) de vapor
saturado y (2) otra de solución de NaOH-H2O al punto de ebullición.
Mediante interpolación, trazar la línea de unión (0,26; 207,2) Hágale paralelo
a las líneas de unión de 220 oF y 250 oF.
La temperatura final de acuerdo con la gráfica de entalpia, que es de 232 o F
(a).
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
Si aplicamos Balance de Energía para la cantidad de agua evaporada en el
proceso, se tiene:
ΔH agua –liquida = 175 BTU/ lb. A la TBurbuja ≈ 220 oF.
ΔH agua-vapor saturado = 1.158 BTU/ lb. A la TFinal de la solución de 232 o F.
Si x = Cantidad de agua – evaporada, se tiene:
𝐵𝑇𝑈 𝐵𝑇𝑈 𝐵𝑇𝑈
x. (1.158 ) + (1.000 – x). 175 = 1.000 lb. (207,2 )
𝑙𝑏 𝑙𝑏 𝑙𝑏
Resolviendo para x, se tiene:
983 x = 32.200 lb.
x = Cantidad agua – evaporada = 32,8 lb. (c).
Mva/dv.
Ingeniería de Procesos IX Nivel Carrera de Ingeniería Química
S-ar putea să vă placă și
- Problemas Resueltos de BalanceDocument60 paginiProblemas Resueltos de BalanceEric Ceballos50% (6)
- Problemas resueltos de Hidráulica de CanalesDe la EverandProblemas resueltos de Hidráulica de CanalesEvaluare: 4.5 din 5 stele4.5/5 (7)
- CONCENTRACIÓN DE SOLUCIÓNDocument46 paginiCONCENTRACIÓN DE SOLUCIÓNNavoxjn63% (8)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe la EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSEvaluare: 4.5 din 5 stele4.5/5 (7)
- Diagramas de Entalpia ComposicionDocument24 paginiDiagramas de Entalpia ComposicionCharly Balderas100% (1)
- Ejercicios Sobre La Primera Ley de La Termodinámica-2018Document23 paginiEjercicios Sobre La Primera Ley de La Termodinámica-2018David AriasÎncă nu există evaluări
- Repaso Equilibrio QuímicoDocument2 paginiRepaso Equilibrio QuímicoElMaharajaÎncă nu există evaluări
- Termo Ejercicios DRDDocument8 paginiTermo Ejercicios DRDnicolnicolova1Încă nu există evaluări
- Sustentacion Escrita-Evaporacion-Grupo DDocument7 paginiSustentacion Escrita-Evaporacion-Grupo DsergiosanuelmpÎncă nu există evaluări
- PI135A - Evaporación - Grupo C - Sustentación EscritaDocument4 paginiPI135A - Evaporación - Grupo C - Sustentación EscritaDaniel Alejandro Quispe CaballeroÎncă nu există evaluări
- Determinación de flujos de calor y entalpía en evaporador de azúcarDocument6 paginiDeterminación de flujos de calor y entalpía en evaporador de azúcarsergiosanuelmpÎncă nu există evaluări
- 04 Problemas-Entalpia ComposicionDocument27 pagini04 Problemas-Entalpia ComposicionFrancisco MartinezÎncă nu există evaluări
- QA Cuestionario3Document3 paginiQA Cuestionario3Resendiz Daniel LissetÎncă nu există evaluări
- Preguntas Tipo para El Examen Parcial de Fisicoquimica IIDocument35 paginiPreguntas Tipo para El Examen Parcial de Fisicoquimica IIAyudaFIQ-SMÎncă nu există evaluări
- Qa Guia Tercer ParcialDocument4 paginiQa Guia Tercer ParcialDiego SotresÎncă nu există evaluări
- Simulacro Examen FinalDocument1 paginăSimulacro Examen FinalDaniel RojasÎncă nu există evaluări
- I. Tabulacion de Datos Y ResultadosDocument15 paginiI. Tabulacion de Datos Y ResultadosMario Salas PastorÎncă nu există evaluări
- Parcial 2 PDFDocument50 paginiParcial 2 PDFLizeth Maria lizarazoÎncă nu există evaluări
- Anexo 2Document11 paginiAnexo 2Juan Pablo GarantivaÎncă nu există evaluări
- Informe 7 FisicoquimicaDocument9 paginiInforme 7 FisicoquimicaDaniel KStilloÎncă nu există evaluări
- Estados de agregación y concentraciones físicas y químicasDocument11 paginiEstados de agregación y concentraciones físicas y químicasJenni LoperaÎncă nu există evaluări
- Destilacion FraccionadaDocument11 paginiDestilacion FraccionadaLaura CastroÎncă nu există evaluări
- Serie 1Document2 paginiSerie 1Olaya Castaño CotoÎncă nu există evaluări
- Practica 3 de Rectificacion Continua (Desti)Document22 paginiPractica 3 de Rectificacion Continua (Desti)CésarÎncă nu există evaluări
- Guía de Termoquímica y Eq QcoDocument3 paginiGuía de Termoquímica y Eq QcomonserratÎncă nu există evaluări
- FINAL Fis Quim II 21 IDocument2 paginiFINAL Fis Quim II 21 IVICTOR ENRIQUE QUISPE SAMANEZÎncă nu există evaluări
- BMyE Con Cambio de Fase Evap-TDDocument19 paginiBMyE Con Cambio de Fase Evap-TDFrancisco CaneloÎncă nu există evaluări
- Bitacora 5 Termo Frausto Sánchez KarlaDocument12 paginiBitacora 5 Termo Frausto Sánchez Karlakarla fraustoÎncă nu există evaluări
- Taller TermodinámicaDocument1 paginăTaller TermodinámicaAlejandro PerezÎncă nu există evaluări
- Actividades Unidad TermoquímicaDocument8 paginiActividades Unidad Termoquímicamariequi47Încă nu există evaluări
- Quimica GeneralDocument13 paginiQuimica Generaldahiton epinayuÎncă nu există evaluări
- Diagramas de Entalpia ComposicionDocument26 paginiDiagramas de Entalpia ComposicionJesus NMÎncă nu există evaluări
- Laboratorio 6. Calor Diferencial de SoluciónDocument11 paginiLaboratorio 6. Calor Diferencial de SoluciónDIAM 57Încă nu există evaluări
- Examen Principal - FisicoquímicaDocument2 paginiExamen Principal - FisicoquímicaMishell Heredia BenalcázarÎncă nu există evaluări
- Determinación Del Punto de Fusión y de Ebullición de Una Sustancia PuraDocument10 paginiDeterminación Del Punto de Fusión y de Ebullición de Una Sustancia PuraYuli cerveraÎncă nu există evaluări
- PC3 2013-0 - ChongDocument10 paginiPC3 2013-0 - Chongmiguel EncarnacionÎncă nu există evaluări
- Tarea 1 Termo I 2021Document3 paginiTarea 1 Termo I 2021Bladi MamaniÎncă nu există evaluări
- TERMODINAMICA QUIMICADocument19 paginiTERMODINAMICA QUIMICAJ.s. CobarrubiasÎncă nu există evaluări
- 7645guía05 2C19Document6 pagini7645guía05 2C19Diego GuerraÎncă nu există evaluări
- Equilibrio Químico - Constante de AcidezDocument3 paginiEquilibrio Químico - Constante de AcidezAlejandro Garcia GarciaÎncă nu există evaluări
- Taller de Repaso Equilibrio Químico (Constante, PH y Disoluciones Amortiguadoras)Document6 paginiTaller de Repaso Equilibrio Químico (Constante, PH y Disoluciones Amortiguadoras)stevan Benavides PardoÎncă nu există evaluări
- Presión vapor líquidosDocument4 paginiPresión vapor líquidosMercedes Milla PascacioÎncă nu există evaluări
- EntalpíaDocument13 paginiEntalpíaMarcela SolizÎncă nu există evaluări
- Taller 13 EquilibrioDocument3 paginiTaller 13 EquilibrioLuis Fernando vega ReyÎncă nu există evaluări
- Destilacion Por Arrastre de VaporDocument5 paginiDestilacion Por Arrastre de VaporCarolina ValdiviezoÎncă nu există evaluări
- Práctica N°8. Determinación Del Calor de NeutralizaciónDocument3 paginiPráctica N°8. Determinación Del Calor de NeutralizaciónMARIA FERNANDA CARO FONSECAÎncă nu există evaluări
- Ej Tema 4Document2 paginiEj Tema 4Adrián Méndez BenítezÎncă nu există evaluări
- Preparacion de Selectividad Term Velocidad de Reaccion EquilibrioDocument5 paginiPreparacion de Selectividad Term Velocidad de Reaccion EquilibrioITZIAR DOMEC RUIZÎncă nu există evaluări
- Ejercicios TermoquímicaDocument4 paginiEjercicios TermoquímicaClarita393Încă nu există evaluări
- TermodinamicaDocument5 paginiTermodinamicaSantos Osorio LeidyÎncă nu există evaluări
- Examen Sustitutorio 2020-1Document3 paginiExamen Sustitutorio 2020-1owen ricardo llacsahuanga vegasÎncă nu există evaluări
- TPN°1 - Gases Ideales - Sustancias PurasDocument3 paginiTPN°1 - Gases Ideales - Sustancias PurasMatias Daniel LimaÎncă nu există evaluări
- Sustentación Escrita Grupo BDocument6 paginiSustentación Escrita Grupo BrosaÎncă nu există evaluări
- Coligativas y EquilibrioDocument5 paginiColigativas y EquilibrioRoxana Riobueno ValdesÎncă nu există evaluări
- Segundo Examen Parcial de Fisicoquimica PDFDocument3 paginiSegundo Examen Parcial de Fisicoquimica PDFJordan PuenteÎncă nu există evaluări
- TPN°1 - Gases Ideales - Sustancias PurasDocument3 paginiTPN°1 - Gases Ideales - Sustancias PurasEvynec AlvaradoÎncă nu există evaluări
- PI135A B Evaporación SEDocument6 paginiPI135A B Evaporación SELjubenko GagliuffiÎncă nu există evaluări
- Ingeniería química. Soluciones a los problemas del tomo IDe la EverandIngeniería química. Soluciones a los problemas del tomo IÎncă nu există evaluări
- Reacciones CataliticasDocument1 paginăReacciones CataliticasLixy DaquilemaÎncă nu există evaluări
- Tecnica SecadoDocument16 paginiTecnica SecadoLixy DaquilemaÎncă nu există evaluări
- Jesy y LisDocument35 paginiJesy y LisLixy DaquilemaÎncă nu există evaluări
- Celdas Combustibles de Acido FosforicoDocument9 paginiCeldas Combustibles de Acido FosforicoLixy DaquilemaÎncă nu există evaluări
- Escuela Superior Politécnica Del ChimborazoDocument2 paginiEscuela Superior Politécnica Del ChimborazoLixy DaquilemaÎncă nu există evaluări
- Clases de Sistemas de ProducciónDocument4 paginiClases de Sistemas de ProducciónMakliber AlfaroÎncă nu există evaluări
- Tecnica SecadoDocument16 paginiTecnica SecadoLixy DaquilemaÎncă nu există evaluări
- Presentación 1Document28 paginiPresentación 1Lixy DaquilemaÎncă nu există evaluări
- Computacion Metodos AbiertosDocument11 paginiComputacion Metodos AbiertosLixy DaquilemaÎncă nu există evaluări
- Capítulo 5Document14 paginiCapítulo 5Andreéita SaDiÎncă nu există evaluări
- Computacion Metodos AbiertosDocument11 paginiComputacion Metodos AbiertosLixy DaquilemaÎncă nu există evaluări
- CalorimetriaDocument2 paginiCalorimetriaMIGUEL ANGEL ONOFRE FLORESÎncă nu există evaluări
- Expocision Fundición Gris 2022Document23 paginiExpocision Fundición Gris 2022Meday BaltodanoÎncă nu există evaluări
- Exposicion de PabloDocument29 paginiExposicion de PabloelianÎncă nu există evaluări
- Investigación Pandeo en ColumnasDocument4 paginiInvestigación Pandeo en ColumnasJose VergaraMstÎncă nu există evaluări
- TEMA 3 - Segunda y Tercera Leyes de La TermodinamicaDocument53 paginiTEMA 3 - Segunda y Tercera Leyes de La TermodinamicaAnonymous yEGP9hnÎncă nu există evaluări
- Varillas de Bombeo MecanicoDocument8 paginiVarillas de Bombeo Mecanicovictor JavierÎncă nu există evaluări
- Informe 9 Experimento de Clement y DesormesDocument9 paginiInforme 9 Experimento de Clement y DesormesMauricio Rojas BravoÎncă nu există evaluări
- Viscosimetro de Esfera en Caida LibreDocument18 paginiViscosimetro de Esfera en Caida LibreYunuen TorresÎncă nu există evaluări
- ICM CAPITULO VIII Materiales para Ingeniería AcerosDocument66 paginiICM CAPITULO VIII Materiales para Ingeniería AcerosJulio Enrique Salazar LopezÎncă nu există evaluări
- Estructura Fisica de Los MaterialesDocument77 paginiEstructura Fisica de Los MaterialesDanilo AltamiranoÎncă nu există evaluări
- Tesis Bianchi (Hematita)Document139 paginiTesis Bianchi (Hematita)Alejandro HerreraÎncă nu există evaluări
- Clasificacion de Los Materiales GeneralidadesDocument2 paginiClasificacion de Los Materiales GeneralidadesVerónica ArroyoÎncă nu există evaluări
- Tuneles de Viento en Onera, NLR y DNWDocument3 paginiTuneles de Viento en Onera, NLR y DNWJose Maria Lopez PedregalÎncă nu există evaluări
- Ecuación de Difusividad de Fluidos en Medios Porosos Compresibles, Ligeramente e IncomprensiblesDocument16 paginiEcuación de Difusividad de Fluidos en Medios Porosos Compresibles, Ligeramente e IncomprensiblesJosé M. GómezÎncă nu există evaluări
- Introducción A Calor y TemperaturaDocument3 paginiIntroducción A Calor y Temperaturasofiac22Încă nu există evaluări
- 02 - Tratamientos Térmicos en AcerosDocument17 pagini02 - Tratamientos Térmicos en AcerosCarlos BeltranÎncă nu există evaluări
- Ensayo de CompresionDocument23 paginiEnsayo de Compresionzephiroth20070% (1)
- Lab 5 Carga y Descarga de Un CapacitorDocument11 paginiLab 5 Carga y Descarga de Un CapacitorDavid JoelÎncă nu există evaluări
- Gas RealDocument17 paginiGas RealEsme PilcoÎncă nu există evaluări
- Bfde U2 A1 KarvDocument3 paginiBfde U2 A1 KarvKaren Reyes VÎncă nu există evaluări
- Tema - Foro - Desarrollo Del Trabajo - Semanas 3, 4 y 5 Fluidos y TermondinamicaDocument11 paginiTema - Foro - Desarrollo Del Trabajo - Semanas 3, 4 y 5 Fluidos y TermondinamicaGermán CastroÎncă nu există evaluări
- Tipos de EnlacesDocument13 paginiTipos de EnlacesGENESIS KARISMA LIZARRAGA DIAZÎncă nu există evaluări
- LAB-Fís II GUÍA No.1Document4 paginiLAB-Fís II GUÍA No.1ThuKamiSan MartinÎncă nu există evaluări
- Sistemas TermodinámicosDocument2 paginiSistemas TermodinámicosYair Fonseca AvilaÎncă nu există evaluări
- LTC 14 02 3 PDFDocument8 paginiLTC 14 02 3 PDFChoko GarciaÎncă nu există evaluări
- Reporte Practica 7Document8 paginiReporte Practica 7Miguel RamírezÎncă nu există evaluări
- Deformación VidaDocument4 paginiDeformación VidaLuis Enrique GonzálezÎncă nu există evaluări
- Diseño de horno de inducción para laminación continua de aceroDocument30 paginiDiseño de horno de inducción para laminación continua de acerooscar lucio escobarÎncă nu există evaluări
- Informe Química Enlaces Quimicos 1Document8 paginiInforme Química Enlaces Quimicos 1acsa torres vasquezÎncă nu există evaluări
- Manual Técnico Termopanel Ed 2012Document21 paginiManual Técnico Termopanel Ed 2012arqfredo001Încă nu există evaluări