Documente Academic
Documente Profesional
Documente Cultură
Características de Ácidos y Bases
Încărcat de
Ana Elena Betancourt BucheliDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Características de Ácidos y Bases
Încărcat de
Ana Elena Betancourt BucheliDrepturi de autor:
Formate disponibile
Características de Ácidos y Bases
Inicio » Química » Características de Ácidos y Bases
Autor: Redacción Ejemplode.com, año 2017
Se denominan como bases y ácidos a las substancias químicas que se
encuentran en la naturaleza, de las cuales el hombre ha aprendido a
utilizarlas a lo largo de los siglos, llegando a utilizarla en su vida cotidiana,
tanto para procesos diversos como para la preparación de los alimentos.
Bases.- Se considera como base química a las substancias que pueden
tanto proporcionar electrones así como captar electrones, estas substancias
cuentan con un Ph mayor a 7, y al mezclarse con algunos ácidos, producen
sales, las cuales tienen una serie de sabores característicos.
Ácidos.- Los ácidos son substancias que cuentan con una concentración
elevada de iones de hidrógeno, esta clasificación se basa en que el ph
normal en el agua es de 7 y todo compuesto con un ph inferior a esta
medida es considerada ácido.
Característicasa de los ácidos y las báses:
1.- Clasificación.- La diferencia entre un ácido y una base es mediante una
clasificación, la cual se obtiene por el número de iones que contenga, lo que
hace que se determine a través de su nivel de pH, las diversas sustancias
químicas que existen son medidas para determinar si pertenecen a los
ácidos o a las sustancias alcalinas, mediante la escala de pH, (esta escala
determina la acidez o alcalinidad de una sustancia química, midiendo la
concentración de iones hidronio de la sustancia que se mide, teniendo como
punto de partida de la escala al agua, cuya acidez o alcalinidad corresponde
a 7, en esta escala, lo que se determina como neutro). En base a esta
medida del agua (7 = a neutro), se toman como bases o álcalis a las
sustancias que posean un número superior a 7 dentro de esta escala y
como sustancias acidas a las sustancias que posean un número inferior a 7
en esta misma escala.
2.- Neutralización.- Una de las características de los ácidos y las bases, es
que se neutralizan cuando se combinan químicamente, así se pueden
neutralizar ácidos mediante el uso de bases.
Características de las bases:
1.- Las bases.- Estas substancias tienen un pH superior a 7, lo que hace
que las que se encuentran en un margen superior a 7 y que llegue a 14 son
considerados bases.
Los metales alcalinos y los alcalinotérreos están formados de elementos
como el magnesio, calcio, potasio o el sodio, y son altamente solubles en
agua formando sustancias de consistencia jabonosa.
2.- Absorben protones.- Las sustancias básicas o alcalinas juntan o
absorben los protones que se encuentren libres en una solución, a
diferencia de los ácidos que tienen el efecto contrario, que es liberar
protones.
3.- Metales y sustancias alcalinas.- Consistencia y Propiedades
Cáusticas, al ser disueltos en agua tienden a tomar una consistencia
jabonosa, misma que le da facilidad para deslizarse por la piel, es una de
las razones por las que sustancias básicas han sido usadas desde la
antigüedad para productos de limpieza junto con algunas otras propiedades,
como la de disolver sustancias orgánicas como la mugre que es retirada al
lavar la ropa o al bañarse o al destapar tuberías mediante el uso de sosa
cáustica, los niveles de causticidad dependen de la sustancia en específico,
por ejemplo la capsina contenida en plantas como el chile es una sustancia
cáustica irritante, que provoca sensación de picor al comerla, pero
generalmente no es peligrosa, en cambio muchas otras bases son
peligrosas pues producen quemaduras químicas al entrar en contacto con la
piel o en casos de presentarse sales en polvo al ser inaladas.
4.- Sabor alcalino.- Gran variedad de las sustancias denominadas base,
poseen un sabor alcalino similar al del jabón o tienden a ser amargos.
5Cambian la coloración de papel tornasol.- Las sustancias alcalinas o
bases, al entrar en contacto con el papel tornasolado cambian el color de
este a tonos azules verdosos incrementándose la coloración azul conforme
tengan un pH más elevado.
6.- Se presentan en tres de los estados de la materia.- Se encuentran en
estado sólido, en soluciones líquidas y en forma de gases como el cloro
gaseoso.
7.- Algunos ejemplos de bases:
Óxido de calcio, hidróxido de potasio, sal común, sosa cáustica, capsina,
ácido
Hidróxido de aluminio
Hidróxido de bario
Hidróxido de calcio
Hidróxido de cobre
Hidróxido de hierro
Hidróxido de magnesio
Hidróxido de potasio
Hidróxido de sodio
Hidróxido de titanio
Hidróxido de zinc.
Características de los ácidos:
7.- Liberación de protones.- Los ácidos reaccionan liberando protones
dentro de una solución en la cual el ácido se encuentre disuelto. En los
ácidos minerales el hidrógeno tiende a combinarse con metales y
metaloides, mientras que los hidrácidos son formados con la unión de
hidrógeno con minerales no metálicos y con el azufre.
8.- Acritud o sabor ácido.- Al ser probados tienen un sabor picante o agrio
(el llamado “sabor Ácido”), ejemplo de ello son el ácido cítrico de limones,
naranjas, toronjas, chiles, mandarinas y guayabas, así como el ácido
ascórbico (Vitamina C).
9.- Son corrosivos.- Los ácidos atacan electroquímicamente a distintas
sustancias de manera que las corroen, por ejemplo el ácido sulfúrico que
actúa corroyendo diversas sustancias entre las que se cuentan gran
variedad de sustancias orgánicas e inorgánicas, como es el caso de la
mayoría de los metales.
10.- Se presentan en tres de los estados de la materia.- Se encuentran
principalmente en estado líquido y gaseoso aunque se pueden encontrar en
estado sólido como es el caso del ácido benzoico.
11.- Consistencia aceitosa.- Tanto los ácidos orgánicos como inorgánicos
tienden a tener una consistencia aceitosa característica.
12.- Cambian la coloración del papel tornasol.- Los ácidos reaccionan
con el papel tornasol cambiando el color del mismo a un tono rojizo,
anaranjado o magenta, dependiendo del pH del ácido que sea medido.
Algunos ejemplos de ácidos:
Acetilsalicílico
Ácido acético
Ácido Bromhidrico HBr
Ácido Carbónico H2CO3
Ácido clórico HCLO3
Ácido Cloroso HClO2
Ácido Fluorhídrici HF
Ácido fluórico HFO3
Ácido fluoroso HFO2
Ácido Hipocloroso HClO
Ácido Hipofluoroso HFO
Ácido Nítrico HNO3
Ácido Nitroso HNO2
Ácido Perclórico HClO4
Ácido Perfluórico HFO4
Ácido Sulfhídrico H2S
Ácido Sulfúrico H2SO4
Ácido Sulfuroso H2SO3
Ácido Fórmico
Ácido Sulfúrico
S-ar putea să vă placă și
- Algunas de Las Características Que Poseen Los Ácidos y Las BasesDocument5 paginiAlgunas de Las Características Que Poseen Los Ácidos y Las BasesJeff HubbardÎncă nu există evaluări
- Óxidos Ácidos y Óxidos BásicosDocument10 paginiÓxidos Ácidos y Óxidos BásicosDaianaÎncă nu există evaluări
- Ácidos y BasesDocument7 paginiÁcidos y BasesibethÎncă nu există evaluări
- Informe de Laboratorio de BioquimicaDocument13 paginiInforme de Laboratorio de BioquimicaJhuliana VasquezÎncă nu există evaluări
- Acidos y Bases 2d0Document4 paginiAcidos y Bases 2d0Daniel CiprianÎncă nu există evaluări
- Informe de QuimicaDocument8 paginiInforme de QuimicaXiomara Intor67% (6)
- Qué Es El PHDocument4 paginiQué Es El PHGladys Maya100% (1)
- Acidos Word 1Document10 paginiAcidos Word 1Marvin Fabian Valderrama MoralesÎncă nu există evaluări
- Conceptos Básicos de Los Ácidos y Las BasesDocument4 paginiConceptos Básicos de Los Ácidos y Las BasesjassonÎncă nu există evaluări
- AcidoDocument8 paginiAcidoculonicoÎncă nu există evaluări
- Guia de Quimica Clei 5 - Acidos y BasesDocument4 paginiGuia de Quimica Clei 5 - Acidos y BasesYadira Valancia AlvarezÎncă nu există evaluări
- Ácidos Bases PHDocument7 paginiÁcidos Bases PHbaquetasdeoroÎncă nu există evaluări
- La Lluvia Ácida y La Escala de PHLa Escala de PH Mide El Grado de Acidez de Un ObjetoDocument8 paginiLa Lluvia Ácida y La Escala de PHLa Escala de PH Mide El Grado de Acidez de Un Objetopaula bonillaÎncă nu există evaluări
- Actividad Experimental 4Document12 paginiActividad Experimental 4Jesus Yair Cruz AguilarÎncă nu există evaluări
- Acidos Base y El Acido NucleicoDocument18 paginiAcidos Base y El Acido NucleicoFernando GutierrezÎncă nu există evaluări
- Ácidos y Bases, PH en Nuestra Vida CotidianaDocument5 paginiÁcidos y Bases, PH en Nuestra Vida CotidianaDIEGO SANTIAGO OLVERAÎncă nu există evaluări
- CN Grado 9° - Periodo 3Document22 paginiCN Grado 9° - Periodo 3Neyla Janneth Moreno GonzálezÎncă nu există evaluări
- AcidoDocument10 paginiAcidoMARIA JOSE MARTELO RIZOÎncă nu există evaluări
- TiteresDocument4 paginiTiteresNicole Angélica Tipian RafaelÎncă nu există evaluări
- Ácidos y BasesDocument6 paginiÁcidos y BasesAÎncă nu există evaluări
- Ácido-Base QUIMICADocument23 paginiÁcido-Base QUIMICAErickÎncă nu există evaluări
- Ácidos y BasesDocument11 paginiÁcidos y BasesJade VázquezÎncă nu există evaluări
- Acidos y BasesDocument12 paginiAcidos y BasesAndrea FernandezÎncă nu există evaluări
- Modulo 15 - TEMASDocument57 paginiModulo 15 - TEMASMaría Díaz AguilarÎncă nu există evaluări
- Proyecto FinalDocument8 paginiProyecto FinalMagali FloresÎncă nu există evaluări
- PeñalozaConstantino Karla M15S1AI1Document25 paginiPeñalozaConstantino Karla M15S1AI1Karla PeñaÎncă nu există evaluări
- Quimica 6 1Document12 paginiQuimica 6 1Allison ZumaetaÎncă nu există evaluări
- Propiedades y Características de Ácidos y GasesDocument7 paginiPropiedades y Características de Ácidos y GasesJosefina MejiaÎncă nu există evaluări
- Acidos y BasesDocument8 paginiAcidos y BasesyhuillcamÎncă nu există evaluări
- Laboratorio de PH CaseroDocument4 paginiLaboratorio de PH Caserojuan sebastian cortes castroÎncă nu există evaluări
- Los Usos de Ácidos y Sus BasesDocument9 paginiLos Usos de Ácidos y Sus BasesAlicia Morales50% (4)
- QuimicaDocument8 paginiQuimicaAlejandro LópezÎncă nu există evaluări
- PH Es Una Medida de La Acidez o Alcalinidad de Una SoluciónDocument10 paginiPH Es Una Medida de La Acidez o Alcalinidad de Una SoluciónLorena sumoza rodriguezÎncă nu există evaluări
- Exposición de Ácidos y BasesDocument9 paginiExposición de Ácidos y BasesEDWIN GUSQUIÎncă nu există evaluări
- Informe #10Document9 paginiInforme #10Katherin ValdanoÎncă nu există evaluări
- Indicador de Repollo MoradoDocument18 paginiIndicador de Repollo MoradoVanessa Molina50% (6)
- INFORME DE LABORATORIO Corte 2Document6 paginiINFORME DE LABORATORIO Corte 2vanessa alejandra imbachi gonzalesÎncă nu există evaluări
- 5to 11 Indicador Natural TPN°10Document5 pagini5to 11 Indicador Natural TPN°10Javy EspíndolaÎncă nu există evaluări
- Acidos y BasesDocument15 paginiAcidos y BasesJohanna Rivera RodriguezÎncă nu există evaluări
- Reporte de Laboratorio. Acidos Bases e Indicadores. LICCDocument11 paginiReporte de Laboratorio. Acidos Bases e Indicadores. LICCLuis I Che ChanÎncă nu există evaluări
- ÁcidoDocument9 paginiÁcidocarlos ochoaÎncă nu există evaluări
- Acidos y BasesDocument10 paginiAcidos y BasesEdmundo Venegas GaytanÎncă nu există evaluări
- Actividad 1 El Valor de PH de Disoluciones de Uso CotidianoDocument7 paginiActividad 1 El Valor de PH de Disoluciones de Uso Cotidianojacqueline López Gutiérreez 3 DÎncă nu există evaluări
- Informe de Laboratorio Quimica 3er PeriodoDocument15 paginiInforme de Laboratorio Quimica 3er Periododana pirabanÎncă nu există evaluări
- Ácidos y Bases PDFDocument6 paginiÁcidos y Bases PDFGomez YadiÎncă nu există evaluări
- Laboratorio de PHDocument4 paginiLaboratorio de PHjuan sebastian cortes castroÎncă nu există evaluări
- Experimento de Cido y BasesDocument15 paginiExperimento de Cido y BasesNajeth CamarenaÎncă nu există evaluări
- Acido BaseDocument23 paginiAcido Basesheyla perez llantoÎncă nu există evaluări
- Acido y BaseDocument6 paginiAcido y BaseElio barrios ibarraÎncă nu există evaluări
- Acidos y BasesDocument5 paginiAcidos y BasesLilia AnVeÎncă nu există evaluări
- Informe de LaboratorioDocument10 paginiInforme de Laboratoriomariana foreroÎncă nu există evaluări
- Laboratorio de Química N.º 5Document11 paginiLaboratorio de Química N.º 5Eduardo Aldair ArceÎncă nu există evaluări
- LiraSánchez YeseniaBerenice M15S1AI1.Document9 paginiLiraSánchez YeseniaBerenice M15S1AI1.Jess SánchezÎncă nu există evaluări
- Química 26-01-24 HHDocument5 paginiQuímica 26-01-24 HHOliver MatusÎncă nu există evaluări
- Práctica 6Document3 paginiPráctica 6Giovana Barbara Aguilar MamaniÎncă nu există evaluări
- Practica 1. Obtención de Óxidos y Caracterización Ácido BaseDocument16 paginiPractica 1. Obtención de Óxidos y Caracterización Ácido BaseRubén VeraÎncă nu există evaluări
- Fabricación Casera de Un Indicador AcidoDocument3 paginiFabricación Casera de Un Indicador AcidoPablo Martin FagundezÎncă nu există evaluări
- Reporte Acidos y BasesDocument7 paginiReporte Acidos y BasesJosue Martinez100% (2)
- RezaGonzalez Luis Miguel M14S3AI5Document9 paginiRezaGonzalez Luis Miguel M14S3AI5Laura FloresÎncă nu există evaluări
- Caracteristicas Anomalas Del Agua Lectura PDFDocument3 paginiCaracteristicas Anomalas Del Agua Lectura PDFAna Elena Betancourt Bucheli0% (1)
- 1 ESTEQUIOMETRIA y DISOLUCIONES PDFDocument5 pagini1 ESTEQUIOMETRIA y DISOLUCIONES PDFAntonio Flores RiveraÎncă nu există evaluări
- 6.3 - Ácidos y Bases - Problemas Resueltos de Acceso A La Universidad (Ii)Document62 pagini6.3 - Ácidos y Bases - Problemas Resueltos de Acceso A La Universidad (Ii)rosana_quesada100% (14)
- Calculo de Moléculas EjerciciosDocument4 paginiCalculo de Moléculas EjerciciosAna Elena Betancourt BucheliÎncă nu există evaluări
- Ejercicios Configuración ElectrónicaDocument1 paginăEjercicios Configuración Electrónicaclaveromat88% (65)
- Ejercicios Resueltos PPM y %Document3 paginiEjercicios Resueltos PPM y %Ana Elena Betancourt Bucheli83% (6)
- Estructura de LewisDocument1 paginăEstructura de LewisAna Elena Betancourt BucheliÎncă nu există evaluări
- Densidad Temperatura Materia y EnergiaDocument22 paginiDensidad Temperatura Materia y EnergiaAna Elena Betancourt BucheliÎncă nu există evaluări
- % y PPM Unidades Fisicas de ConcentracionDocument3 pagini% y PPM Unidades Fisicas de ConcentracionAna Elena Betancourt BucheliÎncă nu există evaluări
- SOLUCIONESDocument22 paginiSOLUCIONESLaura ValloraniÎncă nu există evaluări
- Contaminacion AmbientalDocument13 paginiContaminacion AmbientalAna Elena Betancourt BucheliÎncă nu există evaluări
- Síndrome MetabólicoDocument27 paginiSíndrome MetabólicoAna Elena Betancourt BucheliÎncă nu există evaluări
- Contaminacion AmbientalDocument13 paginiContaminacion AmbientalAna Elena Betancourt BucheliÎncă nu există evaluări
- Cuader Bio 4 NewDocument36 paginiCuader Bio 4 NewAlfredo Bautista HernándezÎncă nu există evaluări
- 2 SeparacionMezclasDocument2 pagini2 SeparacionMezclasAbelardoGomezArevalo100% (1)
- Enlace Quimico ApuntesDocument4 paginiEnlace Quimico ApuntesAna Elena Betancourt BucheliÎncă nu există evaluări
- ATMOSFERADocument6 paginiATMOSFERAAna Elena Betancourt BucheliÎncă nu există evaluări
- Acido BaseDocument11 paginiAcido BaseAna Elena Betancourt BucheliÎncă nu există evaluări
- Conversiones, Mur, Mrua y Caída LibreDocument1 paginăConversiones, Mur, Mrua y Caída LibreAna Elena Betancourt BucheliÎncă nu există evaluări
- Contador de EstrellasDocument1 paginăContador de EstrellasAna Elena Betancourt BucheliÎncă nu există evaluări
- Acido BaseDocument11 paginiAcido BaseAna Elena Betancourt BucheliÎncă nu există evaluări
- Manual Acidos y BasesDocument9 paginiManual Acidos y BasesAna Elena Betancourt BucheliÎncă nu există evaluări
- Fases de La LunaDocument6 paginiFases de La LunaAna Elena Betancourt BucheliÎncă nu există evaluări
- Conversiones, Mur, Mrua y Caída LibreDocument1 paginăConversiones, Mur, Mrua y Caída LibreAna Elena Betancourt BucheliÎncă nu există evaluări
- Acido Base Unidad DidacticaDocument10 paginiAcido Base Unidad DidacticaAna Elena Betancourt BucheliÎncă nu există evaluări
- 3 EnlacequimicoDocument61 pagini3 EnlacequimicoAna Elena Betancourt BucheliÎncă nu există evaluări
- Elsonido H1Document1 paginăElsonido H1Ana Elena Betancourt BucheliÎncă nu există evaluări
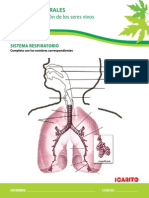
- A. Respitatorio EsquemasDocument2 paginiA. Respitatorio EsquemasAna Elena Betancourt BucheliÎncă nu există evaluări
- Acidos y Bases ApuntesDocument14 paginiAcidos y Bases ApuntesAna Elena Betancourt BucheliÎncă nu există evaluări
- El OlfatoDocument4 paginiEl OlfatoFabian SepulvedaÎncă nu există evaluări
- Unidad 2 - El Mercado, El Producto y La Cultura Del Consumidor PDFDocument12 paginiUnidad 2 - El Mercado, El Producto y La Cultura Del Consumidor PDFolman fernandez MejiaÎncă nu există evaluări
- INFORME 2 BioquimmicaDocument5 paginiINFORME 2 BioquimmicaEduardo Jose Lopez EspañolÎncă nu există evaluări
- Aserrin Transformacion Hidroliticas Biomasa 230708Document30 paginiAserrin Transformacion Hidroliticas Biomasa 230708Iván GilÎncă nu există evaluări
- ZR L M DerechoDocument201 paginiZR L M DerechoJESUS ADRIAN HINOJOSA SANCHEZÎncă nu există evaluări
- Evaluacion TransmisonDocument5 paginiEvaluacion TransmisonRodrigo LopezÎncă nu există evaluări
- Modelo de Silabo Lemm 2014Document8 paginiModelo de Silabo Lemm 2014Paulino Humberto Jave ChicloteÎncă nu există evaluări
- Deficiencia de MCH 1Document16 paginiDeficiencia de MCH 1Fernando OviedoÎncă nu există evaluări
- Resumen Todo MusculosDocument65 paginiResumen Todo MusculosClaudia NievesÎncă nu există evaluări
- HazopDocument6 paginiHazopNatalia PerelloÎncă nu există evaluări
- Las Briofitas y Las TraqueofitasDocument4 paginiLas Briofitas y Las TraqueofitasCasimiro Luengo50% (2)
- 3era Asignacion-Problemas - Cojinetes Con Contacto de Rodadura.Document6 pagini3era Asignacion-Problemas - Cojinetes Con Contacto de Rodadura.JesusDiFabioÎncă nu există evaluări
- Ejercicio 05 Transportacion TuristicaDocument2 paginiEjercicio 05 Transportacion TuristicaRicardo Dzacun EstrellaÎncă nu există evaluări
- Anexo-Fase 2 - Grupo403026 - 14Document20 paginiAnexo-Fase 2 - Grupo403026 - 14Sonia Alejandra Martinez Viveros100% (1)
- Cualquier Cosa Que Yo Diga Tres Veces Es Verdad (Marcelo Bertuccio, 1997)Document17 paginiCualquier Cosa Que Yo Diga Tres Veces Es Verdad (Marcelo Bertuccio, 1997)marcelobertuccioÎncă nu există evaluări
- Diseño VialDocument29 paginiDiseño VialCRISTHIAN LUIS HILARIO BARRIOSÎncă nu există evaluări
- Taller de Teoría Semana 09Document6 paginiTaller de Teoría Semana 09capillocarhuapomadÎncă nu există evaluări
- Evidencia2 FSC4 P2 FMCDocument11 paginiEvidencia2 FSC4 P2 FMCLupita Ssaliss MeercadoÎncă nu există evaluări
- 2-Leyes de Kirchhoff - EjemplosDocument19 pagini2-Leyes de Kirchhoff - EjemplosCristian Aguilar QuintanillaÎncă nu există evaluări
- FIBRINOLISISDocument18 paginiFIBRINOLISISTomas AguilarÎncă nu există evaluări
- Instructivo Invitramites INVIASDocument27 paginiInstructivo Invitramites INVIASRENE32336Încă nu există evaluări
- Trabajo Práctico 2Document3 paginiTrabajo Práctico 2Ceci GarciaÎncă nu există evaluări
- Modo de Servicio y Reset en Equipos Stereo LGDocument11 paginiModo de Servicio y Reset en Equipos Stereo LGOrley Delgado88% (16)
- Sistema Tecnico de UnidadesDocument5 paginiSistema Tecnico de UnidadesLuis Fernando BelloÎncă nu există evaluări
- Programa Trazabilidad de La Madera Herramientas de Gestion y Comercio Responsable de La MaderaDocument2 paginiPrograma Trazabilidad de La Madera Herramientas de Gestion y Comercio Responsable de La MaderaGremer Quispe LobonÎncă nu există evaluări
- Scamper Helen TorresDocument4 paginiScamper Helen TorresHELEN DAHIAN TORRES GETIALÎncă nu există evaluări
- Examen Resuelto Matemáticas 1ºESO - Números DecimalesDocument4 paginiExamen Resuelto Matemáticas 1ºESO - Números DecimalesQueti GutierrezÎncă nu există evaluări
- Regresion y Correlacion Simple y Multiple 2014.Document37 paginiRegresion y Correlacion Simple y Multiple 2014.Luis NöolsÎncă nu există evaluări
- Firma Personal ResposteriaDocument2 paginiFirma Personal ResposteriaAlexander Asis González OlivaresÎncă nu există evaluări
- CN Grado 9° - Periodo 1Document10 paginiCN Grado 9° - Periodo 1jhonatan tiqueÎncă nu există evaluări