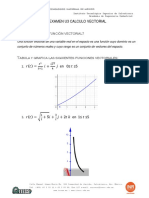
Documente Academic
Documente Profesional
Documente Cultură
Ácido Carbónico
Încărcat de
Jorge FyhyhTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Ácido Carbónico
Încărcat de
Jorge FyhyhDrepturi de autor:
Formate disponibile
Ácido carbónico
El ácido carbónico es un ácido oxácido proveniente del dióxido de
carbono (CO2), siendo su composición H2CO3.2 También es
Ácido carbónico
llamado dihidrogeno (trioxidocarbonato), trioxocarbonato (IV) de
hidrógeno o ácido trioxocarbónico (IV). Es un ácido débil pues su
constante de ionización es muy pequeña, Ka : 0,000 000 45. 3 El
ácido carbónico puede atacar a muchos de los minerales que
comúnmente forman las rocas calizas o margosas,
descomponiéndolos por ejemplo enbicarbonato de calcio
Es el producto de la reacción de agua y óxido de carbono (IV) y
existe en equilibrio con este último, por ejemplo, en el agua
gasificada o la sangre. No es posible obtener ácido carbónico puro
ya que la presencia de una sola molécula de agua catalizaría su
descomposición inmediata en óxido de carbono (IV) y agua. Sin
embargo, se calcula que en ausencia absoluta de agua sería estable.
En disolución, el ácido carbónico puede perder uno o dos protones.
Retirando el primer protón forma el anión bicarbonato; retirando el
segundo protón forma elanión carbonato.
H2CO3 → HCO3- + H+ (pKd = 6,35)
HCO3- → CO32- + H+ (pKd = 10,33)
Nombre IUPAC
Cuando el ácido carbónico se combina con átomos, radicales
positivos o una base, puede formar sales como carbonatos o Dihidrogeno(trioxidocarbonato)
hidrogenocarbonatos. Por ejemplo, combinado con cal (óxido de General
calcio) constituye el carbonato de calcio c( alcita o aragonito). Otros Ácido trioxocarbónico (IV),
nombres Trioxocarbonato (IV) de hidrógeno,
El ácido carbónico está presente en las bebidas gaseosas o Agua Carbonatada, Soda, Sifón
carbonatadas. En una forma más diluida desempeña un papel
Fórmula HO-(CO)-OH
principal en la formación de cuevas debido a que disuelve el
estructural
carbonato de calcio o calcita cuando la concentración de dióxido de
Fórmula H2CO3
carbono (antiguamente anhídrido carbónico) es alta. Este ácido
molecular
opera como regulador del pH (tampón o buffer) en la disolución
Identificadores
lograda para sanitizar el agua cuando es el único medio operante, el
ácido carbónico más fuerte, es el sulfato ácido de calcio. El pH de Número 463-79-61
una solución saturada de dióxido de carbono alcanza un pH de 6,5 CAS
aproximadamente. ChEBI 28976
ChemSpider 747
A las sales y ésteres del ácido carbónico se les denominan
PubChem 767
carbonatos ácidos o bicarbonatos (base conjugada del ácido
Propiedades físicas
carbónico). La base conjugada del bicarbonato es el carbonato.
Apariencia Incoloro
Densidad 1000 kg/m3; 1 g/cm3
Referencias
Masa molar 62,03 g/mol
1. Número CAS (http://webbook.nist.gov/cgi/cbook.cgi?ID= Propiedades químicas
463-79-6)
Acidez 6,352 pKa
2. Mario, GRAU RÍOS; Eugenio, MUÑOZ CAMACHO Solubilidad Sólo existe disuelto
(2013-04-18). Ingeniería química (https://books.google.e
en agua
s/books?id=EES6nXZJbaMC&pg=PT337&dq=El+%C3%
A1cido+carb%C3%B3nico+es+un+%C3%A1cido+ox%C Valores en el SI y en condiciones estándar
3%A1cido&hl=es&sa=X&ved=0ahUKEwiLs8W3lOzY AhV
(25 °C y 1 atm), salvo que se indique lo contrario.
DvxQKHV1FDFIQ6AEIOjAD#v=onepage&q=El%20%C
3%A1cido%20carb%C3%B3nico%20es%20un%20%C [editar datos en Wikidata]
3%A1cido%20ox%C3%A1cido&f=false). Editorial UNED.
ISBN 9788436266429. Consultado el 2018-01-22.
3. Pasto, Daniel J.; Johnson, Carl R. (1981). Determinación de estructuras orgánicas (https://books.google.es/books?id
=uHNdHS8JXFIC&pg=PA348&dq=%C3%A1cido+carb%C3%B3nico+constante+de+ionizaci%C3%B3n&hl=es&sa=X
&ved=0ahUKEwiTgJfglOzYAhUH8RQKHY3LCbcQ6AEIQTAE#v=onepage&q=%C3%A1cido%20carb%C3%B3nico%
20constante%20de%20ionizaci%C3%B3n&f=false) . Reverte. ISBN 9788429174694. Consultado el 2018-01-22.
Véase también
Anión
Enlaces externos
Cálculo del pH y titulación de soluciones de gerardo libuao/bicarbonato/carbonato con hojas Excel en Inglés o
Portugués
Fuente del artículo
Obtenido de «https://es.wikipedia.org/w/index.php?title=Ácido_carbónico&oldid=105080554
»
Se editó esta página por última vez el 22 ene 2018 a las 18:12.
El texto está disponible bajo laLicencia Creative Commons Atribución Compartir Igual 3.0 ; pueden aplicarse cláusulas
adicionales. Al usar este sitio, usted acepta nuestrostérminos de uso y nuestra política de privacidad.
Wikipedia® es una marca registrada de laFundación Wikimedia, Inc., una organización sin ánimo de lucro.
S-ar putea să vă placă și
- Reporte 1 - Tarea Polinomios - 4BV1Document22 paginiReporte 1 - Tarea Polinomios - 4BV1Kevin AlvaradoÎncă nu există evaluări
- SátiroDocument4 paginiSátiroJorge FyhyhÎncă nu există evaluări
- Practica #1Document5 paginiPractica #1juan david casas canizalesÎncă nu există evaluări
- Informe Ley de HessDocument11 paginiInforme Ley de HessYuveidys Chamorro VergaraÎncă nu există evaluări
- Infografia Sobre Equipos de AbsorciónDocument1 paginăInfografia Sobre Equipos de AbsorciónDaniela A.AÎncă nu există evaluări
- Unidad 2. Molienda Húmeda de MaízDocument20 paginiUnidad 2. Molienda Húmeda de MaízJosé Miguel CarlosamaÎncă nu există evaluări
- Practica de FisicoquimicaDocument3 paginiPractica de FisicoquimicaLiza CastilloÎncă nu există evaluări
- Modelo Matemático de SoaveDocument1 paginăModelo Matemático de SoavePatricia BalcazarÎncă nu există evaluări
- Calor EspecificoDocument9 paginiCalor Especificoisabelle_torre_1Încă nu există evaluări
- Anexo 4.1 - Informes Adriana MartínezDocument24 paginiAnexo 4.1 - Informes Adriana MartínezAdriana MartinezÎncă nu există evaluări
- 4-Hidrocarburos Aromáticos-Colorantes AzoDocument4 pagini4-Hidrocarburos Aromáticos-Colorantes AzoDaniela Araújo Rodríguez100% (1)
- SOLUBILIDADDocument17 paginiSOLUBILIDADBoris Fabian Agaon BurbanoÎncă nu există evaluări
- Laboratorio No. 10 - Azul de MetilenoDocument5 paginiLaboratorio No. 10 - Azul de MetilenoFabian MartinÎncă nu există evaluări
- Ecuaciones Diferenciales HomogeneasDocument16 paginiEcuaciones Diferenciales HomogeneasLisbeth YagualÎncă nu există evaluări
- Paper Comparacion Entre Jugo Fresco y Procesado de Tomate de ArbolDocument9 paginiPaper Comparacion Entre Jugo Fresco y Procesado de Tomate de ArbolJames LoganÎncă nu există evaluări
- Informe PHDocument13 paginiInforme PHGERSSON RONALDO RUIZ ULLOAÎncă nu există evaluări
- Practica YesosDocument8 paginiPractica YesosUziel ArroyoÎncă nu există evaluări
- Sintesis de CicloalcanosDocument3 paginiSintesis de CicloalcanosIleana LopezÎncă nu există evaluări
- Ejercicios Del PFMDocument2 paginiEjercicios Del PFMMaria Flores AymaraÎncă nu există evaluări
- Diagrama de Flujo 2Document5 paginiDiagrama de Flujo 2Abril MendívilÎncă nu există evaluări
- Universidad Nacional Autónoma de Huanta: InformeDocument8 paginiUniversidad Nacional Autónoma de Huanta: InformeRutman TorresÎncă nu există evaluări
- PR Ctica N 10 Calificada - Coeficiente Adiab Tico TerminadoDocument16 paginiPR Ctica N 10 Calificada - Coeficiente Adiab Tico TerminadoANDREA CAMILA MARTINEZ GORDONÎncă nu există evaluări
- Propiedades Coligativas de Las SolucionesDocument25 paginiPropiedades Coligativas de Las SolucionesMaríaÎncă nu există evaluări
- Generalidades de Quimica Organica para Ingenieria de AlimentosDocument17 paginiGeneralidades de Quimica Organica para Ingenieria de Alimentosjuan100% (1)
- Articulo LevadurasDocument4 paginiArticulo LevadurasJonathan Rojas PadillaÎncă nu există evaluări
- Practica NormalDocument6 paginiPractica Normaljuan joseÎncă nu există evaluări
- Tarea 1 - Termodinámica y Soluciones.Document43 paginiTarea 1 - Termodinámica y Soluciones.CG Alex0% (1)
- FugacidadDocument32 paginiFugacidadDiego GuerreroÎncă nu există evaluări
- Problemas de BioenergéticaDocument2 paginiProblemas de BioenergéticaGabriela PerezÎncă nu există evaluări
- Equilibrio de FasesDocument9 paginiEquilibrio de FasesMayra Alejandra AlzateÎncă nu există evaluări
- PropanolDocument19 paginiPropanolAlejandro TorresÎncă nu există evaluări
- PRÁCTICA 8. Reacciones de Carbohidratos.Document7 paginiPRÁCTICA 8. Reacciones de Carbohidratos.Gloria Janet TlapechcoÎncă nu există evaluări
- 5.determinacaion Del Porcentaje de Hidratacion de Un CompuestoDocument4 pagini5.determinacaion Del Porcentaje de Hidratacion de Un CompuestoEdwin ValdesÎncă nu există evaluări
- Análisis Gravimétrico Por Volatilización: Determinación Del Contenido de Humedad de Una Muestra SólidaDocument9 paginiAnálisis Gravimétrico Por Volatilización: Determinación Del Contenido de Humedad de Una Muestra SólidaLuis David Mendoza PalaciosÎncă nu există evaluări
- Formulario HidraulicaDocument2 paginiFormulario HidraulicaManuel Alejandro Guerrero GonzálezÎncă nu există evaluări
- Proyecto de Viscosidad de Liquidos Fisica II 1Document30 paginiProyecto de Viscosidad de Liquidos Fisica II 1eder100% (1)
- Cap°tulo 9Document28 paginiCap°tulo 9Miguel DiazÎncă nu există evaluări
- Preparacion de Patrones AcidoDocument4 paginiPreparacion de Patrones AcidoAndres Felipe Reyes OrtegaÎncă nu există evaluări
- PRACTICA 4. DETERMINACION DE CR Con DifenilcarbazidaDocument16 paginiPRACTICA 4. DETERMINACION DE CR Con DifenilcarbazidaLaura PerdomoÎncă nu există evaluări
- Equilibrio QuímicoDocument3 paginiEquilibrio QuímicoWalter Silva SerranoÎncă nu există evaluări
- Segundo Parcial Práctica #2 Determinación de Acidez de Jugos de Frutas y Bebidas Carbonatadas.Document13 paginiSegundo Parcial Práctica #2 Determinación de Acidez de Jugos de Frutas y Bebidas Carbonatadas.Kevin HernándezÎncă nu există evaluări
- Practica Calificada 2 PDFDocument6 paginiPractica Calificada 2 PDFAlonso EspinozaÎncă nu există evaluări
- 7 Heriberto Mejia Fase2Document21 pagini7 Heriberto Mejia Fase2Brandon GonzalezÎncă nu există evaluări
- Ley de HookeDocument17 paginiLey de HookeAnonymous c3ORCzDÎncă nu există evaluări
- Informe de Interpolacion LDocument6 paginiInforme de Interpolacion LLouis AngelÎncă nu există evaluări
- Diseño ExperimentalDocument5 paginiDiseño ExperimentalJuanEstebanSimbañaSantosÎncă nu există evaluări
- Modelosmatemáticos Basados Enla Naturaleza de Las EcuacionesDocument7 paginiModelosmatemáticos Basados Enla Naturaleza de Las EcuacionesGaby BuÎncă nu există evaluări
- Examen de Ingreso Meca de Fluidos 2020 PDFDocument1 paginăExamen de Ingreso Meca de Fluidos 2020 PDFRenato SaraviaÎncă nu există evaluări
- Equilibrio Químico Es La Denominación Que Se Hace A Cualquier Reacción Reversible Cuando Se Observa Que Las Cantidades Relativas de Dos o Más Sustancias Permanecen ConstantesDocument8 paginiEquilibrio Químico Es La Denominación Que Se Hace A Cualquier Reacción Reversible Cuando Se Observa Que Las Cantidades Relativas de Dos o Más Sustancias Permanecen ConstantesZHARICK MIRANDAÎncă nu există evaluări
- 09 Glucolisis Anaerobia y Fermentación-InformeDocument6 pagini09 Glucolisis Anaerobia y Fermentación-Informepaula beltranÎncă nu există evaluări
- Fisico Quimica Resolucion de Ejercicio AtkinsDocument1 paginăFisico Quimica Resolucion de Ejercicio Atkinsgabriela davalosÎncă nu există evaluări
- Laboratorio Virtual Simulador Titulación Ácido BaseDocument17 paginiLaboratorio Virtual Simulador Titulación Ácido BaseKatty Doris Cordova ValverdeÎncă nu există evaluări
- Principio de PascalDocument3 paginiPrincipio de PascalFabiana FigueroaÎncă nu există evaluări
- Viscosimentria Lab 1 Fisica 2Document4 paginiViscosimentria Lab 1 Fisica 2anyelÎncă nu există evaluări
- Serie de Ejercicios Tema 2. - Diseño de Experimentos de Un FactorDocument2 paginiSerie de Ejercicios Tema 2. - Diseño de Experimentos de Un FactorAntonio Alexis Yurrieta GarciaÎncă nu există evaluări
- Coprecipitacion y PostprecipitacionDocument3 paginiCoprecipitacion y PostprecipitacionJhon Snheyder100% (4)
- LIXIVIACIÓNDocument26 paginiLIXIVIACIÓNAldo GranadosÎncă nu există evaluări
- 03 EstequiometríaDocument74 pagini03 EstequiometríaSantiago AllaucaÎncă nu există evaluări
- Informe 6, Analitica IIDocument5 paginiInforme 6, Analitica IIMaria Jose NavarroÎncă nu există evaluări
- Ácido CarbónicoDocument2 paginiÁcido CarbónicoRockero PeruanoÎncă nu există evaluări
- Ácido CarbónicoDocument3 paginiÁcido CarbónicoJaime achuryÎncă nu există evaluări
- Perfil de Proyecto de Investigación Posgrado PDFDocument1 paginăPerfil de Proyecto de Investigación Posgrado PDFJorge FyhyhÎncă nu există evaluări
- Ácido SilícicoDocument2 paginiÁcido SilícicoJorge FyhyhÎncă nu există evaluări
- ElectronegatividadDocument3 paginiElectronegatividadJorge FyhyhÎncă nu există evaluări
- Nitrato de AmonioDocument9 paginiNitrato de AmonioJorge FyhyhÎncă nu există evaluări
- Cloruro de CincDocument5 paginiCloruro de CincJorge FyhyhÎncă nu există evaluări
- BismutoDocument6 paginiBismutoJorge FyhyhÎncă nu există evaluări
- Capa FreáticaDocument6 paginiCapa FreáticaJorge FyhyhÎncă nu există evaluări
- Estandar de Estacion de Barretillas en MinaDocument1 paginăEstandar de Estacion de Barretillas en MinaJorge FyhyhÎncă nu există evaluări
- PatologíaDocument5 paginiPatologíaJorge FyhyhÎncă nu există evaluări
- Dinamita Famesa PulverulentaDocument2 paginiDinamita Famesa Pulverulentaanon_626714735Încă nu există evaluări
- Cloruro de Carbono (IV)Document4 paginiCloruro de Carbono (IV)Jorge FyhyhÎncă nu există evaluări
- OsmioDocument11 paginiOsmioJorge FyhyhÎncă nu există evaluări
- ItrioDocument4 paginiItrioJorge FyhyhÎncă nu există evaluări
- Rub IdioDocument4 paginiRub IdioJorge FyhyhÎncă nu există evaluări
- WolframioDocument9 paginiWolframioJorge FyhyhÎncă nu există evaluări
- UranioDocument7 paginiUranioJorge FyhyhÎncă nu există evaluări
- ÁstatoDocument2 paginiÁstatoJorge FyhyhÎncă nu există evaluări
- Osmio PDFDocument3 paginiOsmio PDFJorge Fyhyh0% (1)
- Distribuciones MultidimensionalesDocument45 paginiDistribuciones MultidimensionalesJoseLuisLópez0% (2)
- Guia DocenteDocument7 paginiGuia DocenteJuan Gabriel FernándezÎncă nu există evaluări
- II BIM - 5to. Año - FIS - Guía 6 - Potencia MecánicaDocument6 paginiII BIM - 5to. Año - FIS - Guía 6 - Potencia MecánicaEnrique Soto LuceroÎncă nu există evaluări
- S Valor de Ajuste, C Valor de Comprobación) OT Tolerancia Exterior (Se Ajusta X)Document8 paginiS Valor de Ajuste, C Valor de Comprobación) OT Tolerancia Exterior (Se Ajusta X)Karen FalconesÎncă nu există evaluări
- CATETERISMO CARDIACO, Cuidados Post CateterismoDocument11 paginiCATETERISMO CARDIACO, Cuidados Post CateterismoDalila OrtegaÎncă nu există evaluări
- DAC y ADCDocument55 paginiDAC y ADCjeremy floresÎncă nu există evaluări
- Sistema Estructural MaderaDocument8 paginiSistema Estructural MaderaBrigith HaydeeÎncă nu există evaluări
- Carta Solar Del Día 19/10/22 Osaka - JapónDocument2 paginiCarta Solar Del Día 19/10/22 Osaka - JapónEva RiveraÎncă nu există evaluări
- Doihipbhq2ihnsm1eift Signature Poli 170401213110Document171 paginiDoihipbhq2ihnsm1eift Signature Poli 170401213110Dario CaparròzÎncă nu există evaluări
- Influencia de La Arquitectura Hospitalaria en El Mejoramiento DelDocument7 paginiInfluencia de La Arquitectura Hospitalaria en El Mejoramiento DelESTEBAN PATRICIO HIDALGO JARAMILLOÎncă nu există evaluări
- Qué Es Justo A TiempoDocument2 paginiQué Es Justo A Tiempocarlos escobarÎncă nu există evaluări
- Diseño de Concreto FC 175 - 210 Aire y PlastificanteDocument4 paginiDiseño de Concreto FC 175 - 210 Aire y PlastificanteRase Valdivia YacilaÎncă nu există evaluări
- EndocrinoDocument54 paginiEndocrinoSandraÎncă nu există evaluări
- Valores Pueblos AndinosDocument4 paginiValores Pueblos Andinosyury ramosÎncă nu există evaluări
- Catalogo Completo RostaDocument110 paginiCatalogo Completo RostaRocko O'BrienÎncă nu există evaluări
- Respuestas Pre-Examen Calc Vect U3Document4 paginiRespuestas Pre-Examen Calc Vect U3Luis Manuel Martinez CaballeroÎncă nu există evaluări
- Glorificación Del Srimad-BhagavatamDocument6 paginiGlorificación Del Srimad-BhagavatamEsteban Ariza RangelÎncă nu există evaluări
- Informe de Fisica Ii N1Document10 paginiInforme de Fisica Ii N1Williams VelasquezÎncă nu există evaluări
- Método Del AciDocument7 paginiMétodo Del AciDaniel LoÎncă nu există evaluări
- INFOGRAFIA Sistema Nervioso Autonomo BILLIKENDocument1 paginăINFOGRAFIA Sistema Nervioso Autonomo BILLIKENYudith SaritaÎncă nu există evaluări
- Nanotecnología en El Concreto y CementoDocument13 paginiNanotecnología en El Concreto y CementoBKAVE TOWRSÎncă nu există evaluări
- Proyecto de Iluminación de Una BibliotecaDocument11 paginiProyecto de Iluminación de Una BibliotecaJose L Huaman GasparÎncă nu există evaluări
- BRAINGYMDocument7 paginiBRAINGYMtamarindossÎncă nu există evaluări
- La Programación Neurolingüística y Los Hemisferios Cerebrales Como Herramientas de AprendizajeDocument89 paginiLa Programación Neurolingüística y Los Hemisferios Cerebrales Como Herramientas de AprendizajeAntonio Baeza100% (1)
- Clase 5 Nomenclatura InorgánicaDocument62 paginiClase 5 Nomenclatura InorgánicaIan Andrade CartesÎncă nu există evaluări
- El Amor Tiene Sus Propias RazonesDocument12 paginiEl Amor Tiene Sus Propias Razonestheotokos00726Încă nu există evaluări
- Documentos UaeDocument166 paginiDocumentos UaeRucajdjdÎncă nu există evaluări
- Firma Personal Comercial Monte MarioDocument2 paginiFirma Personal Comercial Monte MarioArlenis CórdovaÎncă nu există evaluări
- Carta Mesa IncognitaDocument8 paginiCarta Mesa IncognitaBurgos Castro VíctorÎncă nu există evaluări