Documente Academic
Documente Profesional
Documente Cultură
Quimica Lucimar
Încărcat de
ramon lopezDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Quimica Lucimar
Încărcat de
ramon lopezDrepturi de autor:
Formate disponibile
Enlace químico
Un enlace químico es el proceso químico responsable de las interacciones atractivas
entre átomos y moléculas, 1y que confiere estabilidad a los compuestos químicos diatómicos y
poliatómicos. La explicación de tales fuerzas atractivas es un área compleja que está descrita
por las leyes de la química cuántica.
Una definición más sencilla es que un enlace químico es la fuerza existente entre los átomos
una vez que se ha formado un sistema estable.2
Las moléculas, cristales, metales y gases diatómicos (que forman la mayor parte del ambiente
físico que nos rodea) están unidos por enlaces químicos, que determinan las
propiedades físicas y químicas de la materia.
Enlace iónico del cloruro de sodio, donde
sodio da su electrón de valenciaal cloro para ambos tener 8 electrones en su valencia.
Enlace iónico
En química y en física, un enlace iónico o electrovalente es el resultado de la presencia de
atracción electrostática entre los iones de distinto signo, es decir, uno
fuertemente electropositivo (baja energía de ionización) y otro
fuertemente electronegativo (alta afinidad electrónica). 1Eso se da cuando en el enlace, uno de
los átomos capta electrones del otro. La atracción electrostática entre los iones de carga
opuesta causa que se unan y formen un compuesto químico simple, aquí no se fusionan; sino
que uno da y otro recibe. Para que un enlace iónico se genere es necesario que la diferencia
(delta) de electronegatividades sea mayor que 1,7 o igual.
El flúor y el litio uniéndose iónicamente para
formar fluoruro de litio.
Enlace covalente
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para
alcanzar el octeto estable, compartiendo electrones del último nivel1 (excepto el hidrógeno que
alcanza la estabilidad cuando tiene 2 electrones). La diferencia de electronegatividad entre los
átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica.
Para que un enlace covalente se genere es necesario que la diferencia de electronegatividad
entre átomos sea menor a 1,7.2
De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de
orbital, denominado orbital molecular. Los enlaces covalentes se producen entre átomos de un
mismo elemento no metal, entre distintos no metales y entre un no metal y el hidrógeno.34
Enlace covalente polar
Consiste en la formación de un enlace entre átomos de diferentes elementos, y la diferencia
de la electronegatividad debe ser mayor de 0,5. En este enlace, los electrones son atraídos
fundamentalmente por el núcleo del átomo más electronegativo, generando moléculas cuya
nube electrónica presentará una zona con mayor densidad de carga negativa y otra con mayor
densidad de carga positiva (dipolo).
Enlace covalente apolar
Se forma entre átomos iguales y la diferencia de electronegatividad debe ser cero o muy
disminuida (menor que 0,4). En este enlace, los electrones son atraídos por ambos núcleos
con la misma intensidad, generando moléculas cuya nube electrónica es uniforme.
Electronegatividad
La electronegatividad es la capacidad de un átomo para atraer a los electrones, cuando
forma un enlace químico en una molécula.1 También debemos considerar la distribución
de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en
una especie molecular como en sistemas o especies no moleculares. Es cuando los
elementos dan átomos La electronegatividad de un átomo determinado está afectada
fundamentalmente por dos magnitudes: su masa atómica y la distancia promedio de
los electrones de valencia con respecto al núcleo atómico. Esta propiedad se ha podido
correlacionar con otras propiedades atómicas y moleculares
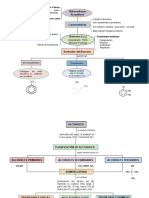
Regla del octeto
La teoría del octeto, enunciada en 1916 por el fisicoquímico Gilbert Newton Lewis, dice que
los iones de los elementos del sistema periódico tienen la tendencia a completar sus últimos
niveles de energía con una cantidad de 8 electrones, de tal forma que adquieren una
configuración muy estable. Esta configuración es semejante a la de un gas noble,1 los
elementos ubicados al extremo derecho de la tabla periódica. Los gases nobles son elementos
electroquímicamente estables, ya que cumplen con la estructura de Lewis, son inertes, es
decir que es muy difícil que reaccionen con algún otro elemento. Esta conclusión es conocida
como la regla del octeto.2
Esta regla es aplicable para la creación de enlaces entre los átomos, la naturaleza de estos
enlaces determinará el comportamiento y las propiedades de las moléculas. Estas
propiedades dependerán por tanto del tipo de enlace, del número de enlaces por átomo, y de
las fuerzas intermoleculares.
Existen diferentes tipos de enlace químico, basados todos ellos, como se ha explicado antes
en la estabilidad especial de la configuración electrónica de los gases nobles, tendiendo a
rodearse de ocho electrones en su nivel más externo. Este octeto electrónico puede ser
adquirido por un átomo de diferentes maneras, en función de la electronegatividad:
enlace iónico
enlace covalente
enlace metálico
enlaces intermoleculares
enlace coordinado
S-ar putea să vă placă și
- Arte y Patrimonio II MomentoDocument8 paginiArte y Patrimonio II Momentoramon lopezÎncă nu există evaluări
- Iso 19011-2011Document2 paginiIso 19011-2011Ramon LopezÎncă nu există evaluări
- Reseña Historica Liceo Rafael MonasteriosDocument3 paginiReseña Historica Liceo Rafael Monasteriosramon lopezÎncă nu există evaluări
- Representación Grafica AromaticosDocument4 paginiRepresentación Grafica Aromaticosramon lopezÎncă nu există evaluări
- Efemerides de MayoDocument2 paginiEfemerides de Mayoramon lopezÎncă nu există evaluări
- Arte-y-Patrimonio-Arte Campo VisualDocument3 paginiArte-y-Patrimonio-Arte Campo Visualramon lopezÎncă nu există evaluări
- Capitulo2 Analisis de AguasDocument14 paginiCapitulo2 Analisis de Aguasramon lopezÎncă nu există evaluări
- Diagnostico DidácticoDocument1 paginăDiagnostico Didácticoramon lopezÎncă nu există evaluări
- Master Calidad AlimentariaDocument24 paginiMaster Calidad Alimentariaramon lopezÎncă nu există evaluări
- Efemerides Del MarzoDocument2 paginiEfemerides Del Marzoramon lopezÎncă nu există evaluări
- Analisis Critico de MercosurDocument4 paginiAnalisis Critico de Mercosurramon lopezÎncă nu există evaluări
- Capitulo2 Analisis de AguasDocument14 paginiCapitulo2 Analisis de Aguasramon lopezÎncă nu există evaluări
- Cuadro de DecretosDocument2 paginiCuadro de DecretosRamon LopezÎncă nu există evaluări
- Cuáles Son Las Fases Del Sistema APPCCDocument5 paginiCuáles Son Las Fases Del Sistema APPCCramon lopezÎncă nu există evaluări
- Casos de La Función AfínDocument7 paginiCasos de La Función Afínramon lopezÎncă nu există evaluări
- Caracteristicas Estado PortuguesaDocument5 paginiCaracteristicas Estado Portuguesaramon lopez100% (1)
- 304 Norma Isa PidDocument0 pagini304 Norma Isa PidBrenda PascacioÎncă nu există evaluări
- Sketch UpDocument4 paginiSketch Upramon lopezÎncă nu există evaluări
- Conjuntos2 190610170630Document56 paginiConjuntos2 190610170630ramon lopezÎncă nu există evaluări
- Cuáles Son Las Fases Del Sistema APPCCDocument5 paginiCuáles Son Las Fases Del Sistema APPCCramon lopezÎncă nu există evaluări
- Caracteristicas Estado PortuguesaDocument5 paginiCaracteristicas Estado Portuguesaramon lopez100% (1)
- Casos de La Función AfínDocument7 paginiCasos de La Función Afínramon lopezÎncă nu există evaluări
- Documento Yaisel MatematicaDocument11 paginiDocumento Yaisel Matematicaramon lopezÎncă nu există evaluări
- Casos de La Función AfínDocument7 paginiCasos de La Función Afínramon lopezÎncă nu există evaluări
- Planificación 11 Al 15 de Mayo Prof. CarmenDocument2 paginiPlanificación 11 Al 15 de Mayo Prof. Carmenramon lopezÎncă nu există evaluări
- Cancer de PancreasDocument18 paginiCancer de PancreasArturo FigueroaÎncă nu există evaluări
- La Contaminación Del AguaDocument23 paginiLa Contaminación Del AguaBrian Bermúdez QuinteroÎncă nu există evaluări
- FuncionesDocument21 paginiFuncionesfermarquez000Încă nu există evaluări
- MineralesyrocasDocument10 paginiMineralesyrocasramon lopezÎncă nu există evaluări
- La Contaminación Del AguaDocument23 paginiLa Contaminación Del AguaBrian Bermúdez QuinteroÎncă nu există evaluări
- Dispositivos Lógicos ProgramablesDocument20 paginiDispositivos Lógicos Programablesluz PereiraÎncă nu există evaluări
- Falla LCD Samsung No EnciendeDocument3 paginiFalla LCD Samsung No Enciendetecnologo456Încă nu există evaluări
- Filtros Activos 2.0Document37 paginiFiltros Activos 2.0Jason Jose AcostaÎncă nu există evaluări
- Problemas Circuitos RC y RLDocument11 paginiProblemas Circuitos RC y RLDavid HawkinsÎncă nu există evaluări
- Manual Bomba DosificadoraDocument1 paginăManual Bomba DosificadoraEmanuel OnisimchukÎncă nu există evaluări
- Cuestionario Aire Acondicionado y Refregeracion Parcial 2 Sin RespuestasDocument5 paginiCuestionario Aire Acondicionado y Refregeracion Parcial 2 Sin RespuestasBrAyAn JiMèNEz100% (1)
- 2 - Experimento 40 - Polaridad Del TransformadorDocument5 pagini2 - Experimento 40 - Polaridad Del Transformadorjaz100% (1)
- Iei06 Tarea2Document12 paginiIei06 Tarea2miuv0% (1)
- 2 Diodos y RectificadoresDocument11 pagini2 Diodos y RectificadoresEmmanuel OsunaÎncă nu există evaluări
- Laboratorio 4 de Sistemas de Comunicación Digital IDocument8 paginiLaboratorio 4 de Sistemas de Comunicación Digital IAndrésEduardoMartinezÎncă nu există evaluări
- Practica de Laboratorio 1,2,3Document8 paginiPractica de Laboratorio 1,2,3Uriel SalinasÎncă nu există evaluări
- Fisica y Aplicacion de Las Bobinas de RFDocument42 paginiFisica y Aplicacion de Las Bobinas de RFSebastian Alexis Villagra NavarroÎncă nu există evaluări
- Reporte Temporizador DigitalDocument5 paginiReporte Temporizador DigitalRafael Martinez BarraganÎncă nu există evaluări
- Trabajo UD6 RespDocument9 paginiTrabajo UD6 RespJesús A Solís PonsÎncă nu există evaluări
- Evolucion Del ComputadorDocument1 paginăEvolucion Del Computadordayci jimenez50% (4)
- AtariDocument8 paginiAtariLinoberth GonzalezÎncă nu există evaluări
- Marco TeóricoDocument5 paginiMarco TeóricotabizaÎncă nu există evaluări
- Som-3531 Manual de Procedimientos de Pruebas de Equipo PrimDocument472 paginiSom-3531 Manual de Procedimientos de Pruebas de Equipo PrimCarlos Mauricio Salazar Ojeda100% (1)
- CNS-NT-11-09 Especificaciones Técnicas de Conectores PDFDocument28 paginiCNS-NT-11-09 Especificaciones Técnicas de Conectores PDFJavier Eduardo Vargas MorenoÎncă nu există evaluări
- Pérez Morales Luis Enrique 2018301211Document2 paginiPérez Morales Luis Enrique 2018301211Enrique Prz'Încă nu există evaluări
- Informe Dispositivos MovilesDocument19 paginiInforme Dispositivos MovilesYessica Cruz MartinezÎncă nu există evaluări
- Infosr 1 SDocument4 paginiInfosr 1 SWilliamsFiguerasÎncă nu există evaluări
- Conectar Dos Arduinos Mediante BluetoothDocument6 paginiConectar Dos Arduinos Mediante BluetoothmekanicobucaroÎncă nu există evaluări
- Definicion de Lineas de Transmision y Distribucion PDFDocument2 paginiDefinicion de Lineas de Transmision y Distribucion PDFAndrea Soto100% (1)
- Lab 05 Sensores Industriales de Temperatura PresionDocument5 paginiLab 05 Sensores Industriales de Temperatura PresionJoséMiguelEscobedoDelgadoÎncă nu există evaluări
- Unidad 3 MetoDoS ElectricosDocument43 paginiUnidad 3 MetoDoS ElectricosYeraldi Montiel Alor67% (6)
- Transformadores de Distribución Monofásicos de 3-37.5 Kva v0Document17 paginiTransformadores de Distribución Monofásicos de 3-37.5 Kva v0Jorge Walter Chavez HilarionÎncă nu există evaluări
- Pea Electricista Industrial 5Document4 paginiPea Electricista Industrial 5GRACE NICOLE AQUINO LAZOÎncă nu există evaluări
- Acoplamiento de AmplificadoresDocument2 paginiAcoplamiento de AmplificadoresVitore Morleone82% (11)
- PRUEBA DE DIAGNÓSTICO QUIMICA 1RO ResueltoDocument2 paginiPRUEBA DE DIAGNÓSTICO QUIMICA 1RO ResueltoBraulio Alvarado92% (59)