Documente Academic
Documente Profesional
Documente Cultură
Construcción de Escala PH para La Valoracion de NaOH Con HCL 1
Încărcat de
Guillermo GuerreroTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Construcción de Escala PH para La Valoracion de NaOH Con HCL 1
Încărcat de
Guillermo GuerreroDrepturi de autor:
Formate disponibile
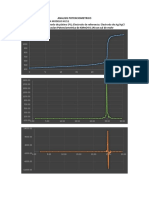
Construcción de escala pH para la valoracion de 𝑯𝑪𝒍 𝒄𝒐𝒏 𝑵𝒂𝑶𝑯
Fenomeno de la disociación del agua
𝑯𝟑 𝑶+ 𝑯𝟐 𝑶
pH
𝑯𝟐 𝑶
OH-
Reacciones de disociación
2𝐻2 𝑂 → 𝐻3 𝑂+ + 𝑂𝐻 − ; Kw=[𝐻3 𝑂+ ][𝑂𝐻 − ] = 1014
interaccion de un acido con Agua
𝑯𝟑 𝑶+ 𝑯𝑨 𝑯𝟐 𝑶
pH
𝑯𝟐 𝑶 𝑨 −
OH-
∆𝟏 = (𝒑𝒌𝑨 − 𝟎)
Interración del agua con el acido monoprotico
𝐻2 𝑂 + 𝐻𝐴 → 𝐻3 𝑂+ + 𝐴− ; 𝐾𝐴 = 10𝑃𝐾𝐴
Autropotolisis del agua
2𝐻2 𝑂 → 𝐻3 𝑂+ + 𝑂𝐻 − ; Kw=[𝐻3 𝑂+ ][𝑂𝐻 − ] = 1014
Reacción de un acido monoprotico con una base fuerte
𝑯𝟑 𝑶+ 𝑯𝑨 𝑯𝟐 𝑶
pH
𝑯𝟐 𝑶 𝑨 −
OH-
∆𝟏 = (𝒑𝒌𝑨 − 𝟎)
Reacción del hidroxido con el acido monoprotico
𝐻𝐴 + 𝑂𝐻 − → 𝐻3 𝑂+ + 𝐴− ; 𝐾𝐴 = 10 14−𝑃𝐾𝐴
Autropotolisis del agua
2𝐻2 𝑂 → 𝐻3 𝑂+ + 𝑂𝐻 − ; Kw=[𝐻3 𝑂+ ][𝑂𝐻 − ] = 1014
Escala de pH que ocurre en la valoración de Acido clorhidrico con
Hidroxido de sodio
𝑯𝟑 𝑶+ 𝑯𝑪𝒍 𝑯𝟐 𝑶
pH
𝑯𝟐 𝑶 𝑪𝒍−
OH-
∆𝟏 = (𝒑𝒌𝑨 − 𝟎)
Las especies que se tienen en esta solución amortiguadora son
(𝐻3 𝑂+ , 𝑂𝐻 − , 𝐻2 𝑂, 𝐶𝑙 − , 𝑁𝑎 + )
Reacción particular de la valoración
𝐻𝐶𝑙 + 𝑂𝐻 − → 𝐻3 𝑂+ + 𝐶𝑙 − ; 𝐾𝐴 = 10 14−𝑃𝐾𝐴
Autropotolisis del agua
2𝐻2 𝑂 → 𝐻3 𝑂+ + 𝑂𝐻 − ; Kw=[𝐻3 𝑂+ ][𝑂𝐻 − ] = 1014
Balance de materia para cada componente
− −
+
𝑉 𝑂𝐻 𝐶0𝑂𝐻
𝑁𝑎 = 𝐻𝐶𝑙 −
𝑉0 + 𝑉0𝑂𝐻
𝑉 𝐻𝐶𝑙 𝐶0𝐻𝐶𝑙
[𝐻𝐶𝑙] + [𝐶𝑙 − ] = −
𝑉0𝐻𝐶𝑙 + 𝑉0𝑂𝐻
Balance de Cargas( Electroneutralidad)
[𝑁𝑎+ ] + [𝐻3 𝑂+ ] = [𝑂𝐻 − ] + [𝐶𝑙 − ]
Constantes de equilibrio
[𝐻3 𝑂+ ][𝑂𝐻 − ] = 10−14 = Kw
[𝐶𝑙 − ][[𝐻3 𝑂+ ]
𝐾𝐴 =
𝐻𝐶𝑙
Con ayuda de la tabla de valoración de una Acido fuerte con un Base fuerte
anexada en el manual se realizó una Tabla PARTICULAR de la valoración de
Acido Clorhidríco con Hidroxido de sodio realizada en la experimentación
con un porcentaje conversión ≥ 97%
1
𝐻3 𝑂+ + 𝑂𝐻 − → 2𝐻2 𝑂 𝐾𝑅 = 𝐾 = 1014
𝑤
Inicio 𝐶0 = 0. 0980𝑀 1
𝑉=0
−
Se agrega 𝑉 ∗ (𝐶0𝑂𝐻 ) = 0.0953 𝑀
−
𝐶0 𝑉0 −𝑉𝐶0𝑂𝐻 𝐶 𝑉
APE 𝜀 𝑉 0+𝑉0 1
𝑉0 +𝑉 0
0 0𝐶 𝑉 (0.0980 𝑀)(5𝑚𝐿)−𝑉(0.0953) (0.0980𝑀)(5𝑚𝐿)
0 < 𝑉 < 𝐶 𝑂𝐻 − − 𝜀 −
0 5𝑚𝐿+𝑉 𝑂𝐻 5𝑚𝐿+𝑉 𝑂𝐻
𝐶 𝑉 𝐶 𝑉
PE 0 0
𝜀 𝑉 +𝑉 0 0
𝜀 𝑉 +𝑉 1
0 𝑝𝑒 0 𝑝𝑒
𝐶 𝑉
0 0 (0.0980 𝑀)(5𝑚𝐿) (0.0980 𝑀)(5𝑚𝐿)
𝑉 = 𝐶 𝑜𝐻 − 𝜀 𝜀
0 5𝑚𝐿+𝑉𝑝𝑒 5𝑚𝐿+𝑉𝑝𝑒
−
𝐶 𝑉 𝑉𝐶0𝑂𝐻 −𝐶0 𝑉0
DPE 𝜀 𝑉 0+𝑉0 1
0 𝑉0 +𝑉
𝐶0 𝑉0 (0.0980𝑀)(5𝑚𝐿) 𝑉(0.0953𝑀)−(0.0980 𝑀)(5𝑚𝐿)
𝑉> − 𝜀 − −
𝐶0𝑂𝐻 5𝑚𝐿+𝑉 𝑂𝐻 5𝑚𝐿+𝑉 𝑂𝐻
S-ar putea să vă placă și
- Cartel 2Document1 paginăCartel 2Berenice Sanchez GalindoÎncă nu există evaluări
- Práctica 2Document11 paginiPráctica 2Lalo VegaÎncă nu există evaluări
- Extraccion Acido BaseDocument11 paginiExtraccion Acido BaseDiego OrtizÎncă nu există evaluări
- Problemas de Complejos y RedoxDocument6 paginiProblemas de Complejos y RedoxSebaaÎncă nu există evaluări
- Taller RedoxDocument4 paginiTaller Redoxalejandra rodriguezÎncă nu există evaluări
- Formulario 08 Acidos Bases 2 BachDocument1 paginăFormulario 08 Acidos Bases 2 BachIñigo Sánchez Enciso100% (1)
- 6 Previo (Bombas)Document12 pagini6 Previo (Bombas)Guillermo Guerrero100% (1)
- Solubilidad PracticaDocument8 paginiSolubilidad Practicabrrujita16-75% (4)
- K 4Document13 paginiK 4maria joseÎncă nu există evaluări
- Sintesis Yodo AnilinaDocument4 paginiSintesis Yodo AnilinaSebastianAntaresÎncă nu există evaluări
- Equilibrio Resueltos2Document7 paginiEquilibrio Resueltos2LEODAN BLADIMIR MAMANI ZAPANAÎncă nu există evaluări
- 04 Ejercicios Red OxDocument16 pagini04 Ejercicios Red OxEduard RomeroÎncă nu există evaluări
- Informe 1 Inorgánica - Compuestos de CoordinaciónDocument13 paginiInforme 1 Inorgánica - Compuestos de Coordinaciónandrea yuilanaÎncă nu există evaluări
- Sesiã N 11 - UIII - Coeficiente de RepartoDocument24 paginiSesiã N 11 - UIII - Coeficiente de RepartoMiyaray LecarosÎncă nu există evaluări
- Seminario 5 Halogenuros de AlquiloDocument4 paginiSeminario 5 Halogenuros de AlquiloRaúl Nicolás Caicedo VidalÎncă nu există evaluări
- Pasar inDocument3 paginiPasar inAlexander LeónÎncă nu există evaluări
- Volumetría Por Formación de Precipitados (Ramos)Document5 paginiVolumetría Por Formación de Precipitados (Ramos)Alex LumbardoÎncă nu există evaluări
- Informe 1 Compuestos de Coordinacion deDocument3 paginiInforme 1 Compuestos de Coordinacion devalentina vargasÎncă nu există evaluări
- Práctica Demostrativa #07 - InformeDocument6 paginiPráctica Demostrativa #07 - InformedavidÎncă nu există evaluări
- Equilibrio de Solubilidad, Ejercicios Resueltos2016Document19 paginiEquilibrio de Solubilidad, Ejercicios Resueltos2016holaÎncă nu există evaluări
- Informe Capacidad Calorific A de Un SolidoDocument13 paginiInforme Capacidad Calorific A de Un SolidoAngélica María Castañeda RivasÎncă nu există evaluări
- Serie 3 Equilibrio Quimico 4540Document2 paginiSerie 3 Equilibrio Quimico 4540Yassel4Încă nu există evaluări
- Parcial 2 FQDocument4 paginiParcial 2 FQNicole KesslerÎncă nu există evaluări
- Reporte Fisica FriccionDocument3 paginiReporte Fisica FriccionjoelÎncă nu există evaluări
- Modulo de CoordinaciónDocument79 paginiModulo de Coordinaciónjhon fernandoÎncă nu există evaluări
- Reporte de Laboratorio 2Document10 paginiReporte de Laboratorio 2ESTHEPHANIE CARRILLO URREGO0% (1)
- Mezclas AzeotropicasDocument3 paginiMezclas AzeotropicasMaricruz LeónÎncă nu există evaluări
- Ejercicios Ácido-BaseDocument18 paginiEjercicios Ácido-BaseGabriel García MoralesÎncă nu există evaluări
- Laboratorio 9 de InorganicaDocument21 paginiLaboratorio 9 de InorganicaIsaac Farfan CondorÎncă nu există evaluări
- Clase Nº8 2018 IDocument53 paginiClase Nº8 2018 IDevra GomezÎncă nu există evaluări
- 1 Sintesis de Complejos de OxalatoDocument10 pagini1 Sintesis de Complejos de OxalatoLucia DiazÎncă nu există evaluări
- Extraccion de La TrimiristinaDocument4 paginiExtraccion de La TrimiristinaMaria Alejandra Olarte CortesÎncă nu există evaluări
- SOLUBILIDADDocument5 paginiSOLUBILIDADalingolingo100% (1)
- SEMINARIODocument7 paginiSEMINARIOAlbert FernandezÎncă nu există evaluări
- Informe-De-Laboratorio-10 Sal de Mohr - Galarza Jenniffer y Reyes DayanneDocument6 paginiInforme-De-Laboratorio-10 Sal de Mohr - Galarza Jenniffer y Reyes DayanneJenniffer Melissa GalarzaÎncă nu există evaluări
- Trabajo de QuimicaDocument6 paginiTrabajo de QuimicaPatrick AlbanÎncă nu există evaluări
- Qa2 TP3 Grupo5Document5 paginiQa2 TP3 Grupo5Jonathan SeoÎncă nu există evaluări
- Estandarizacion D Kmno4Document3 paginiEstandarizacion D Kmno4Willy MelgarejoRmroÎncă nu există evaluări
- Laboratorio #4 Síntesis, Purificación y Caracterización de Acetanilida - Grupo NDocument18 paginiLaboratorio #4 Síntesis, Purificación y Caracterización de Acetanilida - Grupo NBeatriz godoyÎncă nu există evaluări
- Recristalización de Alumbre y Sal de CocinaDocument7 paginiRecristalización de Alumbre y Sal de CocinaMaryin QuimbayaÎncă nu există evaluări
- 2019 Problemas Curvas de Titulacion ACIDO BASEDocument10 pagini2019 Problemas Curvas de Titulacion ACIDO BASEGray D L LeoÎncă nu există evaluări
- Cuestionario 1 Síntesis de NitrobencenoDocument3 paginiCuestionario 1 Síntesis de NitrobencenoKarla PaulethÎncă nu există evaluări
- Unidad 4 - CINÉTICA QUÍMICADocument40 paginiUnidad 4 - CINÉTICA QUÍMICAnicolas acostaÎncă nu există evaluări
- Informe Practica 10Document7 paginiInforme Practica 10Roberto SánchezÎncă nu există evaluări
- Respuestas Chang 10 EdDocument4 paginiRespuestas Chang 10 EdIngrithDayhanaTobarÎncă nu există evaluări
- Previo RivaldoDocument2 paginiPrevio RivaldoRivaldoÎncă nu există evaluări
- Obtencion de Amarillo MartiusDocument4 paginiObtencion de Amarillo MartiusFrancisco Miguel CastilloÎncă nu există evaluări
- Síntesis de Tris (Acetilacetonato) de Manganeso (Iii)Document5 paginiSíntesis de Tris (Acetilacetonato) de Manganeso (Iii)roshifernandez0% (1)
- Síntesis de Las Reacciones de AdiciónDocument1 paginăSíntesis de Las Reacciones de AdiciónMiri AldreteÎncă nu există evaluări
- Practica 3 Electrodo de ReferenciaDocument9 paginiPractica 3 Electrodo de ReferenciaCaballero RrzÎncă nu există evaluări
- Energia de HelmholtzDocument14 paginiEnergia de HelmholtzpeterÎncă nu există evaluări
- Sintesis NiquelDocument8 paginiSintesis NiquelAndrés Aurelijus JuradoÎncă nu există evaluări
- P10 Marylett Garcia ReporteTermoDocument10 paginiP10 Marylett Garcia ReporteTermoMary GarcíaÎncă nu există evaluări
- Determinacion Del Peso Molecular de Un Vapor Condensable Por Los Metodos de Dumas y de Victor MeyerDocument11 paginiDeterminacion Del Peso Molecular de Un Vapor Condensable Por Los Metodos de Dumas y de Victor MeyerSEBASTIAN ALZATE ALZATEÎncă nu există evaluări
- Informe Quimica 2Document6 paginiInforme Quimica 2Yolanda LozanoÎncă nu există evaluări
- Informe 7 FisicoquimicaDocument9 paginiInforme 7 FisicoquimicaDaniel KStilloÎncă nu există evaluări
- Masas RelativasDocument9 paginiMasas RelativasCande FloresÎncă nu există evaluări
- Examen I Biologia CelularDocument7 paginiExamen I Biologia CelularRamcheto MojicaÎncă nu există evaluări
- Practica 10 - Yodimetria Indirecta (Analitica II)Document7 paginiPractica 10 - Yodimetria Indirecta (Analitica II)SEBASTIAN OSPINA PELAEZÎncă nu există evaluări
- Formulas para El Primer Parcial Equilibrios en DisolucionDocument5 paginiFormulas para El Primer Parcial Equilibrios en DisolucionSalome QuirogaÎncă nu există evaluări
- Taller Semicontinuo Ramon y GenesisDocument19 paginiTaller Semicontinuo Ramon y GenesisanamorenoÎncă nu există evaluări
- R2 Analitica Final..terminado 22 de AgostoDocument20 paginiR2 Analitica Final..terminado 22 de AgostoGuillermo GuerreroÎncă nu există evaluări
- Valoracion Del Cloro Activo en Una MuestDocument7 paginiValoracion Del Cloro Activo en Una MuestGuillermo GuerreroÎncă nu există evaluări
- Lem IV Humidif.Document12 paginiLem IV Humidif.Guillermo GuerreroÎncă nu există evaluări
- Reporte LEM3 Flujo CruzadoDocument18 paginiReporte LEM3 Flujo CruzadoGuillermo GuerreroÎncă nu există evaluări
- Previo de EvaporacionDocument7 paginiPrevio de EvaporacionGuillermo Guerrero100% (1)
- Cuestionario #3Document3 paginiCuestionario #3Ludy Perez PanduroÎncă nu există evaluări
- Determinación de La Alcalinidad y La Acidez en Una Muestra de Agua de Humedal y de Una Muestra SinteticaDocument8 paginiDeterminación de La Alcalinidad y La Acidez en Una Muestra de Agua de Humedal y de Una Muestra SinteticaCamilo AldanaÎncă nu există evaluări
- SustanciasanfoterasDocument2 paginiSustanciasanfoterasYumikoÎncă nu există evaluări
- 1NOMENCLATURA QUÍMICA INORGÁNICA Grupo 4Document4 pagini1NOMENCLATURA QUÍMICA INORGÁNICA Grupo 4lesly gutierrezÎncă nu există evaluări
- Documento Sin TítuloDocument3 paginiDocumento Sin TítuloMaría José Lafuente ZuletaÎncă nu există evaluări
- Capitulo 16 Garritz Gasque MartinezDocument38 paginiCapitulo 16 Garritz Gasque MartinezYun GarciaÎncă nu există evaluări
- PROBLEMASDisoluciones 2Document1 paginăPROBLEMASDisoluciones 2Eva PedreroÎncă nu există evaluări
- QA 02 Complejos Problemas01Document6 paginiQA 02 Complejos Problemas012112mariaÎncă nu există evaluări
- Sustancias Amortiguadores en El OrganismoDocument3 paginiSustancias Amortiguadores en El OrganismoMATEO SEBASTIAN CORONEL TENESACAÎncă nu există evaluări
- Informe - Soluciones Neutralización - Tomas FabrizioDocument2 paginiInforme - Soluciones Neutralización - Tomas FabrizioTomas FabrizioÎncă nu există evaluări
- Informe 6Document9 paginiInforme 6Ariany RomeroÎncă nu există evaluări
- Equilibrio Acido Base y Sistema AmortiguadoresDocument8 paginiEquilibrio Acido Base y Sistema AmortiguadoresNores Marlene Alarcon BerrocalÎncă nu există evaluări
- Guía Práctica 1 Sistemas Amortiguadores de PHDocument6 paginiGuía Práctica 1 Sistemas Amortiguadores de PHCamila AlegriaÎncă nu există evaluări
- Reporte 9 - Titulación Ácido BaseDocument4 paginiReporte 9 - Titulación Ácido BaseVALERIA SARMIENTO GOMEZÎncă nu există evaluări
- Ácido Base N°1Document19 paginiÁcido Base N°1Ignacio AliagaÎncă nu există evaluări
- Discusión N°1 Equilibrio Ácido BaseDocument47 paginiDiscusión N°1 Equilibrio Ácido BasekathÎncă nu există evaluări
- Copia de Experimento Valoracion Phmetrica. 3docxDocument10 paginiCopia de Experimento Valoracion Phmetrica. 3docxEvelin RangelÎncă nu există evaluări
- Soluciones ReguladorasDocument6 paginiSoluciones ReguladorasJoan HoyosÎncă nu există evaluări
- Guia 2 Quimica Once PHDocument2 paginiGuia 2 Quimica Once PHfercho8012100% (2)
- Mezclas Alcalinas - Colin PortilloDocument15 paginiMezclas Alcalinas - Colin PortilloAlejandra TapiaÎncă nu există evaluări
- Acidos para Primero Grado de SecundariaDocument4 paginiAcidos para Primero Grado de SecundariaANGIE GIERESH HUAMAN MENDOZAÎncă nu există evaluări
- Informe Quimica PHDocument6 paginiInforme Quimica PHImZianÎncă nu există evaluări
- Acidos y Bases o HidroxidosDocument20 paginiAcidos y Bases o HidroxidosJuan TorresÎncă nu există evaluări
- Ácidos Más ImportantesDocument2 paginiÁcidos Más ImportantesEdwin Arevalo100% (1)
- PH, Poh Amortiguadores .Document32 paginiPH, Poh Amortiguadores .Leslie GarciaÎncă nu există evaluări
- Respuestas Unidad 3Document7 paginiRespuestas Unidad 3johanaÎncă nu există evaluări
- Reacciones BUFFERSDocument7 paginiReacciones BUFFERSAnnaisha HayamiÎncă nu există evaluări
- Informe Medidas de PH en Soluciones - Lorena AlejandraDocument4 paginiInforme Medidas de PH en Soluciones - Lorena AlejandrafviverosÎncă nu există evaluări
- Cinética y Equilibrio QuímicoDocument40 paginiCinética y Equilibrio QuímicoAlejandra Gabriel JuanezÎncă nu există evaluări
- Cálculo de Pi de Un Péptido - Rosales Ocampo Iván. 4QM1Document2 paginiCálculo de Pi de Un Péptido - Rosales Ocampo Iván. 4QM1Ivan50% (2)