Documente Academic
Documente Profesional
Documente Cultură
TermoQca Taller No. 4 2018-1
Încărcat de
Mauricio Taborda MontañoDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
TermoQca Taller No. 4 2018-1
Încărcat de
Mauricio Taborda MontañoDrepturi de autor:
Formate disponibile
PROGRAMA DE INGENIERÍA QUÍMICA
TERMODINÁMICA QUIMICA PROBLEMAS TALLER EXAMEN FINAL
1) a) Calcular la variación de la entropía que se produce al variar una muestra de gas ideal que se expande
isotérmicamente desde un volumen Vi hasta Vf. b) Calcular la variación de la entropía que se produce al
variar isotérmicamente la presión de un gas ideal desde cuando la presión de una muestra de gas ideal
cambia isotérmicamente Pi hasta Pf.
2) Calcular el cambio de entropía cuando argón a 25°C y 1 bar en un recipiente de 0,5 L se expande hasta
un 1L y simultáneamente se calienta hasta 100°C. Presuma que Cv,m=1,5R.
3) Si en una máquina térmica de Carnot, cuyos reservorios operan a las temperaturas de 227°C and 27°C y
absorbe 1000 Joule del depósito caliente por ciclo, ¿cuánto calor debe descargarse en el depósito frío y
cuánto trabajo se realiza por ciclo? ¿Cuál es la eficiencia del ciclo?
4) Un mol de un gas ideal a 300K se comprime reversible e isotérmicamente desde un volumen de 25.0 L a
un volumen de 10.0 L. La temperatura del baño de temperatura constante en el que se encuentra el
sistema se mantiene esencialmente constante a 300K durante el proceso. Calcular ∆Ssistema, ∆Salrededores y
∆Stotal del proceso.
5) Calcular la variación de entropía del sistema y del medio, junto con la correspondiente variación total de
entropía, cuando se incrementa el volumen de una muestra de 21 g de argón gaseoso a 298K y 1,50 bar
desde 1,2 L hasta 4,6L en a) una expansión reversible isotérmica b) una expansión irreversible
isotérmica contra Pext=0 y c) una expansión adiabática reversible.
6) 1,00 mol de un gas ideal a 27°C se expande isotérmicamente desde una presión inicial de 3,00 atm hasta
una presión final de 1,0 atm de dos manera: a) de forma reversible y b) contra una presión externa de
1,00 atm. Determina r los valores de Q, W, ∆U, ∆H, ∆Smedio y ∆Salrededores para cada proceso.
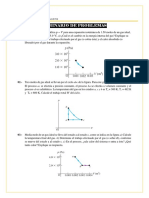
7) Un mol de un gas ideal monoatómico realiza el ciclo abca que se muestra en la figura. El proceso
a b es isotérmico a 400 K, mientras que el proceso c a es un proceso adiabático. (i) Calcular la
presión, el volumen y la temperatura en los puntos a, b y c. (ii) Calcular el trabajo total del ciclo. (iii)
Calcular los calores en cada uno de los procesos.
1
8) mol de un gas ideal se expande isotérmica y reversiblemente a 298,15 K desde un volumen inicial de
2
10 litros hasta un volumen final de 20 litros. (i) Calcule el cambio de entropía del gas. (ii) Calcule el
trabajo realizado. (iii) Calcule el flujo de calor del medio. (iv) Calcule la entropía del medio. (v) Calcule la
entropía total.
9) Se tiene un cilindro de paredes adiabáticas cerrado por un pistón móvil, también adiabático. En el
interior del cilindro se encuentra un gas ideal sitiado inicialmente a una presión p0, una temperatura T0
y ocupando un volumenV0. De pronto se aumenta bruscamente la presión externa colocando una pesa
sobre el pistón, de forma que la nueva presión externa pasa a ser p1 = rp0 > p0. El gas se comprime
hasta que las presiones interna y externa vuelven a coincidir. a) Halle la temperatura final y el volumen
final ocupado por el gas. b) Calcule el incremento de entropía del sistema. c) Supongamos que se trata de
un gas diatómico a una presión inicial de 1 atm, una temperatura inicial 20°C y un volumen inicial de
100 cm³. Si la presión final es de 2 atm. ¿Cuál es el volumen y la temperatura finales, el trabajo realizado
sobre el sistema y el aumento de entropía? Compárense estos resultados con lo que se obtienen en una
compresión adiabática reversible desde 1 a 2 atm.
10) Defina o explique los siguientes términos:
a) La entropía
b) Segunda ley de la termodinámica
c) Ciclo de Carnot
d) Tercera ley de la termodinámica
f) Procesos espontáneos
g) Fugacidad
11) Explique o desarrolle las siguientes expresiones:
a) La entropía neta del universo tiende a aumentar
b) Criterios de reversibilidad e irreversibilidad en términos de la entropía y la energía libre de Gibbs
c) La relación entre entropía y probabilidad
f) Todos los procesos espontáneos aumentan la entropía del universo
g) La entropía de cualquier sustancia es cero a 0K
S-ar putea să vă placă și
- Trabajo - Termodinamica PDFDocument2 paginiTrabajo - Termodinamica PDFExamenesPorWhatsappÎncă nu există evaluări
- Guía 1 PDFDocument3 paginiGuía 1 PDFDaniel Andres Roa UmañaÎncă nu există evaluări
- 006629420Document4 pagini006629420Jesús JacksonÎncă nu există evaluări
- FseyndrxuDocument4 paginiFseyndrxuMiguel SaavedraÎncă nu există evaluări
- Guia Numero 4Document7 paginiGuia Numero 4eutectic19920% (1)
- Factores de Conversion de UnidadesDocument6 paginiFactores de Conversion de UnidadesMel LunaÎncă nu există evaluări
- Guía de ejercicios primera ley termodinámicaDocument2 paginiGuía de ejercicios primera ley termodinámicajesus orlando peñaloza contrerasÎncă nu există evaluări
- Guía Ejercicios TDDocument6 paginiGuía Ejercicios TDKatheryn MondragónÎncă nu există evaluări
- 07-1 - Práctica Primer PpioDocument3 pagini07-1 - Práctica Primer PpioEmilia TamantiniÎncă nu există evaluări
- 2da Ley ENTROPIADocument3 pagini2da Ley ENTROPIAStefany Elizabeth Crisostomo QuispeÎncă nu există evaluări
- Fisicoquímica BDocument11 paginiFisicoquímica BRoger MendezÎncă nu există evaluări
- Serie de Jercicios Primera LeyDocument3 paginiSerie de Jercicios Primera LeyLuisCharrisÎncă nu există evaluări
- Programa INAP Mujeres Intensivo Reformulado para Enviar A NachaDocument2 paginiPrograma INAP Mujeres Intensivo Reformulado para Enviar A NachaChristianAprosoffÎncă nu există evaluări
- Problemas de Física 1 Semana 6Document3 paginiProblemas de Física 1 Semana 6ALONSO CONDORI CORNEJOÎncă nu există evaluări
- TermodinamicaDocument4 paginiTermodinamicaJimmy Erick Luque MamaniÎncă nu există evaluări
- Guía de Ejercicios Tema 3Document4 paginiGuía de Ejercicios Tema 3Kleidder ZacariasÎncă nu există evaluări
- Discusion 5Document3 paginiDiscusion 5elbetoavila0% (2)
- Guía 2 TermodinámicaDocument3 paginiGuía 2 TermodinámicaJosé Barrera CovarrubiasÎncă nu există evaluări
- Taller 3 - TermodinámicaDocument4 paginiTaller 3 - TermodinámicavanegasmarinÎncă nu există evaluări
- Gua N1 Termodinmica 2015Document9 paginiGua N1 Termodinmica 2015Elías Raphael Rubilar BugueñoÎncă nu există evaluări
- FQ1-2015.1 Tarea 01Document2 paginiFQ1-2015.1 Tarea 01Jonathan DiazÎncă nu există evaluări
- Ejercicios Primera Ley TermodinámicaDocument9 paginiEjercicios Primera Ley TermodinámicabrayanfloresmerinoÎncă nu există evaluări
- Taller 1Document10 paginiTaller 1Juan Camilo DicueÎncă nu există evaluări
- Ecuación de Estado y Primera Ley de La TermodinámicaDocument8 paginiEcuación de Estado y Primera Ley de La TermodinámicaIng Manuel QuintÎncă nu există evaluări
- Termodinámica y gases idealesDocument4 paginiTermodinámica y gases idealesVíctor Hugo Ossa OssaÎncă nu există evaluări
- Taller Numero 3Document4 paginiTaller Numero 3Daniel DBÎncă nu există evaluări
- TERMODINAMICADocument2 paginiTERMODINAMICARosanaEstela0% (1)
- Tarea Unidad IVDocument3 paginiTarea Unidad IVIsabelÎncă nu există evaluări
- Primer Taller TermoDocument10 paginiPrimer Taller Termobookgalindo0404Încă nu există evaluări
- Guía de TermodinámicaDocument9 paginiGuía de TermodinámicaJavier CortésÎncă nu există evaluări
- Practica n8 para ResolverDocument5 paginiPractica n8 para ResolverAllison FgsÎncă nu există evaluări
- Guía Termodinámica ProblemasDocument8 paginiGuía Termodinámica ProblemasyoshiwisÎncă nu există evaluări
- Termodinámica I y II examen 2do ciclo UAM 4Document10 paginiTermodinámica I y II examen 2do ciclo UAM 4Willy RiveraÎncă nu există evaluări
- Problemario QiDocument25 paginiProblemario QiIrving Sanchez0% (1)
- Primera ley termodinámica: ejercicios de calor, trabajo y energía internaDocument7 paginiPrimera ley termodinámica: ejercicios de calor, trabajo y energía internaOleggValVilÎncă nu există evaluări
- Taller 1Document10 paginiTaller 1Monica Oramas0% (2)
- Taller 3 Calor y Ondas 2016-1Document4 paginiTaller 3 Calor y Ondas 2016-1Serghio AndresÎncă nu există evaluări
- Taller 2-GASES Y Ciclos - 2020Document2 paginiTaller 2-GASES Y Ciclos - 2020caren malpicaÎncă nu există evaluări
- Entropía y cambios de estado en sistemas termodinámicosDocument4 paginiEntropía y cambios de estado en sistemas termodinámicosJose Vásquez GómezÎncă nu există evaluări
- Termodinámica: Leyes, Máquinas y CálculosDocument4 paginiTermodinámica: Leyes, Máquinas y CálculosOscar MerinoÎncă nu există evaluări
- PROBLEMAS I UnidadDocument3 paginiPROBLEMAS I UnidadJorge VillegasÎncă nu există evaluări
- Problemas Capítulo 3 TermodinámicaDocument19 paginiProblemas Capítulo 3 Termodinámicacecilia esquivelÎncă nu există evaluări
- Serie de EjerciciosDocument2 paginiSerie de EjerciciosChanocua Gutierrez MetztliÎncă nu există evaluări
- Segundo principio termodinámica problemasDocument5 paginiSegundo principio termodinámica problemasAnthony Quiñones0% (1)
- Guia de Ejerccios 2Document4 paginiGuia de Ejerccios 2Elvin VelasquezÎncă nu există evaluări
- Serie de Ejercicios Segunda LeyDocument3 paginiSerie de Ejercicios Segunda LeyLuisCharrisÎncă nu există evaluări
- Guia de EjercciosDocument4 paginiGuia de EjercciosDavid RiveraÎncă nu există evaluări
- Taller de Procesos Termodinámicos 201820Document4 paginiTaller de Procesos Termodinámicos 201820Jairo Mesa ChaparroÎncă nu există evaluări
- Procesos TermodinámicosDocument4 paginiProcesos TermodinámicosFernandoÎncă nu există evaluări
- Taller 3 Calor y Ondas 2015-1Document4 paginiTaller 3 Calor y Ondas 2015-1Bondmads50% (2)
- Taller Tercer CorteDocument3 paginiTaller Tercer CorteGerman AcebedoÎncă nu există evaluări
- Taller 2 (Primeraley y Gases Ideales)Document3 paginiTaller 2 (Primeraley y Gases Ideales)Jessika Julieth Siachoque SuarezÎncă nu există evaluări
- Hoja de Problemas #04Document4 paginiHoja de Problemas #04Paul Quiroz AliagaÎncă nu există evaluări
- Física II Taller 4 gases idealesDocument3 paginiFísica II Taller 4 gases idealesNelson MuñozÎncă nu există evaluări
- Segunda Ley TermodinamicaDocument3 paginiSegunda Ley Termodinamicacarlos danielÎncă nu există evaluări
- Ingeniería química. Soluciones a los problemas del tomo IDe la EverandIngeniería química. Soluciones a los problemas del tomo IÎncă nu există evaluări
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe la EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesÎncă nu există evaluări
- Solución Al Ejercicio Propuesto 2Document5 paginiSolución Al Ejercicio Propuesto 2Mauricio Taborda MontañoÎncă nu există evaluări
- Taller MacromoleculasDocument2 paginiTaller MacromoleculasMauricio Taborda MontañoÎncă nu există evaluări
- UNIDAD 6 - Qca - Analitica I - Ing PDFDocument17 paginiUNIDAD 6 - Qca - Analitica I - Ing PDFMauricio Taborda MontañoÎncă nu există evaluări
- Cambos de Fase y ProcesosDocument18 paginiCambos de Fase y ProcesosAdgue Gallegos CardenasÎncă nu există evaluări
- UNIDAD 6 - Qca - Analitica I - Ing PDFDocument17 paginiUNIDAD 6 - Qca - Analitica I - Ing PDFMauricio Taborda MontañoÎncă nu există evaluări
- Taller MacromoleculasDocument2 paginiTaller MacromoleculasMauricio Taborda MontañoÎncă nu există evaluări
- UNIDAD 6 - Qca - Analitica I - Ing PDFDocument17 paginiUNIDAD 6 - Qca - Analitica I - Ing PDFMauricio Taborda MontañoÎncă nu există evaluări
- TERMOQUÍMICADocument13 paginiTERMOQUÍMICAMery Jane Greig BriceñoÎncă nu există evaluări
- Taller MacromoleculasDocument2 paginiTaller MacromoleculasMauricio Taborda MontañoÎncă nu există evaluări
- DMTDocument3 paginiDMTMauricio Taborda MontañoÎncă nu există evaluări
- Termodinámica Química IDocument7 paginiTermodinámica Química IMauricio Taborda MontañoÎncă nu există evaluări
- Termodinámica Química IDocument7 paginiTermodinámica Química IMauricio Taborda MontañoÎncă nu există evaluări
- SN2 SN1 CarbocationesDocument37 paginiSN2 SN1 CarbocationesMauricio Taborda MontañoÎncă nu există evaluări
- Mecánica de Fluidos CursoDocument6 paginiMecánica de Fluidos CursoAdrian PaucarÎncă nu există evaluări
- Serie 1Document4 paginiSerie 1Aleex CasÎncă nu există evaluări
- El Sonido: Se Originaran Ondas LongitudinalesDocument26 paginiEl Sonido: Se Originaran Ondas LongitudinalesAgus ShaggyÎncă nu există evaluări
- Clase 0 - IntroducciónDocument24 paginiClase 0 - IntroducciónGalvez WalterÎncă nu există evaluări
- Viga de Riostra - GECOSADocument11 paginiViga de Riostra - GECOSAgivixarÎncă nu există evaluări
- Vigas LaminadasDocument2 paginiVigas LaminadasAnderson CabreraÎncă nu există evaluări
- Clase 4 - Estructuras Estáticamente Indeterminadas, ELEMENTOS CARGADOS AXIALMENTEDocument45 paginiClase 4 - Estructuras Estáticamente Indeterminadas, ELEMENTOS CARGADOS AXIALMENTESmith RoblesÎncă nu există evaluări
- Ley de Los Gases BiofisicaDocument6 paginiLey de Los Gases BiofisicaAkira KarenÎncă nu există evaluări
- Ejercicios Resueltos de FIS 102Document6 paginiEjercicios Resueltos de FIS 102UdhduidÎncă nu există evaluări
- III.1 Esfuerzos y Deformaciones en Pavimentos FlexiblesDocument36 paginiIII.1 Esfuerzos y Deformaciones en Pavimentos FlexiblesGeorge Jeisso Principe100% (1)
- TEMASFISICADocument82 paginiTEMASFISICACarlos Alberto Lozano EscobedoÎncă nu există evaluări
- QF1 Tema1 ProbDocument5 paginiQF1 Tema1 ProbÁLvaro Salsavilca CayetanoÎncă nu există evaluări
- Taller8 (TORQUE)Document2 paginiTaller8 (TORQUE)Alejandro Vallejo ParraÎncă nu există evaluări
- Problemas Diarios Semana 10Document4 paginiProblemas Diarios Semana 10Angel Enoc Gutiérrez AranibarÎncă nu există evaluări
- Guia de Materia Dinamica de NewtonDocument7 paginiGuia de Materia Dinamica de Newtonhalegria_1Încă nu există evaluări
- Modelo de Respuesta: Universidad Nacional Abierta Vicerrectorado Académico Área Ingeniería de SistemasDocument11 paginiModelo de Respuesta: Universidad Nacional Abierta Vicerrectorado Académico Área Ingeniería de SistemasMary RondonÎncă nu există evaluări
- Ingeniería antisísmica: Respuesta a cargas armónicasDocument30 paginiIngeniería antisísmica: Respuesta a cargas armónicasGerardo ChahuaÎncă nu există evaluări
- Formulario Mas IbDocument2 paginiFormulario Mas Iboctaviopozo andresauriaÎncă nu există evaluări
- Estudio y Diseño de Sistemas para El Acondicionamiento AcústicoDocument500 paginiEstudio y Diseño de Sistemas para El Acondicionamiento AcústicoVictoria S. Sánchez González100% (2)
- Tema 2 - Tipología de InestabilidadesDocument25 paginiTema 2 - Tipología de InestabilidadesAlejandro AlbiaÎncă nu există evaluări
- AE1 - P5 - Deflexiones de Vigas Parte 2 para LlenarDocument13 paginiAE1 - P5 - Deflexiones de Vigas Parte 2 para LlenarSergio Delgado EscobedoÎncă nu există evaluări
- Actividad de refuerzo de física sobre velocidad media y aceleración de un conejoDocument4 paginiActividad de refuerzo de física sobre velocidad media y aceleración de un conejoSergio Alvarado PedrazaÎncă nu există evaluări
- Mecánica física: Construcción y análisis de la máquina de GoldbergDocument3 paginiMecánica física: Construcción y análisis de la máquina de GoldbergSebastian ChavezÎncă nu există evaluări
- Primera Practica SOLUCIONARIO 13-01.06 Procesos IDocument7 paginiPrimera Practica SOLUCIONARIO 13-01.06 Procesos ICarlos QuispeÎncă nu există evaluări
- Cedoc FisicaDocument9 paginiCedoc FisicaLeonardoPeñaÎncă nu există evaluări
- Informe Practica 2 ActuadoresDocument6 paginiInforme Practica 2 ActuadoresPaula Andrea Lopez BalcazarÎncă nu există evaluări
- ExamenDocument31 paginiExamenJessy Hervert Rivera100% (1)
- S06s1 MaterialDocument29 paginiS06s1 MaterialJennifer Elizabeth Nina VargasÎncă nu există evaluări
- Unidad 2 - T1 - El Campo EléctricoDocument26 paginiUnidad 2 - T1 - El Campo Eléctricoandrea vasquez lopezÎncă nu există evaluări