Documente Academic
Documente Profesional
Documente Cultură
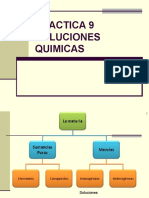
Disoluciones
Încărcat de
Julieta ZerbattoTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Disoluciones
Încărcat de
Julieta ZerbattoDrepturi de autor:
Formate disponibile
1) Calcular el % m/m de una solución que tiene 6 g de soluto en 80 g de solución.
Aplicamos la fórmula: %m/m= 6g/80 g ×100=7,5%
2) Calcular el % m/m de una solución que tiene 10 g de soluto y 110 g de solvente.
En este caso la masa de la solución es de 120 g ya que resulta de sumar los 10 g de soluto más los 110 g de solvente.
%m/m=10 g / 120 g ×100=8,33%
3) Calcular la masa de soluto que tendría una solución de 220 g que es 4% m/m.
En este caso podemos despejar la masa de soluto de la fórmula. Nos queda:
masa de soluto= [(% m/m solución)×masa solución] /100 = 4 %×220 g / 100 = 8,8 g
4) ¿Cuántos g de soluto y solvente tendrán 320 g de solución cuya concentración es 5% m/m?
masa de soluto=[(% m/m solución)×masa solución]/100 = 5 %×320 g / 100 = 16 g
La masa de solvente es fácil obtenerla. Directamente le restamos a la masa de la solución la masa de soluto.
Masa de solvente = 320 g – 16 g = 304 g
5) ¿Cuántos g de soluto tendrán 1200 ml de solución cuya concentración es de 6% m/v?
De la fórmula:
% m/v=masa soluto×100 / volumen solución
despejamos la masa de soluto. masa soluto = % m/v×volumen solución / 100 = 6 % m/v ×1200 ml / 100 = 72 g
6) ¿Qué volumen tendrá una solución al 5% m/v que contiene 80 g de soluto?
De la misma fórmula utilizada en el anterior problema despejamos el volumen.
V=(masa soluto)×100 m/v solución = 80 g×100 / 5% = 1600 ml
7) ¿Cuál será el % v/v en una solución que se preparó con 9 ml de soluto y 180 ml de solvente?
El volumen de la solución lo obtenemos sumando a ambos volúmenes.
% v /v = (volumen soluto)×100 / volumen solución = 9 ml ×100 / (180 ml +9 ml) = 4,76 %
8) ¿Cuáles son los volúmenes de soluto y solvente de 2000 ml de una solución al 16 % v/v?.
volumen soluto = (% v/v solución)×volumen solución / 100 = 16 %×2000 ml / 100 = 320 ml
Volumen de solvente = 2000 ml – 320 ml = 1680 ml
Densidad: Con la densidad podemos relacionar una cantidad de masa a su equivalente en volumen o viceversa.
δ=m/V
2 ejemplos.
1) ¿Cuántos g habrán en un volumen de 12 ml de una solución que tiene una densidad de 1,84 g/ml?
δ=m/V → m=δ×V =1,84 g/ml ×12 ml =22,08 g
2) ¿Qué volumen tendrá una masa de 28 g de una solución cuya densidad es 1,76 g/ml?
De la fórmula anterior despejamos al volumen.
δ=m/V → V= m / δ = 28 g / 1,76 g/ml = 15,91 ml
Molaridad:
1) Calcular la M de una solución que tiene 8 g de hidróxido de sodio (NaOH) en 680 ml de solución.
Según la fórmula de Molaridad. M = n° moles / V
Para calcular la Molaridad hay que saber la cantidad de moles y el volumen expresado en litros.
La cantidad de moles se calcula por n° moles=m/masa molecular
masa molecular OHNa:
O) 16x 1 = 16
H) 1 x 1 = 1
Na)23x1 = 23 ______ total: 40 —→ n ° moles=8g/40g=0,2 moles
Los 680 ml pasados a litros son 0,68 l.
M=n ° moles/V = 0,2 moles/0,68 l=0,294 M
2) ¿Cuántos moles de ácido clorhídrico (HCl) serán necesarios para hacer una solución 1,4M que tenga un volumen de
3.6 l?
M=n° moles/V Despejamos n° de moles de la fórmula quedando: n° moles= M ×V =1,4 M ×3,6 l =5,04 moles
3) ¿Qué volumen tendrá una solución que es 2 M y contiene 18 g de hidróxido de potasio (KOH)?
El volumen lo despejamos de la fórmula de molaridad. Y los 18 g de soluto lo pasamos a moles.
M=n° moles/V → V=n° moles / M
masa molecular KOH:
O) 16x 1 = 16 H) 1 x 1 = 1 K) 39x1 = 39 ______ total: 56 —→ n° moles=18 g/56g=0,321 moles
Así:
V=n° moles / M = 0,321 moles / 2 = 0,16 l
4) ¿Cómo prepararía 2 l de una solución 0,5 M de hidróxido de sodio (NaOH) a partir de otra también de hidróxido de
sodio cuya concentración es 1,8 M?
Cuando se prepara una solución a partir de otra de mayor concentración, lo que se hace es tomar una cantidad de la de
mayor concentración y luego diluirla con agua hasta llegar al volumen requerido de la de menor concentración. Para
saber cuánto debemos tomar de la más concentrada usamos una fórmula.
M1 × V1= M2 × V2
Los subíndices numéricos se usan para diferenciar a las dos soluciones de distinta concentración.
Llamamos 1 a la más concentrada y 2 a la más diluida.
1,8 M ×V1=0,5 M ×2 l → V1=0,5 M ×2 l / 1,8 M = 0,555 l
5) Calcular la M de una solución de ácido sulfúrico (H2SO4) de densidad 1,82 g/ml y de 94% de pureza.
Sabemos que para calcular la molaridad tenemos que tener los datos de la cantidad de moles y el volumen expresado en
litros.
A partir de la densidad deducimos que en 1 ml de solución hay 1,82 g de masa de solución. Por lo tanto en 1 litro habrá
1820 g de solución. Ahora bien, de esos 1820 g sólo el 94% es puro en el
soluto que tenemos. Con un simple cálculo de porcentaje obtendremos la cantidad que realmente hay de soluto en esos
1820 g.
94% de 1820 g = 1710,80 g A partir de esta masa sacamos la cantidad de moles.
masa molecular H2SO4:
O) 16x 4 = 64 H) 1 x 2 = 2 S) 32x1 = 32 ______ total: 98 —→ n ° moles=1710,80 g/98g=17,457 moles
Si dividimos esta cantidad de moles por un litro obtenemos directamente la molaridad.
Molaridad = 17,457 M (molar).
6) ¿Cuál será la Normalidad de una solución de ácido clorhídrico que tiene 6 g de éste en 1200 ml de solución?
A partir de la fórmula: N = n° equivalentes soluto / V solución en l
Tenemos que calcular el número de equivalentes de soluto y pasar a litros el volumen que ya tenemos de solución.
En el caso de los ácidos el número de equivalentes se calcula dividiendo la masa por el peso del equivalente químico del
mismo. El equivalente químico en el caso de los ácidos se calcula
dividiendo el peso molecular por la cantidad de hidrógenos que tiene la molécula. El ácido clorhídrico tiene un solo
átomo de hidrógeno, por lo tanto su peso equivalente es el mismo.
masa molecular HCl:
H) 1 x 1 = 1
Cl) 35,5x1 = 35,5 ____ total: 36,5 —→ equivalente químico=masa molecular / n° de Hidrógenos = 36,5 g / 1=36,5 g
Así: n° equiv soluto=masa soluto/equiv qco = 6 g/36,5 g=0,164
N=n ° equivalentes soluto /V solución en l=0,167/1,2 l=0,137 N
7) ¿Qué volumen tendrá una solución 2,6 N de hidróxido de calcio Ca(OH)2 si la cantidad de soluto usada fue de 4
moles?
N=n ° equivalentes soluto/V solución en l → V=n° eq soluto/N
En este caso tenemos moles pero no equivalentes. Se puede pasar de una manera sencilla de moles a equivalentes.
Teniendo en cuenta que para calcular el peso de un equivalente de un hidróxido se divide al peso molecular por la
cantidad de grupos oxhidrilos. El peso del equivalente es el peso molecular dividido por 2, ya que este hidróxido posee 2
grupos oxhidrilos. Deducimos por lo tanto que en un mol de este compuesto hay 2 equivalentes. Como tenemos 4 moles
del hidróxido tenemos 8 equivalentes.
V=n° eq soluto/N=8 eq/2,6 N = 3,077 l
8) Calcular la Normalidad de:
Una solución 4 M de NaOH. Una solución 6 M de Mg (OH)2 Una solución 0,5 M de H2SO4
Una solución 0,8 M de HNO3
En el caso del NaOH vemos que tiene un solo radical hidroxilo, o sea que el peso molecularl (mol) coincide con el peso
de un equivalente químico. Por lo tanto si es 4 M también será 4 N.
En el segundo caso, el Mg(OH)2, tiene 2 grupos hidroxilos. El peso de un equivalente será la mitad del peso molecular.
En un mol hay dos equivalentes. Entonces si es 6 M será 12 N.
En el tercer caso, vemos que el ácido sulfúrico tiene 2 hidrógenos. O sea que el peso de su equivalente será la mitad de
su mol. En un mol hay dos equivalentes. Así que si es 0.5 M será 1 N.
En el último caso, el ácido nítrico, tiene un solo hidrógeno. Así que un mol equivale a un equivalente. Es igual su
molaridad y su normalidad. Es 0.8 M y 0.8 N.
9) Calcular la molalidad de una solución que se prepara con 16 g de Hidróxido de Potasio (KOH) y 1600 g de agua.
m = moles de soluto/Kg de solvente
Tenemos que transformar los 16 g del soluto a moles.En el problema 3 se calculó la mol KOH que es 56g, luego n °
moles= 16 g/56g =0,286 moles
La fórmula es: m=moles de soluto/Kg de solvente= 0,286 moles/1,6 Kg=0,179 m
10) ¿Cuántos g de soluto habrá en una solución 2,8 m de Li(OH), que se hizo con 500 ml de agua.?
En el caso del agua 1 gramo equivale a un ml. Por lo tanto aceptamos que 500 ml son 500 g
Primero calcularemos la cantidad de moles de soluto. Despejando de la fórmula:
m=moles de soluto/Kg de solvente → moles soluto=m×Kg de solvente=2,8 m×0,5 Kg=1,4 moles
Ahora todo consiste en pasar esta cantidad de moles a g.
masa molecular LiOH:
O) 16x 1 = 16
H) 1 x 1 = 1
Li) 7 x1 = 7 ______ total: 24 → n ° moles=m/M
m = n° moles×M =1,4 moles×24 g =33,6 g
11) Calcular la masa de agua que se utilizó para preparar una solución 2,2 m si se utilizó 12 g de soluto (NaOH).
Primero hay que saber la cantidad de moles de soluto. El peso molecular de NaOH es 40.
n ° moles= m/M = 12 g / 40 =0,3 moles
Luego de la fórmula de m:
m=moles soluto/Kg de solvente → Kg de solvente = moles de soluto / m = 0,3 moles/2,2 =0,136 Kg agua
12) Calcular la M y N de una solución que se preparó con 28 g de Mg(OH)2 al 82 % de pureza en un volumen final de
1600 ml.
Primero debemos corregir la masa de 28 g ya que al no ser 100% pura en realidad no hay 28 g sino que habrá algo
menos.
82% de 28g = 22,96 g.
Ahora averiguamos a cuantos moles equivale esta masa.
masa molecular Mg(OH)2:
O) 16x 2 = 32
H) 1 x 2 = 2
Mg) 24x1 = 24 ______ total: 58 —→ n ° moles=22,96 g/58 =0,395 moles
M=n° moles/V= 0,395 moles/1,6 l = 0,247 M
Como este hidróxido tiene 2 radicales oxhidrilos. Por cada mol tenemos 2 equivalentes. Por lo tanto, será 0.49 N
S-ar putea să vă placă și
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe la EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadÎncă nu există evaluări
- Ejercicios Resueltos de SolucionesDocument7 paginiEjercicios Resueltos de SolucionesBrayan Joseph Gomez AmayaÎncă nu există evaluări
- Ejercicios de Swwwwoluciones QuimicasDocument8 paginiEjercicios de Swwwwoluciones QuimicasJonathanÎncă nu există evaluări
- Ejercicios de Concentración de Soluciones ResueltosDocument9 paginiEjercicios de Concentración de Soluciones ResueltosGuille Aguilar100% (1)
- Ejercicios de SolucionesDocument10 paginiEjercicios de SolucionesAlejandra CastellanosÎncă nu există evaluări
- Soluciones Químicas - Química y Algo MásDocument137 paginiSoluciones Químicas - Química y Algo Másjose12391Încă nu există evaluări
- Soluciones QuimicasDocument12 paginiSoluciones QuimicasHollmanDanielSalazarÎncă nu există evaluări
- Concentracion SolucionesDocument22 paginiConcentracion SolucionesSantiago FierroÎncă nu există evaluări
- Las SolucionesDocument57 paginiLas SolucionesJorge SegoviaÎncă nu există evaluări
- Guia 10 Primer AñoDocument10 paginiGuia 10 Primer AñoJerson GermánÎncă nu există evaluări
- Concentración de Soluciones Químicas Conceptos y EjerciciosDocument9 paginiConcentración de Soluciones Químicas Conceptos y EjerciciosLorena Isabel Arancibia CortesÎncă nu există evaluări
- Qui MicaDocument9 paginiQui Micaesteban perezÎncă nu există evaluări
- Las Soluciones-CsjDocument57 paginiLas Soluciones-CsjQuenguan FranklinÎncă nu există evaluări
- Taller 4 Soluciones Quimicas - Grupo 1 - 1370144,50,58,66Document20 paginiTaller 4 Soluciones Quimicas - Grupo 1 - 1370144,50,58,66Danny HerreraÎncă nu există evaluări
- Taller Química Calculo de Concentración en Las SolucionesDocument6 paginiTaller Química Calculo de Concentración en Las SolucionesAnggel Ruiz FernandezÎncă nu există evaluări
- Guia Mensual de Quimica 2Document33 paginiGuia Mensual de Quimica 2Jesús MedinaÎncă nu există evaluări
- Tema 5 SolucionesDocument63 paginiTema 5 SolucionesDasigo SzkamardaÎncă nu există evaluări
- CONCENTRACION Más Teoría y Ejercicio de SolucionesDocument1 paginăCONCENTRACION Más Teoría y Ejercicio de SolucionesHoracio Alfredo RodriguezÎncă nu există evaluări
- So Luci OnesDocument31 paginiSo Luci OnesPatricia BusteloÎncă nu există evaluări
- Soluciones 10junioDocument10 paginiSoluciones 10junioDavid Reinaldo Ascue SalgadoÎncă nu există evaluări
- Normalidad-Fraccion Molar - Molaridad, MoladidadDocument11 paginiNormalidad-Fraccion Molar - Molaridad, MoladidadRomina. LopezÎncă nu există evaluări
- Moises Pizarro TareaS5Document6 paginiMoises Pizarro TareaS5Moisés PizarroÎncă nu există evaluări
- Resolucion ParcialDocument7 paginiResolucion ParcialpatriciapsicosocialÎncă nu există evaluări
- Actividad N°8-Soluciones (Ii)Document5 paginiActividad N°8-Soluciones (Ii)manuel FigueiraÎncă nu există evaluări
- Presentacindedonjulio 160807204855Document26 paginiPresentacindedonjulio 160807204855remberto mercadoÎncă nu există evaluări
- Disolución de ConcentraciónDocument6 paginiDisolución de ConcentraciónNorwis GonzalezÎncă nu există evaluări
- Quimica Guia 1 Soluciones y ConcentracionesDocument6 paginiQuimica Guia 1 Soluciones y Concentracioneszy4d7n589gÎncă nu există evaluări
- Plantilla - Evaluacion - Desarrollo Sem 5Document5 paginiPlantilla - Evaluacion - Desarrollo Sem 5Jose Antonio Baeza GarrigaÎncă nu există evaluări
- 3ro Medio Disoluciones QuimicasDocument40 pagini3ro Medio Disoluciones Quimicaseioa3Încă nu există evaluări
- Quimica en Procesos ProductivosDocument7 paginiQuimica en Procesos ProductivosDaniel Ordenes CamposÎncă nu există evaluări
- Quimica 2Document12 paginiQuimica 2MARIA FERNANDA COPARIÎncă nu există evaluări
- Informe de Laboratorio de Quimica Concentraciones CorregidoDocument13 paginiInforme de Laboratorio de Quimica Concentraciones CorregidoFabio Andre FeeneyÎncă nu există evaluări
- Concentración Porcentual en PesoDocument8 paginiConcentración Porcentual en Pesohongudo100% (1)
- Disoluciones Ejercicios (Autoguardado)Document9 paginiDisoluciones Ejercicios (Autoguardado)Keissy Brenda Valles DreyfusÎncă nu există evaluări
- Unidades Químicas de Concentración de Las SolucionesDocument9 paginiUnidades Químicas de Concentración de Las SolucionesDaniela CárcamoÎncă nu există evaluări
- ANEXO Unidades Físicas de Concentración Soluciones 2 Trabajo 11-3 M.D.L.A.C.G.Document10 paginiANEXO Unidades Físicas de Concentración Soluciones 2 Trabajo 11-3 M.D.L.A.C.G.Music & PinkÎncă nu există evaluări
- Cálculo de Concentración en Soluciones QuímicasDocument6 paginiCálculo de Concentración en Soluciones QuímicasTania MartinezÎncă nu există evaluări
- Expresión de Concentración de SolucionesDocument60 paginiExpresión de Concentración de SolucionesPatricia BusteloÎncă nu există evaluări
- Soluciones QuimicasDocument58 paginiSoluciones QuimicasrdiazbetetaÎncă nu există evaluări
- P DisolucionesDocument6 paginiP DisolucionesIsabel Ramírez100% (1)
- Guía de Soluciones QuímicasDocument4 paginiGuía de Soluciones QuímicasyolethÎncă nu există evaluări
- Seminario SolucionesDocument7 paginiSeminario SolucionesJulio TiradoÎncă nu există evaluări
- Ejercicios ConcentracionesDocument8 paginiEjercicios ConcentracionesIALCÎncă nu există evaluări
- Juan Lagos Tarea5Document6 paginiJuan Lagos Tarea5Jp Lagos Brvo100% (1)
- Disoluciones Resueltos PDFDocument5 paginiDisoluciones Resueltos PDFadolfo olmosÎncă nu există evaluări
- Disoluciones ResueltosDocument5 paginiDisoluciones ResueltosGino PajueloÎncă nu există evaluări
- Udelas-M - Dulo 5-SolucionesDocument8 paginiUdelas-M - Dulo 5-SolucionesJonathan MedinaÎncă nu există evaluări
- 3 .Disoluciones 2Document31 pagini3 .Disoluciones 2Karen Vidal CortezÎncă nu există evaluări
- Relaciones EstequiometricasDocument39 paginiRelaciones EstequiometricasAnthony Soto L.50% (2)
- Qumica IsraelDocument5 paginiQumica IsraelIsrarlÎncă nu există evaluări
- QUÍMICA EN PROCESOS PRODUCTIVOS Semana 5Document6 paginiQUÍMICA EN PROCESOS PRODUCTIVOS Semana 5MILAGROS ESTEFANIA PERALTA DUARTEÎncă nu există evaluări
- Cálculos de Concentraciones ++Document48 paginiCálculos de Concentraciones ++Katherin GuillenÎncă nu există evaluări
- Ingeniería química. Soluciones a los problemas del tomo IDe la EverandIngeniería química. Soluciones a los problemas del tomo IÎncă nu există evaluări
- AVZ FQ3 CapModeloDocument12 paginiAVZ FQ3 CapModeloJulieta ZerbattoÎncă nu există evaluări
- EstadisticaDocument12 paginiEstadisticaJulieta ZerbattoÎncă nu există evaluări
- Error Absoluto y Error RelativoDocument4 paginiError Absoluto y Error RelativoJulieta Zerbatto100% (1)
- Ejercicios Primer AñoDocument2 paginiEjercicios Primer AñoJulieta ZerbattoÎncă nu există evaluări
- Preguntero 2 Quimica Inorganic 30-091Document8 paginiPreguntero 2 Quimica Inorganic 30-091Celeste TolozaÎncă nu există evaluări
- Clase 5. Métodos de Control de Sistemas de Ventilación IndustrialDocument67 paginiClase 5. Métodos de Control de Sistemas de Ventilación IndustrialDavid LinguaÎncă nu există evaluări
- Antioxidant Activity and Chemical Study of The Fun PDFDocument7 paginiAntioxidant Activity and Chemical Study of The Fun PDFIdel Fernando Ramirez MesaÎncă nu există evaluări
- Tema 33Document21 paginiTema 33Victor PereaÎncă nu există evaluări
- Soluciones QuimicasDocument11 paginiSoluciones QuimicasAlejandra HernandezÎncă nu există evaluări
- Guía 2 de Química 9° P3Document2 paginiGuía 2 de Química 9° P3vivianaÎncă nu există evaluări
- Solucion de La PC 3 de LaboratorioDocument6 paginiSolucion de La PC 3 de LaboratorioGUILENIA YASHIRA LOAYZA CASTILLOÎncă nu există evaluări
- Taller QuimicaDocument17 paginiTaller QuimicaAndres PuentesÎncă nu există evaluări
- 10Document402 pagini10Noemi ColungaÎncă nu există evaluări
- Práctica 7. Conocimiento de Técnicas Analíticas Parte 1Document5 paginiPráctica 7. Conocimiento de Técnicas Analíticas Parte 1Edith GaytánÎncă nu există evaluări
- INFORME DE PRACTICAS DE LABORATORIO QUIMICA Final PDFDocument85 paginiINFORME DE PRACTICAS DE LABORATORIO QUIMICA Final PDFlorenaÎncă nu există evaluări
- Leche ConcentradasDocument48 paginiLeche ConcentradasCarMarquzÎncă nu există evaluări
- Guía Lab Nº1 AAS - 2023Document7 paginiGuía Lab Nº1 AAS - 2023German Morales LoyolaÎncă nu există evaluări
- Matematica Superior Folder PDFDocument46 paginiMatematica Superior Folder PDFFranco GarciaÎncă nu există evaluări
- Tema 4 - EJERCICIOS de Cálculos de DosisDocument1 paginăTema 4 - EJERCICIOS de Cálculos de DosisRosmery HuaringaÎncă nu există evaluări
- Previo 6. Propiedades ColigativasDocument5 paginiPrevio 6. Propiedades ColigativasGiselleÎncă nu există evaluări
- Preguntas FrecuentesDocument3 paginiPreguntas FrecuentesFrida Paucar AlbarracinÎncă nu există evaluări
- Cuadernillo Ciencias Naturales y Educación Ambiental - 8ºDocument18 paginiCuadernillo Ciencias Naturales y Educación Ambiental - 8ºINSTITUCION BOMBONA100% (1)
- Prácica de Laboratorio N°2 - Preparación de Soluciones Ácido - BaseDocument22 paginiPrácica de Laboratorio N°2 - Preparación de Soluciones Ácido - BaseMiguel Angel Paternina RuizÎncă nu există evaluări
- Trabajo No 8 Final de Procesos Industriales 2017Document2 paginiTrabajo No 8 Final de Procesos Industriales 2017Giovanny Molina100% (1)
- Cuantificación de Hierro en Tabletas de Sulfato Ferroso Por Espectroscopía de Absorción Atómica de LlamaDocument9 paginiCuantificación de Hierro en Tabletas de Sulfato Ferroso Por Espectroscopía de Absorción Atómica de LlamaCalidad LassÎncă nu există evaluări
- Taller de Químic1Document6 paginiTaller de Químic1Edirley EscalanteÎncă nu există evaluări
- Equilibrio QuímicoDocument38 paginiEquilibrio QuímicoClever Alexander Saldaña VásquezÎncă nu există evaluări
- Examen ACV S04 Laboratorio N 2 Simulador de Cin Tica Qu Mica PDFDocument10 paginiExamen ACV S04 Laboratorio N 2 Simulador de Cin Tica Qu Mica PDFOmar Huaraya50% (4)
- Ejericio PreparcialDocument6 paginiEjericio PreparcialPau SanchezÎncă nu există evaluări
- Guía de Ejercicios de Unidades de Concentracion FisicasDocument3 paginiGuía de Ejercicios de Unidades de Concentracion FisicasCamila Barrera MenesesÎncă nu există evaluări
- ColigatDocument47 paginiColigatTakshivana Navarro Flores100% (1)
- Aplicación de La Deshidratación Osmótica en Frutas y VegetalesDocument5 paginiAplicación de La Deshidratación Osmótica en Frutas y VegetalesPaulo Fabrizio De la TOrreÎncă nu există evaluări
- 1-1 Manual para La Elaboración de Planes de Reparación PDFDocument62 pagini1-1 Manual para La Elaboración de Planes de Reparación PDFLilo AmiraÎncă nu există evaluări