Documente Academic
Documente Profesional
Documente Cultură
TD Dosages Directs 1
Încărcat de
Youssef ArbaDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
TD Dosages Directs 1
Încărcat de
Youssef ArbaDrepturi de autor:
Formate disponibile
Niveau : 1ére BAC Année scolaire
Physique Chimie ----/-------
Exercice 1
Pour déterminer la concentration C1 en diiode I2(aq) d’une solution de Tarnier, on dose un volume
V1=25,0 mL de solution de Tarnier par une solution de thiosulfate de sodium (2Na+(aq) + S2O32-(aq)) de
concentration C2=0,0200 mol/L.
Données : I2(aq) / I-(aq) et S4O62- (aq) / S2O32- (aq)
Le volume versé à l’équivalence est égal à V2E=12,1 mL.
1. Etablir l’équation de la réaction de dosage.
2. Etablir un tableau d’avancement.
3. En déduire une relation entre n(I2) et n(S2O32-).
4. Déterminer la concentration C1 du diiode.
Exercice 2
Un détartrant pour cafetière vendu dans le commerce se présente sous la forme d’une poudre blanche : l’acide
sulfamique ( H2NSO3H ) qui, en solution, à les mêmes propriétés que l’acide chlorhydrique et que l’on notera HA.
On dissous m = 1,50 g de ce détartrant dans de l’eau distillée à l’intérieur d’une fiole jaugée de volume
V = 200 mL que l’on complète jusqu’au trait de jauge. On
dispose alors d’une solution S de concentration en acide CA.
On dose VA = 20 mL de S par une solution aqueuse
d’hydroxyde de sodium ( Na+(aq) + HO-(aq) ) de
concentration CB = 0,10 mol.L-1.
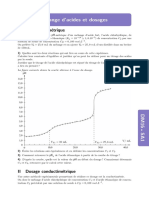
Le graphique donnant la conductance G de la solution en
fonction du volume VB de solution d’hydroxyde de sodium
versé est donnée ci-dessous.
On donne les équations des réactions suivantes :
- réaction de dissolution de HA dans l’eau : HA(s) + H2OO H 3O+ (aq) + A- (aq) ;
- réaction support du dosage : H3O+ (aq) + HO- 2 H2O(aq) .
1. Dresser le tableau permettant de suivre l’évolution du dosage en fonction de l’avancement x.
2. Définir l’équivalence du dosage. Quelle relation peut-on écrire entre les différentes quantités de réactifs à
l’équivalence ?
3. Comment peut-on déterminer graphiquement le volume VBE de solution d’hydroxyde de sodium versé à
l’équivalence ? Déterminer graphiquement VBE. En déduire la concentration CA de la solution S.
4. Calculer la masse d’acide sulfamique présente dans S ; en déduire le pourcentage massique de cet acide dans le
détartrant étudié.
Données : Masse molaire moléculaire de l’acide sulfamique : M(HA) = 97,0 g.mol-1
Exercice 3
Le gel détartrant est dilué pour obtenir une solution de concentration 100!fois plus faible. Un volume V=5,0mL de
la solution diluée est introduit dans un bécher, auquel on ajoute 170 mL d’eau distillée. Un Titrage
conductimétrique est alors réalisé avec une solution aqueuse d’hydroxyde de sodium (Na+(aq) ;HO- (aq)) de
concentration 2,0.10-2 mol.L-1. Les mesures de conductivité σ au cours du titrage, en fonction du volume V
de solution titrante versée, sont présentées dans le tableau ci-dessous.
V(mL) 0 2 4 6 8 10 12 14 16 18 20 22
σ(mS/m) 56,61 49,38 42,4 35,2 28,2 22,6 23,8 28,3 32,8 37,4 41,9 46,4
1. Faire un schéma légendé du montage permettant de réaliser le titrage conductimétrique.
2. Ecrire l’équation de la réaction support du titrage.
3. Déterminer le volume de solution titrante permettant d’atteindre l’équivalence.
4. En déduire la concentration molaire du gel détartrant en acide chlorhydrique.
5. La densité du gel détartrant est de 1,07. Le résultat de la mesure est-il en accord avec l’indication du fabricant ?
S-ar putea să vă placă și
- Adobe Illustrator CC Le Support de Cours OfficielDocument479 paginiAdobe Illustrator CC Le Support de Cours OfficielAly Bernard Ndiaye86% (7)
- QCM Energie 0Document45 paginiQCM Energie 0Youssef ArbaÎncă nu există evaluări
- Transformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 5Document5 paginiTransformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 5qwerty aertyÎncă nu există evaluări
- Ue201718 213 S3 PDFDocument120 paginiUe201718 213 S3 PDFIman FalahÎncă nu există evaluări
- Sciences Industrielles Pour L'ingennieur, Tout-En-UnDocument272 paginiSciences Industrielles Pour L'ingennieur, Tout-En-UnAyoub Marraha50% (2)
- Immunite CoursDocument14 paginiImmunite CoursJulien GhandourÎncă nu există evaluări
- Le Risque D'inondationDocument13 paginiLe Risque D'inondationcasaouis02Încă nu există evaluări
- Exercice Équilibre D'un Solide PDFDocument1 paginăExercice Équilibre D'un Solide PDFEl Youbi Mohammed100% (8)
- Sup Deco Institut Mercure Cours Compta AnalytiqueDocument57 paginiSup Deco Institut Mercure Cours Compta AnalytiqueCheikhou Dia100% (1)
- Normal 2018 PDFDocument10 paginiNormal 2018 PDFMohamed El OuahdaniÎncă nu există evaluări
- Art-Pie 1er Régiment d'Artillerie-à-Pied (Dunkerque, Calais, Boulogne)Document22 paginiArt-Pie 1er Régiment d'Artillerie-à-Pied (Dunkerque, Calais, Boulogne)DUCHAUSSOYÎncă nu există evaluări
- Devoir N°3 Type 1 S1 - 1bacDocument2 paginiDevoir N°3 Type 1 S1 - 1bacFatima MakroumiÎncă nu există evaluări
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 paginiLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadÎncă nu există evaluări
- Serie 1 TransfoDocument2 paginiSerie 1 TransfoIbtissam AttaouanziÎncă nu există evaluări
- Controle 3-1 1bac SM Semestre 1Document5 paginiControle 3-1 1bac SM Semestre 1Abdellah Ouali100% (1)
- Devoir Surveillé N°6Document4 paginiDevoir Surveillé N°6EL Ansari Jalal100% (1)
- Séries 2 Solutions ÉlectrolytiquesDocument1 paginăSéries 2 Solutions Électrolytiquessoso.saaan777Încă nu există evaluări
- Applications Suivi20.21Document3 paginiApplications Suivi20.21Phobos ElfaÎncă nu există evaluări
- Oxydoreduction Exercices Corrigés 05Document3 paginiOxydoreduction Exercices Corrigés 05Ferdannie BemsÎncă nu există evaluări
- Mesure Des Quantites de Matiere en Solution Par Conductimetrie Cours 1 1Document5 paginiMesure Des Quantites de Matiere en Solution Par Conductimetrie Cours 1 1mouna elÎncă nu există evaluări
- Devoir 4Document3 paginiDevoir 4Mohamed El OuahdaniÎncă nu există evaluări
- Test Diagnostique en Chimie 2 Bac PCDocument2 paginiTest Diagnostique en Chimie 2 Bac PCMahfoud Mohammed ELÎncă nu există evaluări
- Contrôle 28 (PR Jenkal Rachid)Document4 paginiContrôle 28 (PR Jenkal Rachid)Mouhibi AbdellahÎncă nu există evaluări
- Examen National SVT Sciences Physiques 2017 Rattrapage CorrigeDocument4 paginiExamen National SVT Sciences Physiques 2017 Rattrapage CorrigeFF CLIPSÎncă nu există evaluări
- Utiliser La Constante DDocument19 paginiUtiliser La Constante DElvis Wilfried PossiÎncă nu există evaluări
- Examen National 2016 Session Normal-SVTDocument6 paginiExamen National 2016 Session Normal-SVTMohamed El OuahdaniÎncă nu există evaluări
- Arithmétique Dans ZDocument13 paginiArithmétique Dans ZMohamed LekmadÎncă nu există evaluări
- Dipole RC Avec Latis ProDocument3 paginiDipole RC Avec Latis ProElyazghi AbdellahÎncă nu există evaluări
- Serie 1 E Et 2 E (Cinétique Chimique) PDFDocument9 paginiSerie 1 E Et 2 E (Cinétique Chimique) PDFbouaounÎncă nu există evaluări
- DS2 SM 1BAC FR Prof - Oubouhane (WWW - Pc1.ma)Document2 paginiDS2 SM 1BAC FR Prof - Oubouhane (WWW - Pc1.ma)Mr Riad-YTÎncă nu există evaluări
- Série Pile Math 1 SCDocument3 paginiSérie Pile Math 1 SCScriblouÎncă nu există evaluări
- Evaluation Cont 1S1 2bacDocument3 paginiEvaluation Cont 1S1 2bacZinebÎncă nu există evaluări
- Cours & Exercices Mesure de Quantités de Matière Par ConductimétrieDocument6 paginiCours & Exercices Mesure de Quantités de Matière Par ConductimétrieAmine AlaoUii AlaouiÎncă nu există evaluări
- Controle 2 - 3 S2 PC 1bac FRDocument2 paginiControle 2 - 3 S2 PC 1bac FRAlae AnouarÎncă nu există evaluări
- Cours - Sciences Physiques DIPOLE RL - Bac Math (2015-2016) ACADEMIE ARCHIMEDE EL MOUROUJ PDFDocument5 paginiCours - Sciences Physiques DIPOLE RL - Bac Math (2015-2016) ACADEMIE ARCHIMEDE EL MOUROUJ PDFLotfi HammamiÎncă nu există evaluări
- Contrôle 1 PR - ELANSARI SMDocument2 paginiContrôle 1 PR - ELANSARI SMHassan Dib100% (1)
- 2010 AmNord Exo1 Sujet Eau 6 5ptsDocument3 pagini2010 AmNord Exo1 Sujet Eau 6 5ptsHarakat ElhoucineÎncă nu există evaluări
- Evaluation N°1 M2 Baba El Houssine Model 2Document2 paginiEvaluation N°1 M2 Baba El Houssine Model 2gta5yassplays100% (1)
- Sa. Dev3 TS3 13-14 PDFDocument10 paginiSa. Dev3 TS3 13-14 PDFaittaliÎncă nu există evaluări
- Exo 8Document2 paginiExo 8wofabo100% (1)
- SuiviDocument3 paginiSuivihahaÎncă nu există evaluări
- Série Les Réactions Acido BasiquesDocument2 paginiSérie Les Réactions Acido BasiquesIMAD EL BYDARYÎncă nu există evaluări
- Controle 1 Sem 1 SFMDocument2 paginiControle 1 Sem 1 SFMMed AbourÎncă nu există evaluări
- Série 1 2022-2023Document2 paginiSérie 1 2022-2023Zineb Sassi100% (1)
- AaaaaDocument1 paginăAaaaaZo Zo100% (3)
- Devoir Surveillé #1 Semestre 1, 2BAC BIOF, SM, SP Et SVT, 2019-2020, PR JENKAL RACHIDDocument3 paginiDevoir Surveillé #1 Semestre 1, 2BAC BIOF, SM, SP Et SVT, 2019-2020, PR JENKAL RACHIDMoukil ÀYoùbÎncă nu există evaluări
- Chimie C Chap11 ElectrolyseDocument5 paginiChimie C Chap11 Electrolysemghaete100% (1)
- Chimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)Document7 paginiChimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)othman HassounÎncă nu există evaluări
- Devoir de Synthèse - 2-4è-Sc - Avec Correction 2023Document6 paginiDevoir de Synthèse - 2-4è-Sc - Avec Correction 2023kilaniben100% (1)
- Devoir 1 Semestre 2 SM-2022 - 2023Document2 paginiDevoir 1 Semestre 2 SM-2022 - 2023Abdellah Ouali100% (1)
- Chapitre 2 Acide BaseDocument17 paginiChapitre 2 Acide BaseSouFien MabroukÎncă nu există evaluări
- Chimie-Chapitre1-Mesures Quantite Matiere PDFDocument3 paginiChimie-Chapitre1-Mesures Quantite Matiere PDFRedouane Reda100% (1)
- Contrôle 26 (PR Khallouq) SMDocument5 paginiContrôle 26 (PR Khallouq) SMMouhibi AbdellahÎncă nu există evaluări
- BAC Physique-Chimie-Specialite 2009 SDocument11 paginiBAC Physique-Chimie-Specialite 2009 SLetudiant.fr100% (7)
- Chapitre 8, Transformations Forcées, Cours, Activités, Exercices D'applicationDocument6 paginiChapitre 8, Transformations Forcées, Cours, Activités, Exercices D'applicationasma oumo douaÎncă nu există evaluări
- Examen National Physique Chimie SPC 2013 Rattrapage SujetDocument6 paginiExamen National Physique Chimie SPC 2013 Rattrapage Sujetothmane GbÎncă nu există evaluări
- DM16 1112 - Dosage PH Metrique Es PDFDocument6 paginiDM16 1112 - Dosage PH Metrique Es PDFEmma LovaÎncă nu există evaluări
- Exercice D'application Transfo Lentes Et Rapides 2Document1 paginăExercice D'application Transfo Lentes Et Rapides 2الغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- Devoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDDocument3 paginiDevoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDHiba NajiÎncă nu există evaluări
- Les Transformations Chimiques Qui S Effectuent Dans Les 2 Sens Cours 2Document4 paginiLes Transformations Chimiques Qui S Effectuent Dans Les 2 Sens Cours 2Mohamed B'nÎncă nu există evaluări
- TD1 SMPC S2 2018 19 PDFDocument2 paginiTD1 SMPC S2 2018 19 PDFAyoub BrhmmouchÎncă nu există evaluări
- Exercice 4 Réactions Destérification Et Dhydrolyse LAHLALI PDFDocument5 paginiExercice 4 Réactions Destérification Et Dhydrolyse LAHLALI PDFBouba KhedherÎncă nu există evaluări
- Reaction Acido Basique - 022730Document2 paginiReaction Acido Basique - 022730Alaoui AmineÎncă nu există evaluări
- Devoir 1 PC 1biofDocument2 paginiDevoir 1 PC 1biofBjpvohiÎncă nu există evaluări
- CH 3 Oxydation Des MétauxDocument2 paginiCH 3 Oxydation Des MétauxAbdellah BrmÎncă nu există evaluări
- 2010 AmNord Exo1 Correction Eau 6 5ptsDocument3 pagini2010 AmNord Exo1 Correction Eau 6 5ptsla physique selon le programme FrançaisÎncă nu există evaluări
- 8 DosagesDocument3 pagini8 DosagesAnis DahnenÎncă nu există evaluări
- Ex11.Dosages Redoc 1Document9 paginiEx11.Dosages Redoc 1Chihab ÉddîneÎncă nu există evaluări
- TD 2Sc Sol BasDocument2 paginiTD 2Sc Sol BasIyed GawaÎncă nu există evaluări
- ElectromagnetismeDocument45 paginiElectromagnetismeDietethiqueÎncă nu există evaluări
- 2011 AmNord Spe Exo3 Correction Modulation 4pts PDFDocument2 pagini2011 AmNord Spe Exo3 Correction Modulation 4pts PDFYoussef ArbaÎncă nu există evaluări
- Cours - Physique - OptiqueDocument7 paginiCours - Physique - OptiqueYoussef ArbaÎncă nu există evaluări
- (Nucléaire) Radioactivité Et Réactions NucléairesDocument4 pagini(Nucléaire) Radioactivité Et Réactions NucléairesYoussef ArbaÎncă nu există evaluări
- Poincare, Henri - Cours de Physique MathematiqueDocument88 paginiPoincare, Henri - Cours de Physique MathematiqueVeio MacieiraÎncă nu există evaluări
- Particles + Effective Potential Interacting Electrons Non-Interacting, Fictitious + Real PotentialDocument22 paginiParticles + Effective Potential Interacting Electrons Non-Interacting, Fictitious + Real PotentialYoussef ArbaÎncă nu există evaluări
- See - Echecs - Techniques Et StrategieDocument51 paginiSee - Echecs - Techniques Et StrategieYoussef ArbaÎncă nu există evaluări
- 2005 AmSud Spe Correction RadioDocument2 pagini2005 AmSud Spe Correction RadioYoussef ArbaÎncă nu există evaluări
- 2005 AmSud Spe Sujet Exo1 RadioDocument2 pagini2005 AmSud Spe Sujet Exo1 RadioYoussef ArbaÎncă nu există evaluări
- Math ProbaDocument6 paginiMath ProbaYoussef ArbaÎncă nu există evaluări
- Cours de Physique Des SC - Poly - BAC+3 PDFDocument75 paginiCours de Physique Des SC - Poly - BAC+3 PDFUdei SchikhauiÎncă nu există evaluări
- MatéraiuxDocument91 paginiMatéraiuxYoussef ArbaÎncă nu există evaluări
- Projet EolienneDocument22 paginiProjet EolienneYoussef ArbaÎncă nu există evaluări
- 2011 AmNord Spe Exo3 Correction Modulation 4pts PDFDocument2 pagini2011 AmNord Spe Exo3 Correction Modulation 4pts PDFYoussef ArbaÎncă nu există evaluări
- PhysiqueDocument3 paginiPhysiqueYoussef ArbaÎncă nu există evaluări
- 2eme Licence Socle Communpolycopie Eng Et EnvDocument24 pagini2eme Licence Socle Communpolycopie Eng Et EnvYoussef ArbaÎncă nu există evaluări
- TP EolienneDocument14 paginiTP EolienneOmar CharifÎncă nu există evaluări
- Diagnostic PrerequisDocument7 paginiDiagnostic PrerequisYoussef ArbaÎncă nu există evaluări
- Questions de Physique Autour de L'énergie SolaireDocument1 paginăQuestions de Physique Autour de L'énergie SolaireYoussef ArbaÎncă nu există evaluări
- Phénomène Périodique, Période Et FréquenceDocument4 paginiPhénomène Périodique, Période Et FréquenceYoussef ArbaÎncă nu există evaluări
- Questions de Physique Autour de L'énergie Solaire PDFDocument73 paginiQuestions de Physique Autour de L'énergie Solaire PDFYoussef ArbaÎncă nu există evaluări
- Ifri Note Lenergie Photovoltaique Un Outil de Developpement Efficace Pour Les Economies Subsahariennes PDFDocument45 paginiIfri Note Lenergie Photovoltaique Un Outil de Developpement Efficace Pour Les Economies Subsahariennes PDFYoussef ArbaÎncă nu există evaluări
- Conf Energiesolaire Belrhandoria PDFDocument26 paginiConf Energiesolaire Belrhandoria PDFYoussef ArbaÎncă nu există evaluări
- Le Solaire Photovoltaique Au MarocDocument38 paginiLe Solaire Photovoltaique Au MarocIsmail toro100% (1)
- Ouerzazate ESIA Ex Sum Français Version Oct 2011 PDFDocument23 paginiOuerzazate ESIA Ex Sum Français Version Oct 2011 PDFYoussef ArbaÎncă nu există evaluări
- Les Lettres AdministrativesDocument7 paginiLes Lettres AdministrativesAyman LamzouriÎncă nu există evaluări
- 20 Pages Part 3 - Trajectoire Decarbonation Du MarocDocument20 pagini20 Pages Part 3 - Trajectoire Decarbonation Du MarocIsmail LamriniÎncă nu există evaluări
- Dossier Complet Belles Plantes Scolaires Textes Fiches PedagogiquesDocument59 paginiDossier Complet Belles Plantes Scolaires Textes Fiches Pedagogiquesjosdiakiese950Încă nu există evaluări
- Calendrier Previsionnel These 1.2Document5 paginiCalendrier Previsionnel These 1.2Wassim CharmantÎncă nu există evaluări
- 08 Cours Travail Force Energie Mecanique MelissoDocument5 pagini08 Cours Travail Force Energie Mecanique MelissoAZIAKOUÎncă nu există evaluări
- Le TANTRA Et Le Massage Tantrique.Document15 paginiLe TANTRA Et Le Massage Tantrique.Alexandra GalvezÎncă nu există evaluări
- BUDAI Erika - Les SirenesDocument9 paginiBUDAI Erika - Les SirenesHélène RichardeauÎncă nu există evaluări
- Integrer Un PDF Dans Un Site PDFDocument3 paginiIntegrer Un PDF Dans Un Site PDFlydiaberthomieuÎncă nu există evaluări
- DS1 4si2 2015-2016Document2 paginiDS1 4si2 2015-2016PROF PROFÎncă nu există evaluări
- Architecture J2 EEDocument27 paginiArchitecture J2 EEFaiçal YahiaÎncă nu există evaluări
- 11 Technique D'expression3Document17 pagini11 Technique D'expression3Imene BrbÎncă nu există evaluări
- MONS Rue de Nimy (TEC) MONS Grands Prés (TEC) : Votre Trajet en Quelques ChiffresDocument1 paginăMONS Rue de Nimy (TEC) MONS Grands Prés (TEC) : Votre Trajet en Quelques ChiffresPernelle DÎncă nu există evaluări
- Grille Bfem TroisiemeDocument5 paginiGrille Bfem Troisiemepapeefi93Încă nu există evaluări
- Passerelle Primaire Admis 2023-2024Document6 paginiPasserelle Primaire Admis 2023-2024Chaymah ChoubouÎncă nu există evaluări
- Ces Aliments Que L'on Peut Consommer Après La Date de Péremption - Santé MagazineDocument3 paginiCes Aliments Que L'on Peut Consommer Après La Date de Péremption - Santé MagazinekiamgoÎncă nu există evaluări
- Du de La Des de de L ExercisesDocument2 paginiDu de La Des de de L Exercisesapi-262811896Încă nu există evaluări
- COUR DE COMPTES TOGO AUDIT Thème 1Document42 paginiCOUR DE COMPTES TOGO AUDIT Thème 1Pascal SindieÎncă nu există evaluări
- Plan de Travail 3Document1 paginăPlan de Travail 3Fabienne GillardÎncă nu există evaluări
- E Vocabulaire GeometriqueDocument23 paginiE Vocabulaire Geometriqueadel kaisÎncă nu există evaluări
- Examen Eoae 2 Bac Eco 2012 Session Rattrapage CorrigeDocument4 paginiExamen Eoae 2 Bac Eco 2012 Session Rattrapage CorrigeAhmed Hassan SkifaÎncă nu există evaluări
- 10 29000-Rumelide 817008-1366091Document19 pagini10 29000-Rumelide 817008-1366091gnouna12Încă nu există evaluări
- Cordiérite-Mullite 1 PDFDocument10 paginiCordiérite-Mullite 1 PDFkhalidÎncă nu există evaluări
- Le Management de La Force de Vente Support 2Document73 paginiLe Management de La Force de Vente Support 2Soufiane Cherif100% (1)
- Dwnload Full Analog Circuit Design Discrete and Integrated 1st Edition Franco Solutions Manual PDFDocument36 paginiDwnload Full Analog Circuit Design Discrete and Integrated 1st Edition Franco Solutions Manual PDFlincolnrod80100% (16)