Documente Academic
Documente Profesional
Documente Cultură
C9Chim Transformations Forcees PDF
Încărcat de
AzizElheni100%(1)100% au considerat acest document util (1 vot)
132 vizualizări2 paginiTitlu original
C9Chim_transformations_forcees.pdf
Drepturi de autor
© © All Rights Reserved
Formate disponibile
PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
100%(1)100% au considerat acest document util (1 vot)
132 vizualizări2 paginiC9Chim Transformations Forcees PDF
Încărcat de
AzizElheniDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 2
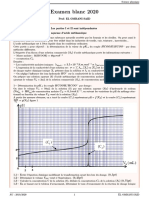
Terminale S Chimie – Partie C – Chapitre 9 : Exemples de transformations forcées – Page 1 sur 2
Chapitre 9 : Exemples de transformations forcées
1. Qu’est-ce qu’une transformation forcée ?
1.1. Évolution spontanée –0.89
Plaçons dans un tube en U, un mélange d’une solution de dibrome Br2(aq) et de sulfate
de cuivre (Cu –
aq + SOaq).
Une électrode de graphite plonge dans la solution, par l’une des ouvertures du tube en
COM mA
U. Une électrode de cuivre plonge dans la solution, par l’autre ouverture. On branche I I
un ampèremètre aux bornes des électrodes. Ce dernier indique un courant électrique électrons
circulant de l’électrode de graphite vers l’électrode de cuivre.
Le déplacement des charges positives s’effectue dans le sens du courant (cations). électrode
Le déplacement des charges négatives s’effectue dans le sens contraire du sens du de graphite
courant (anions en solutions et électrons dans les fils et les électrodes).
électrode
Le système fabriqué est une pile : de cuivre
–
– l’électrode de cuivre génère des électrons, c’est une oxydation : Cu(s) = Cu2+
(aq) + 2 e
– l’électrode de graphite est une électrode passive. À sa surface a lieu une réduction
avec le dibrome présent en solution : Br2(aq) + 2 e– = 2 Br–aq.
Le système chimique évolue spontanément jusqu’à la situation d’équilibre. L’équation cations
2+
de la réaction est : Cu(s) + Br2(aq) = Cu(aq) + 2 Br–aq (K = 1025). anions
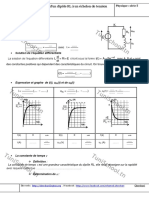
1.2. Évolution forcée
–
La réaction d’équation Cu2+ (aq) + 2 Braq = Cu(s) + Br2(aq) est la réaction inverse de la réaction spontanée mise en
évidence précédemment. Sa constante d’équilibre est donc K’ = 1/K = 10–25.
2+
Il est donc légitime de penser que la réaction entre les ions cuivre II Cu(aq) et les ions
– 21.77
bromure Braq est très limitée, puisque la constante d’équilibre est très faible.
En plaçant, dans un tube en U une solution de sulfate de cuivre et d’ions bromure, on
n’observe effectivement aucune transformation à l’échelle macroscopique. Entre une
électrode de graphite et une électrode de cuivre, un ampèremètre ne détecte aucun
courant (le système chimique ainsi constitué est l’équivalent d’une pile usée !). COM mA + G –
Plaçons un générateur entre les bornes du système chimique : on remarque qu’un I
courant circule de l’électrode de cuivre vers l’électrode de graphite : c’est un courant I I
qui circule dans le sens contraire du sens observé précédemment. électrons
Il est possible, pour certains système chimiques, d’inverser le sens d’évolution
électrode
spontanée à l’aide d’un apport d’énergie extérieur.
de graphite
Rem. : toutes les réactions chimiques ne peuvent pas être inversées par apport électrode
d’énergie électrique. de cuivre
Rem. : c’est parfois le solvant qui subit une transformation.
Les électrons sont forcés à quitter l’électrode de graphite : 2 Br–aq = Br2(aq) + 2 e–.
C’est une oxydation : cette électrode siège d’une oxydAtion est appelée Anode.
Les électrons sont forcés à rejoindre l’électrode de cuivre : Cu(aq) 2+
+ 2e– = Cu(s). anions
C’est une réduction : cette électrode siège d’une réduCtion est appelée Cathode. cations
[Braq]
Le quotient de réaction est Qr = . Dans l’état initial Qr = K : le système
2+
[Cu(aq) ].[Br–aq]2
est à l’équilibre. Au cours de la transformation la concentration en Br2(aq) augmente tandis que les concentrations en
–
Cu2+
(aq) et Braq diminue : le quotient de réaction Qr augmente : il s’éloigne de la constante d’équilibre K.
Lors d’une transformation forcée, le quotient de réaction Qr s’éloigne toujours de la constante d’équilibre K.
Évolution forcée K’ Qr K’ Évolution forcée Qr
0 Q’r,i ou 0 Q’r,i
Terminale S Chimie – Partie C – Chapitre 9 : Exemples de transformations forcées – Page 2 sur 2
2. Application à l’électrolyse
2.1. Définitions
Une électrolyse est une transformation forcée, au cours de laquelle un générateur de tension continue impose le
sens du courant électrique, et ainsi les réactions d’oxydoréduction s’effectuant aux électrodes.
L’électrode siège d’une oxydAtion est l’Anode ; l’électrode siège d’une réduCtion est la Cathode.
2.2. Bilan de matière
Lors d’une électrolyse effectuée à intensité constante, la charge (ou quantité d’électricité) passant d’une électrode à
l’autre est : Q = I.t. Cette charge correspond à N(e–) circulant, sous l’action du générateur, d’une électrode à
l’autre : Q = N(e–).e. Or N(e–) = n(e–).NA, donc Q = n(e–).NA.e. En utilisant la constante de faraday : Q = n(e–).F.
Si l’on souhaite déterminer la quantité de matière d’une espèce produite ou consommée sur l’une des électrodes, on
utilise la demi-équation électronique s’effectuant, lors de l’électrolyse, à cette électrode : on en déduit la relation
entre la quantité de matière de l’espèce chimique considérée et le nombre n(e –) d’électrons échangés.
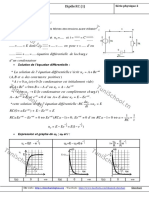
2.3. Électrolyse d’une solution aqueuse de chlorure de sodium + –
Lorsque l’on réalise l’électrolyse d’une solution aqueuse de chlorure de sodium (eau G
salée) les espèces chimiques présentes sont : Na+aq, Cl–aq et H2O(l).
I I
L’expérience montre que les ions sodium Na+aq n’interviennent pas chimiquement.
On observe un dégagement gazeux à l’anode et à la cathode. Les couples mis en jeu Anode
font intervenir les ions chlorure et l’eau : Cl2(g)/Cl–aq et H2O(l)/H2(g). Cathode
2 Cl–aq = Cl2(g) + 2e– : c’est une oxydAtion, le dichlore est produit à l’Anode. électrodes
2 H2O(l) + 2e– = H2(g) + 2 HO–aq : réduCtion, le dihydrogène est produit à la Cathode. de graphite
Le bilan de cette transformation est : 2 H2O(l) + 2 Cl–aq = H2(g) + 2 HO–aq + Cl2(g). dihydrogène
La phénolphtaléine rosit : le milieu devient basique (apparition d’ion HO–aq).
dichlore
L’indigo se décolore : c’est une preuve de l’apparition du dichlore.
Rem. : lorsqu’on ne sépare par le dichlore des ions hydroxyde HO–, on obtient de l’eau
de Javel par réaction de dismutation : Cl2(g) + 2 HO–aq = Cl–aq + ClO –aq + H2O(l) anions
cations
2.4. Principe de l’accumulateur au plomb eau de Javel
Activité documentaire page 248.
Lors de la charge de l’accumulateur : c’est une transformation forcée Un accumulateur peut être rechargé.
Lors de la décharge de l’accumulateur : c’est une transformation spontanée Une pile n’est pas rechargeable !
2.5. Purification de métaux
On utilise fréquemment l’électrolyse pour obtenir des métaux presque purs. À partir d’une solution contenant un
cation métallique, une réduCtion a lieu à la Cathode : Mn+ + n e– = M(s).
On peut également purifier un métal par électrolyse : l’anode est constituée de ce métal non pur. On impose un
courant électrique entre la cathode et l’anode. Le métal constituant l’anode se dissout dans la solution par oxydation.
On récupère à la cathode le métal quasi pur (par ex. dans le cas du cuivre utilisé dans les câbles électriques on
récupère du cuivre pur à 99,95 % !). L’essentiel des « impuretés » restant dissout dans le bain électrolytique.
2.6. Dépôt d’une couche métallique
– La galvanoplastie : on dépose par électrolyse, une fine couche métallique sur un objet dans le but d’obtenir un
moule (fabrication des CD et DVD par galvanoplastie) pour reproduire des objets. http://fr.wikipedia.org/wiki/Galvanoplastie
– La galvanostégie : on dépose par électrolyse, à la surface d’objets conducteurs, une fine couche métallique. Ce
dépôt permet d’améliorer la résistance à la corrosion (chromage ou nickelage) ou l’aspect esthétique des pièces
traitées (dorure, argenture).
3. Autre transformation forcée
D’autres domaines dans la vie, font appel à des transformations forcées. C’est le cas, par exemple, de la
photosynthèse. La source d’énergie permettant d’inverser le sens de la transformation spontanée (respiration) est le
rayonnement lumineux. La nuit, seule la transformation spontanée s’effectue. Le jour, la transformation forcée
s’ajoute à la transformation spontanée.
http://xxi.ac-reims.fr/clemenceau/PhysiqueChimie/simul_ostralo/electrolyse.swf
http://myweb.tiscali.co.uk/chemteach/swf/electrolysis2.swf
S-ar putea să vă placă și
- Electro Lys eDocument4 paginiElectro Lys eالغزيزال الحسن EL GHZIZAL HassaneÎncă nu există evaluări
- C8Chim Les Piles PDFDocument3 paginiC8Chim Les Piles PDFAzizElheniÎncă nu există evaluări
- Chapitre 11 Piles CORRIGEDocument7 paginiChapitre 11 Piles CORRIGECharles GoÎncă nu există evaluări
- Série Transformation Forcée CorrectionDocument8 paginiSérie Transformation Forcée CorrectionAmine AlaoUii AlaouiÎncă nu există evaluări
- Site TS C 09 L'ElectrolyseDocument4 paginiSite TS C 09 L'ElectrolysePecorellaÎncă nu există evaluări
- Exercices de Physique Nucléaire et de la MatièreDe la EverandExercices de Physique Nucléaire et de la MatièreÎncă nu există evaluări
- Chapitre 7, Transformations Spontanées Dans Les Piles Et Récupération de L'énergie, Activités, Exercices D'application, 2BAC BIOF, PR JENKAL RACHIDDocument3 paginiChapitre 7, Transformations Spontanées Dans Les Piles Et Récupération de L'énergie, Activités, Exercices D'application, 2BAC BIOF, PR JENKAL RACHIDaristide mabialaÎncă nu există evaluări
- Activité Chapitre 4 Chimie Facteurs Cinétiques Et de LDocument3 paginiActivité Chapitre 4 Chimie Facteurs Cinétiques Et de LMalia TATEÎncă nu există evaluări
- TP Cinetique ChimiqueDocument1 paginăTP Cinetique ChimiqueAyoub GuerriÎncă nu există evaluări
- Chapitre C3 ConductimetrieDocument5 paginiChapitre C3 ConductimetrieLahcen Ben SalmÎncă nu există evaluări
- Acides Carbox CoursDocument11 paginiAcides Carbox CoursOuedraogo HarounaÎncă nu există evaluări
- S12 (PH Des Solutions AqueusesDocument5 paginiS12 (PH Des Solutions AqueusesLotfi BoucharebÎncă nu există evaluări
- Cours Dosage Acide Base 3Document8 paginiCours Dosage Acide Base 3Boussetta ZouhaierÎncă nu există evaluări
- 1 - Cinétique ProfDocument16 pagini1 - Cinétique Profyahya chbaniÎncă nu există evaluări
- C1Chim Transformations Lentes Rapides Exercices PDFDocument6 paginiC1Chim Transformations Lentes Rapides Exercices PDFAzizElheniÎncă nu există evaluări
- Titrage Avec Suivi ColorimetriqueDocument3 paginiTitrage Avec Suivi Colorimetriquemohammed younes100% (1)
- Fiche Defibac Reaction D EsterificationDocument2 paginiFiche Defibac Reaction D Esterificationali100% (1)
- Cours Dynamique Des StructuresDocument2 paginiCours Dynamique Des StructuresAbderrahim Boulanouar100% (1)
- 4 DS3 2009 2010Document4 pagini4 DS3 2009 2010Fethi Ferchiou100% (2)
- Série D'exercices Conductance Et ConductivitéDocument2 paginiSérie D'exercices Conductance Et Conductivitéammoura youssefÎncă nu există evaluări
- Sciences Physiques - Cinetique Chimique-Gazzah MahmoudDocument3 paginiSciences Physiques - Cinetique Chimique-Gazzah MahmoudMahmoud GazzahÎncă nu există evaluări
- TP E4 PileDocument2 paginiTP E4 PileSam Fairire100% (1)
- Devoir de Contrôle N°1 - Physique - Bac Math (2010-2011) MR RaoufDocument5 paginiDevoir de Contrôle N°1 - Physique - Bac Math (2010-2011) MR Raoufahmed tounsiÎncă nu există evaluări
- Vitesse 2Document5 paginiVitesse 2lemiaÎncă nu există evaluări
- Contrôle 2Document3 paginiContrôle 2Mery EmÎncă nu există evaluări
- ElectrolyteDocument4 paginiElectrolytemhaouekÎncă nu există evaluări
- C11Chim Controle Evolution PDFDocument3 paginiC11Chim Controle Evolution PDFAzizElheniÎncă nu există evaluări
- 4 Exercice Suivi D'une Transformation ChimiqueDocument2 pagini4 Exercice Suivi D'une Transformation Chimiquenabil echerrarÎncă nu există evaluări
- Auto Ind PDFDocument5 paginiAuto Ind PDFبن نصر محمد100% (1)
- Devoir de Synthèse N°1 1er Semestre - Sciences Physiques - Bac Sciences Exp (2018-2019) MR Foued Bahlous PDFDocument7 paginiDevoir de Synthèse N°1 1er Semestre - Sciences Physiques - Bac Sciences Exp (2018-2019) MR Foued Bahlous PDFMohamed SaidiÎncă nu există evaluări
- TP .Avancement .4sc - Exp.2022Document6 paginiTP .Avancement .4sc - Exp.2022Med Brini100% (1)
- Exem PCDocument6 paginiExem PCwfwgÎncă nu există evaluări
- Acide Base PDFDocument16 paginiAcide Base PDFchahin07Încă nu există evaluări
- Série 1 2022-2023Document2 paginiSérie 1 2022-2023Zineb Sassi100% (1)
- Serie 1 TransfoDocument2 paginiSerie 1 TransfoIbtissam AttaouanziÎncă nu există evaluări
- Séri N°12Document5 paginiSéri N°12Jihad ELÎncă nu există evaluări
- Revision Circuit RLC Libre Amorti Et LC Libre Non AmortiDocument8 paginiRevision Circuit RLC Libre Amorti Et LC Libre Non Amortiben zayed aliÎncă nu există evaluări
- Transformations Liees A Des Reactions Acide Base Cours 3 2Document4 paginiTransformations Liees A Des Reactions Acide Base Cours 3 2assad saisÎncă nu există evaluări
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2015-2016) MR Maalej Med HabibDocument6 paginiDevoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2015-2016) MR Maalej Med HabibMustapha ElhafiÎncă nu există evaluări
- S6 Chapitre 4 Energie ChimiqueDocument16 paginiS6 Chapitre 4 Energie ChimiqueMed Raslene AlouiÎncă nu există evaluări
- Controle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2Document8 paginiControle de L Evolution D Un Systeme Chimique Exercices Non Corriges 2stefan0% (1)
- Chapitre 2 PH Des Solutions Acides BasesDocument26 paginiChapitre 2 PH Des Solutions Acides BasesRottina RossyÎncă nu există evaluări
- Energie Interne Et Calorimètre Exercices FR 16Document2 paginiEnergie Interne Et Calorimètre Exercices FR 16Yassir Rochd100% (1)
- Exercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumDocument9 paginiExercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumAli A RammalÎncă nu există evaluări
- Chimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)Document7 paginiChimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)othman HassounÎncă nu există evaluări
- Correction Serie N1 Analytique 1Document6 paginiCorrection Serie N1 Analytique 1Hk Eh100% (1)
- Serie 7 ChimieDocument6 paginiSerie 7 ChimieJabri ImeneÎncă nu există evaluări
- Passage Der AcideDocument3 paginiPassage Der AcideBelgasem Assel100% (1)
- Exercice Corrigée Detrmination de LDocument3 paginiExercice Corrigée Detrmination de LBoussetta ZouhaierÎncă nu există evaluări
- TPCorrCeFe 4Document2 paginiTPCorrCeFe 4Amelie Pinchon100% (1)
- Transformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Document3 paginiTransformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Ibtihel BoughanmiÎncă nu există evaluări
- TPC4Document2 paginiTPC4hhedfiÎncă nu există evaluări
- 8 Dipole RLDocument6 pagini8 Dipole RLKawtar kawtarÎncă nu există evaluări
- $RFCGXUMDocument2 pagini$RFCGXUMChikov ÆmineÎncă nu există evaluări
- TP 3 Acide Base PDFDocument8 paginiTP 3 Acide Base PDFadsvgnmÎncă nu există evaluări
- Devoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2010-2011) MR Benaich PDFDocument4 paginiDevoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2010-2011) MR Benaich PDFolfa essefiÎncă nu există evaluări
- 14 Ondes ProgressivesDocument6 pagini14 Ondes ProgressiveslemiaÎncă nu există evaluări
- 17 SpectreDocument8 pagini17 SpectrelemiaÎncă nu există evaluări
- 18 Reaction Nucleaire PDFDocument10 pagini18 Reaction Nucleaire PDFAzizElheniÎncă nu există evaluări
- 11-Oscill Mec Libres PDFDocument9 pagini11-Oscill Mec Libres PDFAzizElheniÎncă nu există evaluări
- 10-rlc Force ScExp PDFDocument4 pagini10-rlc Force ScExp PDFAzizElheniÎncă nu există evaluări
- 13b Mec Forcees ScExp PDFDocument5 pagini13b Mec Forcees ScExp PDFAzizElheniÎncă nu există evaluări
- 2016 Sadiki PDFDocument5 pagini2016 Sadiki PDFAzizElheniÎncă nu există evaluări
- 11-Oscill Mec Libres PDFDocument9 pagini11-Oscill Mec Libres PDFAzizElheniÎncă nu există evaluări
- 15 Interaction Onde PDFDocument7 pagini15 Interaction Onde PDFAzizElheniÎncă nu există evaluări
- 13 Mec Forcees PDFDocument5 pagini13 Mec Forcees PDFAzizElheniÎncă nu există evaluări
- 11-Oscill Mec Libres PDFDocument9 pagini11-Oscill Mec Libres PDFAzizElheniÎncă nu există evaluări
- 11-Oscill Mec Libres PDFDocument9 pagini11-Oscill Mec Libres PDFAzizElheniÎncă nu există evaluări
- 3 RC PDFDocument4 pagini3 RC PDFAzizElheniÎncă nu există evaluări
- 7 LC PDFDocument6 pagini7 LC PDFAzizElheniÎncă nu există evaluări
- 9-rlc Force PDFDocument7 pagini9-rlc Force PDFAzizElheni100% (1)
- S6 Chapitre 6 Cinetique Chimique PDFDocument12 paginiS6 Chapitre 6 Cinetique Chimique PDFAzizElheni100% (1)
- 10-rlc Force PDFDocument5 pagini10-rlc Force PDFAzizElheniÎncă nu există evaluări
- 8 LC PDFDocument3 pagini8 LC PDFAzizElheniÎncă nu există evaluări
- Os Chimie Corrige ch7 PDFDocument38 paginiOs Chimie Corrige ch7 PDFAzizElheniÎncă nu există evaluări
- 4 Ind MagnDocument4 pagini4 Ind MagnBoussetta ZouhaierÎncă nu există evaluări
- 1 Condensateur PDFDocument3 pagini1 Condensateur PDFAzizElheni100% (1)
- 4 RL PDFDocument8 pagini4 RL PDFAzizElheniÎncă nu există evaluări
- 2 RC PDFDocument7 pagini2 RC PDFAzizElheniÎncă nu există evaluări
- Re Capitulatif Avancement PDFDocument4 paginiRe Capitulatif Avancement PDFAzizElheniÎncă nu există evaluări
- 5 RL PDFDocument3 pagini5 RL PDFAzizElheni100% (1)
- C14Phy Ouverture Quantique PDFDocument3 paginiC14Phy Ouverture Quantique PDFAzizElheniÎncă nu există evaluări
- 0 Introduction Exerc PDFDocument3 pagini0 Introduction Exerc PDFAzizElheniÎncă nu există evaluări
- C13Phy Aspects Energetiques PDFDocument4 paginiC13Phy Aspects Energetiques PDFAzizElheniÎncă nu există evaluări
- Resume Equilibre Chimique S 1 PDFDocument4 paginiResume Equilibre Chimique S 1 PDFAzizElheniÎncă nu există evaluări
- C12Phy - Systemes - Oscillants - Pendule - Exos - Galilee PDFDocument4 paginiC12Phy - Systemes - Oscillants - Pendule - Exos - Galilee PDFAzizElheniÎncă nu există evaluări
- TD 1 T ThérmiqueDocument44 paginiTD 1 T ThérmiqueSà Mo50% (2)
- Cat Devant Une Conduite SuicidaireDocument28 paginiCat Devant Une Conduite SuicidaireGhislain AssogbaÎncă nu există evaluări
- L HommeDocument16 paginiL HommeMarina MagninÎncă nu există evaluări
- TD 6 Ry Gimes Transitoires Des Systy Mes Du Premier OrdreDocument8 paginiTD 6 Ry Gimes Transitoires Des Systy Mes Du Premier Ordrelbog.trashÎncă nu există evaluări
- Ahmed Messaoudi Ds2 Maths 2023Document3 paginiAhmed Messaoudi Ds2 Maths 2023messaoudiahmedÎncă nu există evaluări
- Stockage Du Pétrole Et Du GazDocument10 paginiStockage Du Pétrole Et Du Gazhalimatououattara100% (1)
- NarratologieDocument7 paginiNarratologieBileonetÎncă nu există evaluări
- Cours Thermique Bâtiment - SougaDocument41 paginiCours Thermique Bâtiment - SougaCsouga93% (14)
- Le Développement Professionnel Des Enseignants DébutantsDocument13 paginiLe Développement Professionnel Des Enseignants DébutantsAndré FonsecaÎncă nu există evaluări
- Economie Appliquee Et Statistique PDFDocument37 paginiEconomie Appliquee Et Statistique PDFMarco PoloÎncă nu există evaluări
- Mémoire de Fin D'étudesDocument27 paginiMémoire de Fin D'étudesAs ScofÎncă nu există evaluări
- ChaffoteauxDocument24 paginiChaffoteauxchaimaa bouazizÎncă nu există evaluări
- CollectionDocument32 paginiCollectionyv4hnÎncă nu există evaluări
- Catalogue Interrupteurs de Position Gamme XC StandardDocument161 paginiCatalogue Interrupteurs de Position Gamme XC StandardLandecki LoïcÎncă nu există evaluări
- Exemple de Poster2Document1 paginăExemple de Poster2Hamza BenineÎncă nu există evaluări
- Cours Logique - Partie 2Document4 paginiCours Logique - Partie 2SBA Nabil ZakariaÎncă nu există evaluări
- Chap1 Guide MicroDocument16 paginiChap1 Guide Microouafae jowharÎncă nu există evaluări
- Paie PersonnelDocument2 paginiPaie PersonnelOumayma GharieniÎncă nu există evaluări
- Sciencespo Brochure Generale Scpo FRDocument32 paginiSciencespo Brochure Generale Scpo FRSergeÎncă nu există evaluări
- Stratégie Diagnostique Devant Une Surdité de L'adulte: Rappel Succinct D'anatomie FonctionnelleDocument13 paginiStratégie Diagnostique Devant Une Surdité de L'adulte: Rappel Succinct D'anatomie FonctionnelleMoncef PechaÎncă nu există evaluări
- Huit - La Philosophie de La NatureDocument593 paginiHuit - La Philosophie de La NatureMarco PogacnikÎncă nu există evaluări
- t1c2 Complexite Du Systeme ClimatiqueDocument9 paginit1c2 Complexite Du Systeme Climatiquehadj brahimÎncă nu există evaluări
- Dictee 3emeDocument2 paginiDictee 3emeYamina YahiaouiÎncă nu există evaluări
- Examen BlancDocument3 paginiExamen Blancanass zidiÎncă nu există evaluări
- Comment Créer Une Liste Déroulante RestreinteDocument5 paginiComment Créer Une Liste Déroulante RestreinteTeeKa16Încă nu există evaluări
- Receuil Technique Isoone FR 17Document69 paginiReceuil Technique Isoone FR 17Anonymous FZs3yBHh7Încă nu există evaluări
- Fonction Caracteristique PDFDocument1 paginăFonction Caracteristique PDFCircomstasia HouÎncă nu există evaluări
- Mon Premier Achat ImmobilierDocument66 paginiMon Premier Achat Immobilierhamzazouine68Încă nu există evaluări
- Une Annee de MAPLE en MPSIDocument50 paginiUne Annee de MAPLE en MPSIamelie.gogeÎncă nu există evaluări
- SheqDocument1 paginăSheqAnouar Alaa-Eddine BenaïdaÎncă nu există evaluări