Documente Academic
Documente Profesional
Documente Cultură
3er Examen 2017
Încărcat de
Emmanuel RodríguezTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
3er Examen 2017
Încărcat de
Emmanuel RodríguezDrepturi de autor:
Formate disponibile
INSTITUTO POLITÉCNICO NACIONAL
ESCUELA SUPERIOR DE INGENIERÍA QUÍMICA E INDUSTRIAS EXTRACTIVAS
DEPARTAMENTO DE INGENIERÍA QUÍMICA INDUSTRIAL
MATERIA TERMODINÁMICA DEL EQUILIBRIO QUÍMICO TERCER EXAMEN
ALUMNO 31 de mayo de 2017
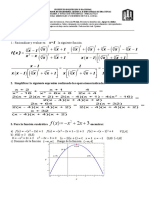
Problema 1. A 320 ºC y 1 atm se tiene el valor de los ΔGf R para el sistema reaccionante: (3 puntos)
CH 4 ( g)+ H 2 O(g)❑ CO ( g)+3 H 2 (g) ΔGf R = 1162.8206 cal/mol
⇔
CH 4 (g)+2 H 2 O( g)❑ CO 2 (g)+ 4 H 2 ( g) ΔGf R = -1479.9481 cal/mol
⇔
Calcular la composición en el sistema reaccionante cuando se alimentan 50 Kg/h de reactivos en una relación
equimolar. Considere comportamiento de gas ideal.
Problema 2. En un recipiente que está adaptado para que se lleve a cabo la producción de Fe en polvo mediante
una mezcla de 25% mol de carbono y el resto de óxido ferroso bien molidos, se hacen reaccionar a una presión
de 1 atm: (2 puntos)
C ( s ) + FeO ( s)↔ Fe ( s )+ CO( g) (1)
C ( s ) +2 FeO(s) ↔2 Fe ( s ) +CO 2( g) (2)
La energía libre, en función de la temperatura, en cal/mol, está dada por la ecuación:
ΔGR0]T1=36500 – 36.4T ΔGR0]T2=32200 – 31.1T T=K
¿A qué temperatura ejerce la mezcla en equilibrio a una presión 1 atm?
¿Cuál es la composición de los gases en el equilibrio?
Problema 3. En una industria química que produce amoníaco se efectúa la siguiente reacción: (4 puntos)
NH 2 CO2 NH 4 ( s ) ❑ 2 NH 3 ( g ) +CO2 (g)
⇔
Dicha reacción se desarrolla en una reactor experimental de 10.5 litros, que opera isotérmicamente a 79 ºC y en
donde se colocaron 57.8 g de carbamato de amonio.
6132.03
Se encontró que la presión total en el equilibrio es: lnP=25.12− , T =K , P=mmHg
T
Determinar:
a) gramos de CO2 producidos cuando se alcanza el equilibrio. (1 punto)
b) gramos de carbamato de amonio, una vez alcanzado el equilibrio. (0.5 puntos)
c) Cuál debe ser la presión a la que debe operar el reactor para que en el equilibrio se obtenga el doble de la
concentración de amoníaco (1 punto)
d) Cuál es la temperatura a la que debe operar el reactor para que en el equilibrio se obtenga el doble de la
concentración de amoníaco. (1 punto)
Problema 4. El acetaldehído se produce a partir de etanol mediante las siguientes reacciones en fase gas a 540
ºC y 1 atm de presión. Las reacciones se llevan a cabo con un catalizador impregnado de plata y aire como
oxidante. (1 punto)
C2H5OH + 0.5O2 ❑ ⇔ CH3CHO + H2O
C2H5OH ❑ ⇔ CH3CHO + H2
Demostrar que el sistema también puede ser interpretado por el siguiente par de ecuaciones:
C2H5OH ❑ ⇔ CH3CHO + H2
❑
H2 + 0.5O2 ⇔ H2O
S-ar putea să vă placă și
- Teq EsiqieDocument6 paginiTeq EsiqieEmmanuel RodríguezÎncă nu există evaluări
- Calendario Ipn Modalidad Escolarizada 2020-2021Document1 paginăCalendario Ipn Modalidad Escolarizada 2020-2021Laura Islas100% (1)
- Preinforme e Informe Practica #8Document21 paginiPreinforme e Informe Practica #8Dahiana MarcelaÎncă nu există evaluări
- Ejercicios Tomassi Capitulo 8 ResueltolDocument2 paginiEjercicios Tomassi Capitulo 8 ResueltolJohnVillegas40% (5)
- LEM VI - Previo I Equilibrio QuimicoDocument3 paginiLEM VI - Previo I Equilibrio QuimicoEmmanuel Ramirez RecillasÎncă nu există evaluări
- ETS Precálculo ESIQIEDocument4 paginiETS Precálculo ESIQIEEmmanuel Rodríguez100% (2)
- Planeación Didáctica Principios de A.C.Document4 paginiPlaneación Didáctica Principios de A.C.Emmanuel RodríguezÎncă nu există evaluări
- Tarea Matemáticas1 - TextoDocument1 paginăTarea Matemáticas1 - TextoEmmanuel RodríguezÎncă nu există evaluări
- TAREA 4 - EsauRodriguezDocument2 paginiTAREA 4 - EsauRodriguezEmmanuel RodríguezÎncă nu există evaluări
- Tarea 3Document2 paginiTarea 3Emmanuel RodríguezÎncă nu există evaluări
- Tarea 4Document1 paginăTarea 4Emmanuel RodríguezÎncă nu există evaluări
- Primer Examen Parcial Del Curso de Apoyo de Matematicas 2021-ADocument1 paginăPrimer Examen Parcial Del Curso de Apoyo de Matematicas 2021-AEmmanuel RodríguezÎncă nu există evaluări
- Tarea 2Document2 paginiTarea 2Emmanuel RodríguezÎncă nu există evaluări
- Tarea 1Document2 paginiTarea 1Emmanuel RodríguezÎncă nu există evaluări
- Clase 2Document10 paginiClase 2Emmanuel RodríguezÎncă nu există evaluări
- Clase 4Document5 paginiClase 4Emmanuel RodríguezÎncă nu există evaluări
- 2019 Diciembre ETS PrecálculoDocument12 pagini2019 Diciembre ETS PrecálculoEmmanuel RodríguezÎncă nu există evaluări
- Formulario AMESIQIE (2019) PDFDocument45 paginiFormulario AMESIQIE (2019) PDFAlex DillenÎncă nu există evaluări
- Tarea 3. CálculoDocument5 paginiTarea 3. CálculoEmmanuel RodríguezÎncă nu există evaluări
- 2019 Junio ETS PrecálculoDocument10 pagini2019 Junio ETS PrecálculoEmmanuel RodríguezÎncă nu există evaluări
- PC 11092019 MatutinoDocument7 paginiPC 11092019 MatutinoEmmanuel RodríguezÎncă nu există evaluări
- Lista de Reactivos SSPSDocument1 paginăLista de Reactivos SSPSEmmanuel RodríguezÎncă nu există evaluări
- FormularioTermodinamicaEquilibrioQuimicoDocument1 paginăFormularioTermodinamicaEquilibrioQuimicoEmmanuel RodríguezÎncă nu există evaluări
- 2016 MatVesp BDocument4 pagini2016 MatVesp BEmmanuel RodríguezÎncă nu există evaluări
- Reversible 28 ResueltoDocument2 paginiReversible 28 ResueltoEmmanuel RodríguezÎncă nu există evaluări
- 2016 MatVesp ADocument4 pagini2016 MatVesp AEmmanuel RodríguezÎncă nu există evaluări
- Plan de Estudios UAMDocument20 paginiPlan de Estudios UAMEmmanuel RodríguezÎncă nu există evaluări
- Programa RMN CinvestavDocument1 paginăPrograma RMN CinvestavEmmanuel RodríguezÎncă nu există evaluări
- Termodinámica del equilibrio químico - Problemas de reacciones químicasDocument1 paginăTermodinámica del equilibrio químico - Problemas de reacciones químicasEmmanuel RodríguezÎncă nu există evaluări
- 1er 2017 Optativa4 SoluciónDocument6 pagini1er 2017 Optativa4 SoluciónEmmanuel RodríguezÎncă nu există evaluări
- 3er Examen Optativa4 2017Document2 pagini3er Examen Optativa4 2017Emmanuel RodríguezÎncă nu există evaluări
- Cuestionario Fisica para Decimo de BasicaDocument2 paginiCuestionario Fisica para Decimo de BasicaAlfonso ProañoÎncă nu există evaluări
- Labo Fisica Informe 02Document19 paginiLabo Fisica Informe 02José Villegas MejíaÎncă nu există evaluări
- Sistemas 3F Balanceados y DesbalanceadosDocument50 paginiSistemas 3F Balanceados y DesbalanceadosMiluj RodriguezÎncă nu există evaluări
- Respuestas7B PDFDocument4 paginiRespuestas7B PDFRenato DonosoÎncă nu există evaluări
- 2do Parcial Lab FísicaDocument11 pagini2do Parcial Lab FísicaYirmy HerreraÎncă nu există evaluări
- Ayudantia Certamen 2 Electronica de PotenciaDocument25 paginiAyudantia Certamen 2 Electronica de PotenciaCamilo FonsecaÎncă nu există evaluări
- PasswordDocument1 paginăPasswordeslovaniaÎncă nu există evaluări
- Calculo VP, VS, SCPTu y SDMT.Document43 paginiCalculo VP, VS, SCPTu y SDMT.Jhon Grajales100% (1)
- Taller Gases Ideales Termo 2Document16 paginiTaller Gases Ideales Termo 2Ivăn ÔspiinoÎncă nu există evaluări
- LA RADIACTIVIDAD - Presentación Del LibroDocument2 paginiLA RADIACTIVIDAD - Presentación Del LibroAPCNEANÎncă nu există evaluări
- Ley de Gay Lusacc Informe IIDocument37 paginiLey de Gay Lusacc Informe IIlabrigaana40% (5)
- Termodinámica y Medicina: Conceptos Básicos para EstudiantesDocument17 paginiTermodinámica y Medicina: Conceptos Básicos para EstudiantesJocker GreickÎncă nu există evaluări
- Centrales hidroeléctricas de EdegelDocument38 paginiCentrales hidroeléctricas de EdegelLesly Anyeline FernandezÎncă nu există evaluări
- Actividad Evaluativa 1 Fisica MecanicaDocument6 paginiActividad Evaluativa 1 Fisica Mecanicacarlos alberto espinal bedoyaÎncă nu există evaluări
- Amorrrrr de Mi VidaaaaaaaDocument6 paginiAmorrrrr de Mi VidaaaaaaaAngie DiazÎncă nu există evaluări
- Separata de EstáticaDocument8 paginiSeparata de EstáticaEduardo MelgarejoÎncă nu există evaluări
- Díaz Cuadro Act3Document2 paginiDíaz Cuadro Act3Mistergun 005Încă nu există evaluări
- Lab 1 Tensiones Fase LineaDocument12 paginiLab 1 Tensiones Fase LineaYoan Alexander Rueda SanmiguelÎncă nu există evaluări
- Movimiento rectilíneo uniforme y caída libreDocument13 paginiMovimiento rectilíneo uniforme y caída libreEdgardo PeñaÎncă nu există evaluări
- Interferencia y Difracción de La LuzDocument8 paginiInterferencia y Difracción de La LuzMarielaÎncă nu există evaluări
- Deformaciones en VigasDocument4 paginiDeformaciones en VigasMaRicruz CornejoÎncă nu există evaluări
- A0RQ - Ejercicios de AplicacionDocument6 paginiA0RQ - Ejercicios de AplicacionMIGUEL ANGEL ROLDAN MARTINÎncă nu există evaluări
- Cap11movimiento OscilatoriorDocument23 paginiCap11movimiento OscilatoriorLeandro Javier RomeroÎncă nu există evaluări
- Clase 6 - Conoscopia de MineralesDocument30 paginiClase 6 - Conoscopia de MineralesDavid Atencio PalominoÎncă nu există evaluări
- Sistema Electrico Por UnidadDocument17 paginiSistema Electrico Por UnidadFABIANÎncă nu există evaluări
- Quimica Cristalina (1) Tema 7.1Document33 paginiQuimica Cristalina (1) Tema 7.1Luis Miguel Mogollon RamosÎncă nu există evaluări