Documente Academic
Documente Profesional
Documente Cultură
Indice de Spaonificaion
Încărcat de
Shina Ruiz Supho0 evaluări0% au considerat acest document util (0 voturi)
40 vizualizări4 paginiindice de saponificacion
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentindice de saponificacion
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
40 vizualizări4 paginiIndice de Spaonificaion
Încărcat de
Shina Ruiz Suphoindice de saponificacion
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 4
Funadmeny: Se define como los miligramos de KOH necesarios para saponificar 1 g de grasa,
reacción en la que intervienen triglicéridos, diglicéridos, monoglicéridos, ácidos grasos libres y
cualquier otro lípido saponificable. Es equivalente a la masa en mg de KOH necesaria para
neutralizar los ácidos grasos libres y los ácidos grasos liberados de los glicéridos, luego de su
saponificación.
Índice de saponificacion
Puede deducirse que a mayor IS, mayor concentración de ácidos grasos de bajo peso
molecular (IS es mayor para una grasa dada, en la medida que aumenta el número de
funciones éster saponificables/ g de la misma). Algunos valores orientativos de este índice son:
Grasas: de 160 a 250 (manteca: 230)
Aceites vegetales: alrededor de 190 (coco y palma: 260)
Análisis y Control de los Alimentos / Guillermo D. Manrique/ UNIVERSIDAD NACIONAL DEL
CENTRO
DE LA PROVINCIA DE BUENOS AIRES
http://www.fio.unicen.edu.ar/usuario/gmanrique/images/Grasas_y_Aceites.pdf
INDICE DE SAPONIFICACION · IMPORTANCIA: La saponificación es el proceso por el cual, un
aceite o una grasa se transforma en jabón, a partir de una reacción química con una solución
alcalina, habitualmente, de hidróxido de sodio. Pero ¿qué es el índice de saponificación? ¿cuál
es el índice de saponificación de cada grasa o aceite en particular? Encuentra la respuesta a
estos interrogantes en la tabla de saponificación de los aceites y grasas para fabricar jabones.
El índice de saponificación es la cantidad en miligramos de un alcali, específicamente de
hidróxido de potasio, que se necesita para saponificar un gramo de determinado aceite o
grasa. Sin embargo, habitualmente en la fabricación de jabones, el alcali que se utiliza es el
hidróxido de sodio. Por otra parte, este índice de saponificación varía para cada grasa o aceite
en particular. Para conocer estas cantidades habría que realizar complejos cálculos, que se
simplifican con las tablas de saponificación existentes. Estas tablas de saponificación, registran
cual es el índice de saponificación adecuado, es decir la cantidad en miligramos de hidróxido
de sodio, que necesitas para saponificar cada grasa o aceite, con la que vayas a fabricar
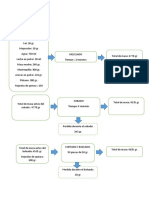
jabones. PROCEDIMIENTO: A: Aceite de Olivo refinado. B: Prueba en blanco. pesar la muestra
añadir 25 ml de disolución alcohólica de kOH 0.5 n aprox, se adapta el condensador de g}flujo y
se introduce el matraz en agua hirviendo durante 30 minutos agitando frecuentemente
durante el calentamiento al cabo de este tiempo se añade 2-3 gotas de indicador de
fenolftaleína al 1% anotar el gasto · RESULTADOS Y DISCUSIÓN: I.S = (B-A)*N*28.05 W I.S =
(34.3-10.5)*0.5*28.05 3 A: Aceite de Olivo refinado.111.26 Peso de la muestra: 3gr.
Gasto:10.5ml B: Prueba en blanco. Peso de la muestra: 3gr Gasto: 33.5ml · CONCLUSIONES: 1.-
Por medio de los procedimientos se determinó los índice de saponificación. · INTERROGANTES:
¿CUÀL ES ES LA IMPORTANCIA DE LA DETERMINACIÒN DEL ÍNDICE DE SAPONIFICACIÓN E
INSAPONIFICACION? El índice de saponificación denota el peso de hidróxido potásico en mg
que se requieren para saponificar un gramo del aceite o grasa. El aceite se saponifica
calentándolo con un exceso de álcali cáustico alcohólico. La cantidad de álcali consumida se
calcula valorando por retroceso con ácido clorhídrico. El índice de saponificación es
inversamente proporcional a la medida de los pesos moleculares de los ácidos grasos de los
glicéridos presentes en el aceite o grasa. Como muchos aceites dan índices similares, el índice
de saponificación es menos valioso que el índice de yodo cuando se trata de identificar un
aceite desconocido. Notables excepciones son los altos índices del aceite de coco y el aceite de
almendra de palma (ambos utilizados en la margarina) y de la grasa de mantequilla. (Pearson,
1993) La materia insaponificable consta de aquellas sustancias contenidas en los aceites
comerciales y grasas (diferentes a las de bajo p. de ebullición a los ácidos libres y a la materia
mineral) que, después de saponificar y extraer con éter dietílico, quedan sin volatilizarse luego
de secar a 80°C. Incluyen hidrocarburos y alcoholes de alto peso molecular. L/a mayoría de los
aceites y grasas contienen una pequeña parte de materia insaponificable (normalmente menos
del 2 %). COMENTARIO: Entonces el índice de saponificación es la cantidad en miligramos de
un álcali, específicamente de hidróxido de potasio, que se necesita para saponificar un gramo
de determinado aceite o grasa. Pero, actualmente en la fabricación de jabones se utiliza es el
hidróxido de sodio. Por otra parte, este índice de saponificación varía para cada grasa o aceite
en particular. Para conocer estas cantidades habría que realizar complejos cálculos, por ello se
realizó tablas de índice de saponificación de cada muestra de aceites y grasas. BIBLIOGRAFÍA: ·
Fessenden Ralf j., Fessenden Joan. S, Organic Marshall W. Logue. An International Thomson
Publishing.Company, 1998. PREGUNTA 2: ¿DESCRIBA LA REACCIÓN QUÍMICA QUE SE PRODUCE
EN LA DETERMINACIÓN DEL ÍNDICE DE SAPONIFICACIÓN? La saponificación es una reacción
química entre un ácido graso (o un lípido saponificable, portador de residuos de ácidos grasos)
y una base o alcalino, en la que se obtiene como principal producto la sal de dicho ácido y de
dicha base. Estos compuestos tienen la particularidad de ser anfipáticos, es decir tienen una
parte polar y otra apolar (o no polar), con lo cual pueden interactuar con sustancias de
propiedades dispares. Por ejemplo, los jabones son sales de ácidos grasos y metales alcalinos
que se obtienen mediante este proceso. Antes que nada habría que dirimir entre un lípido
saponificable y uno insaponificable a pesar que los enlaces son muy similares existe una
diferencia entre los enlaces covalentes de sus elementos. El método de saponificación en el
aspecto industrial consiste en hervir la grasa en grandes calderas, añadiendo lentamente sosa
cáustica (NaOH), agitándose continuamente la mezcla hasta que comienza esta a ponerse
pastosa. La reacción que tiene lugar es la saponificación y los productos son el jabón y la
glicerina: GRASA + SOSA CÁUSTICA → JABÓN + GLICERINA Ecuación general de saponificación
de un triglicérido. Los aceites se saponifican originando mezclas de sales de ácidos grasos
insaturados y la glicerina. En la antigüedad cuando no se conocía la sosa (NaOH), se utilizaba
cenizas de madera las cuales contienen potasio en forma de carbonatos (K2CO3), y estas sales
proporcionaban el medio alcalino para producir la reacción de saponificación. Para completar
esta reacción, en ocasiones se adicionan sales para favorecer la precipitación del jabón y el
glicerol se recupera mediante destilación. El glicerol es utilizado en la industria cosmética, para
disminuir la humedad del tabaco y en la industria farmacéutica. COMENTARIO: Un lípido
saponificable sería todo aquel que esté compuesto por un alcohol unido a uno o varios ácidos
grasos (iguales o distintos). Esta unión se realiza mediante un enlace éster, muy difícil de
hidrolizar. Pero puede romperse fácilmente si el lípido se encuentra en un medio básico. En
este caso se produce la saponificación alcalina. En los casos en los que para la obtención del
jabón se utiliza un glicérido o grasa neutra, se obtiene como subproducto el alcohol llamado
glicerina, que puede dar mayor beneficio económico que el producto principal. BIBLIOGRAFÍA:
· Mc. Murry John. Organuc chemistry JTP. An International Thomson PubliskingCompary 1984.
· Solomons, G.”Química Orgánica” University of South Florida 1997. PREGUNTA 3: ¿EXPLIQUE
EL FUNDAMENTO QUIMICO Y EL TIPIO DE REACCION DEL ANALISI REALIZADO EN LA PRACTICA
COMENTARIO: BIBLIOGRAFÍA: PREGUNTA 5: HAGA UNA TABLA INDICANDOLOS DIVERSOS
INDICES DE SAPONIFICACION DE LOS ACEITE Y GRASA PREGUNTA 6: ¿DESCRIBA EL PROCESO
DE OTROS MÉTODOS DE LA DETERMINACIÓN DEL ÍNDICE DE SAPONIFICACIÓN? INDICE DE
SAPONIFICACION (Método potencio métrico) 1. Principio.-Se denomina índice de
saponificación el peso en mg de hidróxido potásico necesario para saponificar 1 g de materia
grasa. La determinación se realiza saponificando la muestra con una disolución previamente
valorada de hidróxido potásico, determinando por volumetría el exceso de hidróxido potásico,
utilizando indicador potenciométrico. Este método debe aplicarse cuando la coloración intensa
de la solución o turbidez dificulten la apreciación del viraje del indicador coloreado. 2. Material
y aparatos.- 2.1. Equipo de valoración potenciométrica equipado con electrodos de
vidrio/calomelano o wolframio/calomelano. 2.2. Agitador magnético. 2.3. Bureta de 25 ml.
Dividida en décimas de ml. 2.4. Pipeta aforada de 25 ml. 2.5. Matraz aforado de 1.000 ml. 2.6.
Probeta graduada de 50 ml. 2.7. Matraces redondos de 100 ml. Provistos de tubo de reflujo, de
un metro de longitud, con ajuste normalizado 14/23. 2.8. Vasos de precipitado de 150 ml.
Forma alta. 3. Reactivos.- 3.1. Isopropanol. 3.2. Etilenglicol. Indice de refracción a 20 °C:
1,4274-1,4292. 3.3. Acido clorhídrico d = 1,18. 3.4. Hidróxido potásico. 3.5. Tris-(hidroxi-metil)-
aminometano (CH2OH)3ONH4 de calidad utilizada para la preparación de soluciones patrón,
peso equivalente 121,14. 3.6. Disolución 0,5 N de hidróxido potásico en isopropanol. Pesar 35
g de hidróxido potásico, en lentejas, e introducir en un matraz aforado de 1 litro. Adicionar
alcohol isopropílico, agitar con agitador magnético hasta conseguir la disolución completa y
enrasar. 3.7. Disolución 0,5 N de ácido clorhídrico en isopropanol. Medir con probeta 42 ml de
ácido clorhídrico y verterlos en un matraz aforado de 1.000 ml, completando el volumen hasta
el enrase con isopropanol. Para valorar esta disolución pesar, en vidrio de reloj y con precisión
de 0,2 mg, aproximadamente, 1,2 g de tris-(hidroxi-metil)- aminometano, pasándolo a un vaso
de 150 ml, forma alta. Disolver en 20 ml de isopropanol, adicionándose 20 ml de etanodiol,
efectuándose seguidamente la valoración con la disolución clorhídrica, según se describe en
.4.2. La valoración también se puede realizar utilizando indicador coloreado, adicionándose
para ello 2 gotas de disolución azul de timol al 1% en isopropanol, acusándose el punto de
equivalencia por un viraje brusco del amarillo al rosa. Sean P los gramos de THMAM pesados y
V los mililitros de ácido clorhídrico consumidos en la valoración: N = P / 0,12114 * V 4.
Procedimiento.- 4.1. Preparación de la muestra.-La muestra deberá estar seca y libre de
materias extrañas en suspensión. En caso contrario, antes de proceder a la pesada, deberá
decantarse el agua, si hubiese lugar a ello, y, en todo caso, filtrar por papel de filtro,
efectuándose esta operación a una temperatura ligeramente superior a la del punto de fusión
de la grasa. Las grasas que contengan ácidos grasos volátiles no podrán calentarse, debido al
riesgo de volatilización de ácidos libres. En estos casos, se procederá a la determinación de la
acidez directamente, refiriéndose a muestra seca y exenta de impurezas insolubles, basándose
en las determinaciones realizadas sobre muestras independientes. 4.2. Determinación.-Pesar
en un matraz redondo de 100 ml, aproximadamente, 2 g de la muestra. Adicionar
seguidamente con pipeta 25 ml de la disolución 0,5 N de 11 (b).3.6. Ajustar el tubo de reflujo y
calentar hasta ebullición, manteniéndola durante media hora o más si fuera necesario hasta
conseguir la saponificación completa. Retirar el matraz y dejar enfriar. Antes de que se enfríe
completamente trasvasar el contenido a un vaso de precipitado de 150 m, lavando el matraz
con 30 ml de etilenglicol adicionado en porciones sucesivas. Completar el lavado con 5 ml de
isopropanol. Paralelamente se realiza una prueba en blanco con 25 ml de la disolución de
hidróxido potásico 0,5 N. Al terminar el período de ebullición enfriar y trasvasar a un vaso de
150 ml como anteriormente. A continuación introducir los electrodos y proceder a la
valoración con la disolución de ácido clorhídrico. 1. Cálculos.- Calcular el índice de
saponificación aplicando la siguiente fórmula: Is = (Vo - V) * N * 56,1/P Siendo: Vo = volumen,
en ml, consumidos en la valoración en blanco. V = volumen, en ml, consumidos en el ensayo
con la muestra de materia grasa. N = normalidad de la disolución de ácido clorhídrico. P =
peso, en g, de la muestra. 2. Observaciones.- Cuando se utilicen electrodos simples la unión
entre la disolución saturada de cloruro potásico y la disolución de medida se hará a través de
una espiga de porcelana porosa de unos 3 cm de longitud o por cualquier otro sistema que
impida una difusión apreciable entre ambas disoluciones durante el tiempo que dure la
valoración. BIBLIOGRAFÍA: · Instituto de Racionalización y Normalización del Trabajo. Una
Norma Española 55.064.© Editorial Aranzadi
S-ar putea să vă placă și
- Evaluación Diagnostica Del Área de Educación para El TrabajoDocument2 paginiEvaluación Diagnostica Del Área de Educación para El TrabajoMarxsilva Asto87% (47)
- Tarea Semana 03 PlanificacionDocument5 paginiTarea Semana 03 PlanificacionArmando Gutierrez100% (1)
- Leche y Productos LacteosDocument55 paginiLeche y Productos LacteosShina Ruiz SuphoÎncă nu există evaluări
- Metodos de RefrigeracionDocument3 paginiMetodos de RefrigeracionShina Ruiz SuphoÎncă nu există evaluări
- Gelatinizacion Del Almidon PDFDocument2 paginiGelatinizacion Del Almidon PDFShina Ruiz SuphoÎncă nu există evaluări
- Elaboracion de VinoDocument2 paginiElaboracion de VinoShina Ruiz SuphoÎncă nu există evaluări
- Secado de Frutas y HortalizasDocument1 paginăSecado de Frutas y HortalizasShina Ruiz SuphoÎncă nu există evaluări
- Piña y PectinaDocument4 paginiPiña y PectinaShina Ruiz SuphoÎncă nu există evaluări
- Queso AndinoDocument6 paginiQueso AndinoShina Ruiz SuphoÎncă nu există evaluări
- Gelatinizacion Del AlmidonDocument8 paginiGelatinizacion Del AlmidonShina Ruiz SuphoÎncă nu există evaluări
- BEBIDAS ALCOHOLICAS Ec - Nte.0338.1992Document13 paginiBEBIDAS ALCOHOLICAS Ec - Nte.0338.1992Shina Ruiz SuphoÎncă nu există evaluări
- Aumento de Familias ReconstruidasDocument1 paginăAumento de Familias ReconstruidasShina Ruiz SuphoÎncă nu există evaluări
- Balance de Masa Pan de PlatanoDocument2 paginiBalance de Masa Pan de PlatanoShina Ruiz SuphoÎncă nu există evaluări
- RefractometriaDocument4 paginiRefractometriaShina Ruiz SuphoÎncă nu există evaluări
- Indice de SpaonificaionDocument4 paginiIndice de SpaonificaionShina Ruiz SuphoÎncă nu există evaluări
- Balance de YogurtDocument1 paginăBalance de YogurtShina Ruiz SuphoÎncă nu există evaluări
- Escherichia ColiDocument10 paginiEscherichia ColiShina Ruiz SuphoÎncă nu există evaluări
- Norma de PanaderiasDocument5 paginiNorma de PanaderiasKimberly CardenasÎncă nu există evaluări
- TitulacióndeacidosDocument6 paginiTitulacióndeacidosShina Ruiz SuphoÎncă nu există evaluări
- Escherichia ColiDocument1 paginăEscherichia ColiShina Ruiz SuphoÎncă nu există evaluări
- Cepas VínicasDocument6 paginiCepas Vínicasjulio h.oÎncă nu există evaluări
- Refrigeración y CongelaciónDocument9 paginiRefrigeración y CongelaciónShina Ruiz SuphoÎncă nu există evaluări
- RadioDocument6 paginiRadioShina Ruiz SuphoÎncă nu există evaluări
- LechugaDocument6 paginiLechugaShina Ruiz SuphoÎncă nu există evaluări
- Refrigeración y CongelaciónDocument9 paginiRefrigeración y CongelaciónShina Ruiz SuphoÎncă nu există evaluări
- Refrigeración y CongelaciónDocument9 paginiRefrigeración y CongelaciónShina Ruiz SuphoÎncă nu există evaluări
- PRACTICA TermocompresorDocument5 paginiPRACTICA TermocompresorShina Ruiz SuphoÎncă nu există evaluări
- Bombas CentrifugasDocument12 paginiBombas CentrifugasShina Ruiz SuphoÎncă nu există evaluări
- Ciencia y Tecnología de CarnesDocument5 paginiCiencia y Tecnología de CarnesShina Ruiz Supho0% (1)
- PRÁCTICAS HIGIENICAS DEL RECURSO HUMANO, PCC, HACCP Segundo IntentoDocument6 paginiPRÁCTICAS HIGIENICAS DEL RECURSO HUMANO, PCC, HACCP Segundo IntentoLuz Mary AlmarioÎncă nu există evaluări
- EconomiaDocument5 paginiEconomiaswever666100% (1)
- Ponencia SanfeDocument17 paginiPonencia SanfePamelita BalcazarÎncă nu există evaluări
- Memoria I Foro Desarrollo de Software IngInfDocument126 paginiMemoria I Foro Desarrollo de Software IngInfRubén Darío Rivera MejíaÎncă nu există evaluări
- Resident Evil DS - Chris RedfieldDocument36 paginiResident Evil DS - Chris RedfieldrenicitoÎncă nu există evaluări
- Catalogo Isothermal V3 2016-08-Correo PDFDocument37 paginiCatalogo Isothermal V3 2016-08-Correo PDFCJODÎncă nu există evaluări
- Est-A X13Document2 paginiEst-A X13César GutiérrezÎncă nu există evaluări
- Eb70-Mc-10.245 - A Manual Campaña Ing. Ce y de BrasilDocument99 paginiEb70-Mc-10.245 - A Manual Campaña Ing. Ce y de BrasiljorgedbpeÎncă nu există evaluări
- Informe Mensual de ObraDocument103 paginiInforme Mensual de ObraSantillanChristianÎncă nu există evaluări
- Protocolo 01 - EnchapesDocument2 paginiProtocolo 01 - EnchapesEstanly QuintanaÎncă nu există evaluări
- Catálogo Digital - Suplidora Industrial 6 SigmaDocument7 paginiCatálogo Digital - Suplidora Industrial 6 SigmaSuplidora Industrial 6 SigmaÎncă nu există evaluări
- Mannual de Seguridad Empresa Argentina METALURGICADocument104 paginiMannual de Seguridad Empresa Argentina METALURGICAagustin2003Încă nu există evaluări
- 11 - Factores Críticos de Éxito en Los Proyectos de SoftwareDocument12 pagini11 - Factores Críticos de Éxito en Los Proyectos de SoftwareGabriel Silva EspinozaÎncă nu există evaluări
- Modulos EstandaresDocument31 paginiModulos EstandaresDayana MedinaÎncă nu există evaluări
- Unidad 5 - Actividad 2Document5 paginiUnidad 5 - Actividad 2Oscar MuñozÎncă nu există evaluări
- Analisis de Precio Unitarios CementerioDocument4 paginiAnalisis de Precio Unitarios CementerioLesly Thalia Cieza NuñezÎncă nu există evaluări
- Whirpool Cadena de SuministroDocument4 paginiWhirpool Cadena de SuministroStevenFranStevenÎncă nu există evaluări
- La Biomasa en La Industria PDFDocument44 paginiLa Biomasa en La Industria PDFPrincess PrincessÎncă nu există evaluări
- Prueba de Conocimientos en El Area de PresupuestosDocument7 paginiPrueba de Conocimientos en El Area de PresupuestosJuan Camilo MontenegroÎncă nu există evaluări
- Eett - Intervenciones BnupDocument15 paginiEett - Intervenciones Bnuppablo121Încă nu există evaluări
- Analisis de FallasDocument13 paginiAnalisis de FallasFRANMYRÎncă nu există evaluări
- Ajuste - de - Pernos-Laboratorio EDITABLEDocument5 paginiAjuste - de - Pernos-Laboratorio EDITABLEJair Anthony MuchicaÎncă nu există evaluări
- Informe FinalDocument38 paginiInforme Finaldiana GutierrezÎncă nu există evaluări
- Procter & Gamble SigDocument30 paginiProcter & Gamble SigLaisha Lobredish IovstokÎncă nu există evaluări
- Actividad 2 Administracion Financiera Cuadro ComparativoDocument2 paginiActividad 2 Administracion Financiera Cuadro ComparativoAntonio FernandezÎncă nu există evaluări
- FO-SST-41 Inspeccion de MotosierraDocument1 paginăFO-SST-41 Inspeccion de Motosierrayania moncadaÎncă nu există evaluări
- Presentacion - Proyecto de Vida2012Document180 paginiPresentacion - Proyecto de Vida2012Conejos Solorzano100% (1)
- ACTIVIDAD 5 ProcesosDocument6 paginiACTIVIDAD 5 ProcesosAlejandro AlonsoÎncă nu există evaluări