Documente Academic
Documente Profesional
Documente Cultură
Yermo Dinamica
Încărcat de
Rcristian DherreraDescriere originală:
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Yermo Dinamica
Încărcat de
Rcristian DherreraDrepturi de autor:
Formate disponibile
ermodinámica
Ir a la navegaciónIr a la búsqueda
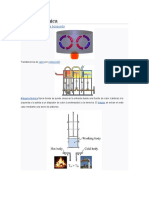
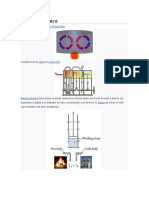
Máquina térmica típica donde puede observarse la entrada desde una fuente de calor (caldera) a
la izquierda y la salida a un disipador de calor (condensador) a la derecha. El trabajo se extrae en
este caso mediante una serie de pistones.
La termodinámica es la rama de la física que describe los estados de equilibrio termodinámico a
nivel macroscópico. El Diccionario de la lengua española de la Real Academia, por su parte, define
la termodinámica como la rama de la física encargada del estudio de la interacción entre el calor y
otras manifestaciones de la energía.1 Constituye una teoría fenomenológica, a partir de
razonamientos deductivos, que estudia sistemas reales, sin modelizar y sigue un método
experimental.2 Los estados de equilibrio se estudian y definen por medio de magnitudes
extensivas tales como la energía interna, la entropía, el volumen o la composición molar del
sistema,3 o por medio de magnitudes no-extensivas derivadas de las anteriores como la
temperatura, presión y el potencial químico; otras magnitudes, tales como la imanación, la fuerza
electromotriz y las asociadas con la mecánica de los medios continuos en general también pueden
tratarse por medio de la termodinámica.4
La termodinámica ofrece un aparato formal aplicable únicamente a estados de equilibrio,5
definidos como aquel estado hacia «el que todo sistema tiende a evolucionar y caracterizado
porque en el mismo todas las propiedades del sistema quedan determinadas por factores
intrínsecos y no por influencias externas previamente aplicadas».3 Tales estados terminales de
equilibrio son, por definición, independientes del tiempo, y todo el aparato formal de la
termodinámica –todas las leyes y variables termodinámicas– se definen de tal modo que podría
decirse que un sistema está en equilibrio si sus propiedades pueden describirse consistentemente
empleando la teoría termodinámica.3 Los estados de equilibrio son necesariamente coherentes
con los contornos del sistema y las restricciones a las que esté sometido. Por medio de los cambios
producidos en estas restricciones (esto es, al retirar limitaciones tales como impedir la expansión
del volumen del sistema, impedir el flujo de calor, etc.), el sistema tenderá a evolucionar de un
estado de equilibrio a otro;6 comparando ambos estados de equilibrio, la termodinámica permite
estudiar los procesos de intercambio de masa y energía térmica entre sistemas térmicos
diferentes.
Como ciencia fenomenológica, la termodinámica no se ocupa de ofrecer una interpretación física
de sus magnitudes. La primera de ellas, la energía interna, se acepta como una manifestación
macroscópica de las leyes de conservación de la energía a nivel microscópico, que permite
caracterizar el estado energético del sistema macroscópico.7 El punto de partida para la mayor
parte de las consideraciones termodinámicas son los que postulan que la energía puede ser
intercambiada entre sistemas en forma de calor o trabajo, y que solo puede hacerse de una
determinada manera. También se introduce una magnitud llamada entropía,8 que se define como
aquella función extensiva de la energía interna, el volumen y la composición molar que toma
valores máximos en equilibrio: el principio de maximización de la entropía define el sentido en el
que el sistema evoluciona de un estado de equilibrio a otro.9 Es la mecánica estadística,
íntimamente relacionada con la termodinámica, la que ofrece una interpretación física de ambas
magnitudes: la energía interna se identifica con la suma de las energías individuales de los átomos
y moléculas del sistema, y la entropía mide el grado de orden y el estado dinámico de los sistemas,
y tiene una conexión muy fuerte con la teoría de información.10 En la termodinámica se estudian
y clasifican las interacciones entre diversos sistemas, lo que lleva a definir conceptos como sistema
termodinámico y su contorno. Un sistema termodinámico se caracteriza por sus propiedades,
relacionadas entre sí mediante las ecuaciones de estado. Estas se pueden combinar para expresar
la energía interna y los potenciales termodinámicos, útiles para determinar las condiciones de
equilibrio entre sistemas y los procesos espontáneos.
Con estas herramientas, la termodinámica describe cómo los sistemas reaccionan a los cambios en
su entorno. Esto se puede aplicar a una amplia variedad de ramas de la ciencia y de la ingeniería,
tales como motores, cambios de fase, reacciones químicas, fenómenos de transporte, e incluso
agujeros negros.
Índice
1 Historia de la termodinámica
2 Principios de la termodinámica
2.1 Principio cero de la termodinámica
2.2 Primer principio de la termodinámica
2.3 Segundo principio de la termodinámica
2.3.1 Enunciado de Clausius
2.3.2 Enunciado de Kelvin—Planck
2.3.3 Otra interpretación
2.4 Tercer principio de la termodinámica
2.5 Sistema
2.6 Medio externo
3 Equilibrio térmico
3.1 Variables termodinámicas
3.2 Estado de un sistema
3.3 Equilibrio térmico
3.4 Foco térmico
3.5 Contacto térmico
4 Procesos termodinámicos
5 Rendimiento termodinámico o eficiencia
5.1 Teorema de Carnot
6 Diagramas termodinámicos
7 Véase también
8 Referencias
8.1 Notas
8.2 Bibliografía
9 Enlaces externos
S-ar putea să vă placă și
- Casos de Judd y CarolineDocument5 paginiCasos de Judd y CarolineLorena Esquivel75% (4)
- Las Leyes de La Termodinamica InformeDocument7 paginiLas Leyes de La Termodinamica InformeAndy Infantes Valenzuela100% (2)
- Respaldo de Termodinamica Parte 6 - 7Document49 paginiRespaldo de Termodinamica Parte 6 - 7Jose Lezano MartinezÎncă nu există evaluări
- Introduccion A TermodinamicaDocument5 paginiIntroduccion A TermodinamicaCarlos Claros RiveraÎncă nu există evaluări
- TermodinámicaDocument3 paginiTermodinámicaRolando MichelÎncă nu există evaluări
- TermodinámicaDocument3 paginiTermodinámicaDoris Beatriz TlapalamatlÎncă nu există evaluări
- Term Odin Á MicaDocument48 paginiTerm Odin Á MicaJose HuapayaÎncă nu există evaluări
- Termodinamica IntroduccionDocument2 paginiTermodinamica IntroduccionMIGUEL ANGEL PERALES VERGARAÎncă nu există evaluări
- Diccionario de La Lengua EspañolaDocument2 paginiDiccionario de La Lengua EspañolaSvetoPetrović100% (1)
- TermodinámicaDocument19 paginiTermodinámicaJoseph López PasmiñoÎncă nu există evaluări
- Termodinámica - Wikipedia, La Enciclopedia LibreDocument19 paginiTermodinámica - Wikipedia, La Enciclopedia LibrealgarabrielaÎncă nu există evaluări
- Term Odin A MicaDocument3 paginiTerm Odin A MicaCésar PCÎncă nu există evaluări
- Reporte de Las Leyes de La TermodinámicaDocument47 paginiReporte de Las Leyes de La TermodinámicaSophiÎncă nu există evaluări
- TermodinamicaDocument14 paginiTermodinamicaRuben G. Quispe UsnayoÎncă nu există evaluări
- Evolucion HumanaDocument764 paginiEvolucion HumanaLobaton Flores JamilÎncă nu există evaluări
- Termo DinamicaDocument4 paginiTermo Dinamicavicuru12Încă nu există evaluări
- TERMODINAMICADocument17 paginiTERMODINAMICAHéctor VillanuevaÎncă nu există evaluări
- TermodinámicaDocument5 paginiTermodinámicaReyes EsmeraldaÎncă nu există evaluări
- TermodDocument18 paginiTermodPetra Banda RamirezÎncă nu există evaluări
- TERMODINAMICADocument27 paginiTERMODINAMICASamuel Gonzalez Naranjo -Încă nu există evaluări
- Termodinamica en FisicaDocument19 paginiTermodinamica en FisicaJhimy AruquipaÎncă nu există evaluări
- TermodinámicaDocument18 paginiTermodinámicaMily DanielaÎncă nu există evaluări
- TermodinamicaDocument3 paginiTermodinamicaPaolo Guarniz TufinioÎncă nu există evaluări
- Leyes Fundamentales de La TermodinámicaDocument12 paginiLeyes Fundamentales de La TermodinámicaAriel Flores OrtuñoÎncă nu există evaluări
- TermoDocument15 paginiTermoMauricio MarÎncă nu există evaluări
- Termodinamica WordDocument17 paginiTermodinamica WordDayana CastroÎncă nu există evaluări
- Revolucion de 1944Document26 paginiRevolucion de 1944Eber BerdúoÎncă nu există evaluări
- Aplicasiones de La TermodinamicaDocument4 paginiAplicasiones de La TermodinamicaMisael GómezÎncă nu există evaluări
- Tarea 2 Investigación de Temas (IT)Document15 paginiTarea 2 Investigación de Temas (IT)Mauricio MarÎncă nu există evaluări
- Jenny Pinto Grupo 24Document14 paginiJenny Pinto Grupo 24FERENGIFOÎncă nu există evaluări
- Ensayo de TermodinamicaDocument7 paginiEnsayo de TermodinamicaMilagros MabelÎncă nu există evaluări
- Trabajo Final TermodinamicaDocument18 paginiTrabajo Final TermodinamicaLazaro GutierrezÎncă nu există evaluări
- Practica Fuera de AulaDocument11 paginiPractica Fuera de AulaMoises CanaviriÎncă nu există evaluări
- Termodinamica MartinDocument10 paginiTermodinamica MartinMartin Arellano GonzalezÎncă nu există evaluări
- Definiciones TermodinamicasDocument16 paginiDefiniciones TermodinamicasEdwin Gatica100% (1)
- 4 - TermodinámicaDocument13 pagini4 - TermodinámicaJulio C. Velasco XoloÎncă nu există evaluări
- FisicofarmaciaDocument2 paginiFisicofarmaciaMelissa VenturaÎncă nu există evaluări
- Term Odin A MicaDocument6 paginiTerm Odin A MicaErick Estuardo González PérezÎncă nu există evaluări
- Maquinas TermicasDocument27 paginiMaquinas TermicasLeslie Shakira Huanca OblitasÎncă nu există evaluări
- 1er PrincipioDocument26 pagini1er PrincipioMartín RodriguezÎncă nu există evaluări
- Ley CeroDocument37 paginiLey CeroAnonymous faRVVGNÎncă nu există evaluări
- Universidad Tecnológica de Bahía de BanderasDocument19 paginiUniversidad Tecnológica de Bahía de BanderasJUNIOR DEMETRIO ALVAREZ HERNANDEZÎncă nu există evaluări
- Tema 16Document21 paginiTema 16Anonymous H4DjwdyÎncă nu există evaluări
- Tarea 1 Termo ArticuloDocument14 paginiTarea 1 Termo ArticulokateÎncă nu există evaluări
- TermodinámicaDocument33 paginiTermodinámicaEmmaÎncă nu există evaluări
- Termodinamica PresenDocument9 paginiTermodinamica PresenRodrigo De JesusÎncă nu există evaluări
- TermodinámicaDocument24 paginiTermodinámicaRene Deza AroniÎncă nu există evaluări
- Proyecto Cálculo VectorialDocument3 paginiProyecto Cálculo VectorialDaniel LopezÎncă nu există evaluări
- Unidad 1 Termodinamica 2024Document13 paginiUnidad 1 Termodinamica 2024Edith Melisa SerranoÎncă nu există evaluări
- TermodinámicaDocument16 paginiTermodinámicaDiego ValenzuelaÎncă nu există evaluări
- Ley CeroDocument10 paginiLey CeroPieroÎncă nu există evaluări
- Energia y La Primera LeyDocument30 paginiEnergia y La Primera LeyANGELES HUANCAÎncă nu există evaluări
- 1º Ley de La TermodinamicaDocument24 pagini1º Ley de La TermodinamicaMarko Cardenas AlcantaraÎncă nu există evaluări
- Ecuaciones Fundamentales de La TermodinamicaDocument5 paginiEcuaciones Fundamentales de La TermodinamicaDANIEL GUARDADO RUIZÎncă nu există evaluări
- TermodinámicaDocument12 paginiTermodinámicaDeryn Quispe MendozaÎncă nu există evaluări
- Tema I Conceptos Basicos.Document19 paginiTema I Conceptos Basicos.Xavier J. LópezÎncă nu există evaluări
- TERMODINÁMICADocument16 paginiTERMODINÁMICAMariana Michel Castro HerediaÎncă nu există evaluări
- TERMODINÁMICADocument30 paginiTERMODINÁMICAEvaÎncă nu există evaluări
- Investigacion TermodinamicaDocument7 paginiInvestigacion TermodinamicaGeraldine RojoÎncă nu există evaluări
- TermodinDocument13 paginiTermodinalejandroÎncă nu există evaluări
- Qué Es La Fuerza de GravedadDocument2 paginiQué Es La Fuerza de GravedadRcristian DherreraÎncă nu există evaluări
- Oncepto de AgroindustriaDocument7 paginiOncepto de AgroindustriaRcristian DherreraÎncă nu există evaluări
- Para Nadie Es Un Secreto Que La Sociedad Ha Experimentado Grandes CambiosDocument1 paginăPara Nadie Es Un Secreto Que La Sociedad Ha Experimentado Grandes CambiosRcristian DherreraÎncă nu există evaluări
- Objetivos Dibujo TécnicoDocument2 paginiObjetivos Dibujo TécnicoRcristian DherreraÎncă nu există evaluări
- EstDocument9 paginiEstRcristian DherreraÎncă nu există evaluări
- CAUEDocument8 paginiCAUERcristian DherreraÎncă nu există evaluări
- El Método de La Ruta Crítica Es Uno de Los Conceptos Más Importantes en La Gestión de Proyectos Sin EmbargoDocument15 paginiEl Método de La Ruta Crítica Es Uno de Los Conceptos Más Importantes en La Gestión de Proyectos Sin EmbargoRcristian DherreraÎncă nu există evaluări
- La Creación de Bienes y Servicios Requiere Transformar Los Recursos en Bienes y ServiciosDocument3 paginiLa Creación de Bienes y Servicios Requiere Transformar Los Recursos en Bienes y ServiciosRcristian DherreraÎncă nu există evaluări
- Comentario PersonalDocument1 paginăComentario PersonalRcristian DherreraÎncă nu există evaluări
- Formatos Personalizados y Formato CondicionalDocument7 paginiFormatos Personalizados y Formato CondicionalRcristian DherreraÎncă nu există evaluări
- Formado MecánicoDocument3 paginiFormado MecánicoRcristian DherreraÎncă nu există evaluări
- Carta N°54 2022 Observaciones Val. Superv. 03 - PurupambaDocument1 paginăCarta N°54 2022 Observaciones Val. Superv. 03 - PurupambaMirian Torres PoloÎncă nu există evaluări
- Sesion de Aprendizaje #13Document4 paginiSesion de Aprendizaje #13SoledadÎncă nu există evaluări
- UO - 01 Construcción de Poza de AceiteDocument6 paginiUO - 01 Construcción de Poza de Aceitejavier Mansilla GarayarÎncă nu există evaluări
- El Principe Ceniciento MejoradoDocument29 paginiEl Principe Ceniciento MejoradoAnii Euu AguilaÎncă nu există evaluări
- Plan de Trabajo Investidura Guias NayoresDocument6 paginiPlan de Trabajo Investidura Guias NayoresConexión 1másÎncă nu există evaluări
- Los Coacervados de OparinDocument2 paginiLos Coacervados de OparinRamzenyGonzalezÎncă nu există evaluări
- Radiografia ExtrabucalDocument31 paginiRadiografia Extrabucalemmanuel.magdalenoÎncă nu există evaluări
- El MaizDocument2 paginiEl MaizedgarbbÎncă nu există evaluări
- Servicios Regulares de Transporte MaritimoDocument49 paginiServicios Regulares de Transporte Maritimoandres5588Încă nu există evaluări
- Feriados 2021Document3 paginiFeriados 2021Cadena 3 ArgentinaÎncă nu există evaluări
- La Piramide - SarmientoDocument4 paginiLa Piramide - SarmientosdfsfsÎncă nu există evaluări
- Formulariodemanda - de - Pension 2016 PDFDocument4 paginiFormulariodemanda - de - Pension 2016 PDFAnonymous xf8W6LÎncă nu există evaluări
- 45 Frases de Grandes Hombres Que Machacaron Cruelmente La Imagen de La MujerDocument4 pagini45 Frases de Grandes Hombres Que Machacaron Cruelmente La Imagen de La MujerPedro Cañizares CuadraÎncă nu există evaluări
- Postítulo de Mención en Necesidades Educativas EspecialesDocument22 paginiPostítulo de Mención en Necesidades Educativas EspecialesanaÎncă nu există evaluări
- Guia de Heridas UNAB. FinalDocument41 paginiGuia de Heridas UNAB. FinalAntonia FuentealbaÎncă nu există evaluări
- El Paraguas de WittgensteinDocument3 paginiEl Paraguas de WittgensteinEl-Egan Lamors100% (1)
- Derecho Procesal Consttiucional UDADocument207 paginiDerecho Procesal Consttiucional UDALorena BuenoÎncă nu există evaluări
- Resumen de AcuérdateDocument3 paginiResumen de AcuérdateJossi Neyra50% (2)
- Autorización A Persona Juridica para Vender Vehículo en ConsignaciónDocument2 paginiAutorización A Persona Juridica para Vender Vehículo en ConsignaciónGerardo AmosÎncă nu există evaluări
- Sitema Decimal MetricoDocument5 paginiSitema Decimal MetricotottyÎncă nu există evaluări
- Ordenanza MunicipalDocument6 paginiOrdenanza MunicipalElianaEstelaBejaranoÎncă nu există evaluări
- 1 Componentes Del Paradigma de La SimplicidadDocument3 pagini1 Componentes Del Paradigma de La SimplicidadTorres Ed67% (3)
- Producción de HidrocarburosDocument227 paginiProducción de Hidrocarburosjulian aruquipaÎncă nu există evaluări
- Herpes Zoster y Medicina AlternativaDocument7 paginiHerpes Zoster y Medicina AlternativaHM1468078100% (1)
- POLIGONOS Presentación de Mate FINALDocument25 paginiPOLIGONOS Presentación de Mate FINALElizabeth RiosÎncă nu există evaluări
- Glosario Gaete M.J & Parra, F.Document18 paginiGlosario Gaete M.J & Parra, F.Florencia ParraÎncă nu există evaluări
- Tecnicas de Identificacion de ResiduosDocument5 paginiTecnicas de Identificacion de ResiduosMonserrath SalazarÎncă nu există evaluări
- Mapa Conceptual Buho de MinervaDocument1 paginăMapa Conceptual Buho de MinervaCaro Soto100% (1)
- Fenómenos Naturales - OkDocument20 paginiFenómenos Naturales - OkLucia Catita Tarqui CajanÎncă nu există evaluări