Documente Academic
Documente Profesional
Documente Cultură
Examen 1 de Reactores
Încărcat de
J Frank Qch0 evaluări0% au considerat acest document util (0 voturi)
15 vizualizări2 paginiTitlu original
examen 1 de reactores.docx
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
15 vizualizări2 paginiExamen 1 de Reactores
Încărcat de
J Frank QchDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 2
1.
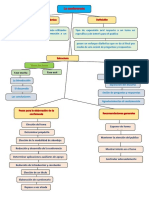
Equilibrio químico TEMPERATURA
Balance de proporcionalidad que se da cuando la capacidad de formación de un
Entalpía
producto es equivalente a la capacidad de regeneración del reactivo
2. Que es un proceso químico
Un proceso químico es un conjunto de operaciones químicas ordenadas para la
transformación de unos materiales iniciales en otros productos finales. Calor de reacción Se libera o absorbe energia
* si aumenta la temperatura aumenta la velocidad de reacción
*la entalpia cambia en función de la temperatura
3. Que es operaciones unitarias PRESION: se demuestra q
Es cada una de las acciones necesarias (de transporte, adecuación y transformación) que
modifica una cantidad de materia en un proceso químico.
4. Defina estequiometria si se trata de gases ideales se puede
Es la ley de conservación del número de átomos durante la reacción Ejemplo: La
combustión del gas natural (metano) puede ser escrita como:
CH4 + 2O2 CO2 + 2H20
integrando nos queda
Los coeficientes estequeométricos pueden ser multiplicados por cualquier constante y el
balance de átomos permanecerá.
5. Defina reacciones químicas
La reacción química es la operación unitaria que tiene por objeto distribuir de forma *la calor de reacción permanece constante al variar la presión
distinta los átomos de unas moléculas (aumentar o disminuir átomos) para formar otras *la presión influye a la velocidad de reacción
nuevas (productos). *la presión no influye a la calor de reacción
6. Un cuerpo está absolutamente definido, cuando está especificado 10. Explique la variación de la constante de equilibrio (IK) con la temperatura
a. cantidad de materia y composición.
b. energía total (interna, eléctrica, magnética, potencial, cinética).
la entalpía es función de la temperatura
c. las componentes de velocidad de que está animado.
7. Principales funciones de los reactores
- Asegurar el tipo de contacto o modo de fluir de los reactantes en el interior del Cuando la entalpía es constante, la expresión anterior
aparato, para conseguir la mezcla deseada de las fases presentes.
- Proporcionar el tiempo suficiente de contacto entre las sustancias y con el catalizador,
en su caso, para conseguir la extensión deseada de la reacción. queda de la forma:
- Permitir condiciones de presión, temperatura y composición de modo que la reacción 11. Describa la constante de equilibrio en función de las fracciones molares en equilibrio
tenga lugar en el grado y a las velocidades deseadas
8. Ecuaciones que relacionan las variables de un sistema Al incrementarse el
Las ecuaciones de estado de las sustancias del sistema. valor de la constante
Las leyes de equilibrio físico o químico (relaciones entre fases, constantes de
equilibrio químico, etc.). en un sistema en equilibrio.
de equilibrio aumenta
Las leyes cinéticas o de velocidad. En un sistema que no está en equilibrio. la conversión de
9. Variaciones del calor de reacción en función de la temperatura y la presión. equilibrio
12. Que requisitos o condiciones se deben cumplir para medir velocidades de reacción Los reactores discontinuos se usan porque determinan parámetros de ley de velocidad
intrínsecas para reacciones homogéneas. La determinación se realiza midiendo la concentración
La concentración de los reaccionantes o productos y la temperatura son como función del tiempo y después se utiliza el método diferencial o integral.
iguales en todos los puntos de la mezcla reaccionante. Esto se consigue con 18. Factores a tener en cuenta a la hora de desarrollar un proceso
la utilización de un reactor homogéneo por lotes (reactor discontinuo) con un a. Condiciones en las que la reacción es posible (P, T).
buen mezclado. b. En qué grado se produce la reacción (Termodinámica).
Las concentraciones sólo cambian a causa de la reacción. Puede que se c. A qué velocidad (Cinética ).
produzca un cambio en concentración no sólo por el avance de la propia d. Qué fases se encuentran presentes en la reacción.
reacción, sino por un cambio en el volumen. El volumen será constante 19. Modelos de flujo
cuando también lo sean la temperatura, la presión y, en el caso de las - Modelo de mezcla perfecta (reactores de tanque agitado)
reacciones gaseosas, los moles de la mezcla reaccionante. - Modelo de flujo en pistón (reactores tubulares)
20. Tipos principales de reactores químicos
13. Defina la velocidad de reacción en función de la temperatura, presión y composición a. Reactor Discontinuo Ideal o Por Lotes y los
Las velocidades de reacción dependen de la temperatura, la presión y las b. Reactores ideales de flujo estacionario:
concentraciones. Por consiguiente : (-r)A=f( temperatura, presión, composición) i. Reactor de Tanque Agitado o CSTR.
Estas variables están relacionadas en el sentido de que la presión esta en función de la ii. Reactor de Flujo Pistón o PFR
temperatura y la composición. Por lo que podemos escribir : iii. Reactor de lecho Empacado o PBR
21. Velocidad de reacción para reacciones homogeneas
(-r)A=f(temperatura,composición)
14. Reacciones reversibles La velocidad de una reacción homogénea se define como el cambio del número de
Son aquellas reacciones que se dan en equilibrio es decir los reactivos solo reaccionan moles (debido a la reacción) de un reactante o un producto, por unidad de tiempo y
hasta un punto determinado y apartir del cual los productos empiezan a transformarse unidad de volumen de la mezcla reaccionante
en reactivo. En relación al equilibrio: (se llega al equilibrio antes de que se alcance el 100 22. Velocidad de reacción para reacciones heterogéneas
% de conversión). Para reacciones heterogéneas, la velocidad de desaparición de la especie A es denotada
15. Reacciones irreversibles como (rA')
Son aquellas reacciones en las cuales los reactivos se convierten en productos en casi o Las reacciones heterogéneas de interés son principalmente catalíticas.
su totalidad. En relación al equilibrio: (conversión total). Consecuentemente, la velocidad es definida en términos de la masa del catalizador
16. Explique la ley de la velocidad para una reaccion química presente. Unidades of (-rA')
Función de la temperatura y de la concentración de los reactivos - mol por unidad tiempo por masa de catalizador
Independiente del tipo de reactor y - mol/s-g or kmol/hr-kg catalizador
Esta descrita por la ley de velocidad de reacción.
Ecuación algebraica : 23. orden de reaccion: El orden de reacción (n) se refiere a las potencias a las que las
(-rA) = k ·[términos de concentración] concentraciones se elevan en la ley de la velocidad El orden global de la reacción n es n = α+ β
(-rA) = k CA o
(-rA) = k CA² donde, k es la constante de 23. Calor de reacción: El calor de reacción, Qr se define como la energía absorbida y
velocidad especifica [k=f(T)] liberada por un sistema cuando los productos de una reacción se llevan a la misma
17. Explique cómo calcular la concentración en reactores discontinuos temperatura de los reactantes.
La concentración de los reaccionantes o productos y la temperatura son iguales en
todos los puntos de la mezcla reaccionante. Esto se consigue con la utilización de un
reactor homogéneo por lotes (reactor discontinuo) con una buen mezclado.
S-ar putea să vă placă și
- Problemas Resueltos Cinetica QuimicaDocument34 paginiProblemas Resueltos Cinetica QuimicaAlvaro Llanos100% (3)
- Agurto Calvo Santiago - Estudios Acerca de La Construccion Arquitectura Y Planeamiento IncasDocument286 paginiAgurto Calvo Santiago - Estudios Acerca de La Construccion Arquitectura Y Planeamiento IncasRaiza Roxana100% (1)
- Análisis de La BiromeDocument4 paginiAnálisis de La BiromeMariano Losio100% (2)
- Sesión 3Document49 paginiSesión 3Luis Santiago Gutierrez FalconÎncă nu există evaluări
- Cuadro N°1: Identificacion de Peligros Y Riesgos de La Imagen N°1Document7 paginiCuadro N°1: Identificacion de Peligros Y Riesgos de La Imagen N°1Nelson xD Coaguila TarifaÎncă nu există evaluări
- Impacto de La Actividad Física en El Desarrollo Cerebral y El Aprendizaje Durante La Infancia y La AdolescenciaDocument14 paginiImpacto de La Actividad Física en El Desarrollo Cerebral y El Aprendizaje Durante La Infancia y La AdolescenciaJ Frank Qch0% (1)
- Silabo-Soldadura y Control de CalidadDocument5 paginiSilabo-Soldadura y Control de CalidadJ Frank QchÎncă nu există evaluări
- Bases 158Document27 paginiBases 158J Frank QchÎncă nu există evaluări
- Practica 2 Microestrutura de Aceros y Aleaciones MetalicasDocument2 paginiPractica 2 Microestrutura de Aceros y Aleaciones MetalicasJ Frank QchÎncă nu există evaluări
- Bases 58Document29 paginiBases 58J Frank QchÎncă nu există evaluări
- ConferenciaDocument1 paginăConferenciaJ Frank QchÎncă nu există evaluări
- ConferenciaDocument1 paginăConferenciaJ Frank QchÎncă nu există evaluări
- Practica 2 Microestrutura de Aceros y Aleaciones MetalicasDocument6 paginiPractica 2 Microestrutura de Aceros y Aleaciones MetalicasJ Frank QchÎncă nu există evaluări
- Observacion 0bv9cv7ut3iDocument1 paginăObservacion 0bv9cv7ut3iJ Frank QchÎncă nu există evaluări
- 03 Magnitudes Fisicas I PDFDocument10 pagini03 Magnitudes Fisicas I PDFAndy SampedroÎncă nu există evaluări
- Cuadro de TalentosDocument9 paginiCuadro de TalentosJ Frank QchÎncă nu există evaluări
- Documento de DireccionDocument1 paginăDocumento de DireccionJ Frank QchÎncă nu există evaluări
- Práctica GlobalizaciónDocument3 paginiPráctica GlobalizaciónJ Frank QchÎncă nu există evaluări
- Artiuclo Científico de RevisiónDocument5 paginiArtiuclo Científico de RevisiónJ Frank QchÎncă nu există evaluări
- Lectura - Población MundialDocument3 paginiLectura - Población MundialJ Frank QchÎncă nu există evaluări
- Primero Sistemas Moralas y Escuelas HelenísticiasDocument9 paginiPrimero Sistemas Moralas y Escuelas HelenísticiasJ Frank QchÎncă nu există evaluări
- Cuadro de TalentosDocument9 paginiCuadro de TalentosJ Frank QchÎncă nu există evaluări
- Examen Final de Word (1 - 2020)Document2 paginiExamen Final de Word (1 - 2020)J Frank QchÎncă nu există evaluări
- Grupo EmperadorDocument1 paginăGrupo EmperadorJ Frank QchÎncă nu există evaluări
- Unidad 2 VFDocument65 paginiUnidad 2 VFbritanny palaciosÎncă nu există evaluări
- Lectura - Población MundialDocument3 paginiLectura - Población MundialJ Frank QchÎncă nu există evaluări
- Practica Math 1ro Sem 19 Veronica ParedesDocument7 paginiPractica Math 1ro Sem 19 Veronica ParedesJ Frank QchÎncă nu există evaluări
- Unidad 2 VFDocument65 paginiUnidad 2 VFbritanny palaciosÎncă nu există evaluări
- PLANIFICACION 1ro AB DIA 6 de SetiembreDocument7 paginiPLANIFICACION 1ro AB DIA 6 de SetiembreJ Frank QchÎncă nu există evaluări
- Bases Lider Peru OctubreDocument2 paginiBases Lider Peru OctubreJ Frank QchÎncă nu există evaluări
- Resumen ModelmientoDocument19 paginiResumen ModelmientoJ Frank QchÎncă nu există evaluări
- MapaDocument1 paginăMapaJ Frank QchÎncă nu există evaluări
- PA 2 (Rúbrica)Document3 paginiPA 2 (Rúbrica)abuelito blaugranaÎncă nu există evaluări
- 03 Magnitudes Fisicas I PDFDocument10 pagini03 Magnitudes Fisicas I PDFAndy SampedroÎncă nu există evaluări
- Ficha Evaluación Organizadores VisualesDocument2 paginiFicha Evaluación Organizadores VisualesJ Frank QchÎncă nu există evaluări
- Dilo de Otra Manera Utiliza Sinonimos: LeerDocument1 paginăDilo de Otra Manera Utiliza Sinonimos: LeerTeddy CGÎncă nu există evaluări
- Actividad 3 Análisis de OperaciónDocument2 paginiActividad 3 Análisis de Operaciónbrauliocm2011Încă nu există evaluări
- 20 MoCADocument5 pagini20 MoCACandy CajamarcaÎncă nu există evaluări
- Suelo AysenDocument159 paginiSuelo AysenRorambo 07Încă nu există evaluări
- Syllabus - Laboratorio de Rodaje I - UartesDocument12 paginiSyllabus - Laboratorio de Rodaje I - UartesDaniel EstrellaÎncă nu există evaluări
- HT No. 4 1S2023 FII PotencialDocument1 paginăHT No. 4 1S2023 FII PotencialERICK ESTUARDO IXENÎncă nu există evaluări
- Prismyan IntroduzioneTecnicaDocument72 paginiPrismyan IntroduzioneTecnicaJesús Manuel Giz NovoÎncă nu există evaluări
- Fuerza y Estatica para Quinto Grado de SecundariaDocument7 paginiFuerza y Estatica para Quinto Grado de SecundariaErika NavarroÎncă nu există evaluări
- Actividad Evaluativa Eje4Document3 paginiActividad Evaluativa Eje4Yiset Tibocha JimenezÎncă nu există evaluări
- Guia Biologia 7-2 Periodo Jorge Navarro 2020 PDFDocument13 paginiGuia Biologia 7-2 Periodo Jorge Navarro 2020 PDFJorge Andres Navarro de la RosaÎncă nu există evaluări
- UntitledDocument18 paginiUntitledEdzon MaldonadoÎncă nu există evaluări
- Logística de Comercio ExteriorDocument2 paginiLogística de Comercio ExteriorLena OrozcoÎncă nu există evaluări
- Tema (8) ELU Punzonamiento y TorsionDocument20 paginiTema (8) ELU Punzonamiento y TorsionMilagros GiraudoÎncă nu există evaluări
- MSDS Teycer DB OP ES v17.1Document11 paginiMSDS Teycer DB OP ES v17.1Ing_RaulÎncă nu există evaluări
- CLASE 5 y 6. Captura y Esfuerzo de PescaDocument43 paginiCLASE 5 y 6. Captura y Esfuerzo de PescaMeller Caceres RabelloÎncă nu există evaluări
- 2022 01T1CargasDocument4 pagini2022 01T1CargasKARLA DE LA CRUZ SILVAÎncă nu există evaluări
- Formato Asignación de Horario Salud.Document1 paginăFormato Asignación de Horario Salud.ERENDIRA RUIZ IBARRAÎncă nu există evaluări
- Reseña Arte RupestreDocument2 paginiReseña Arte RupestreSara Catalina Gutierrez ArciniegasÎncă nu există evaluări
- Guia de Aprendizaje - VentilaciónDocument7 paginiGuia de Aprendizaje - VentilaciónFernanda BarrreraÎncă nu există evaluări
- Evaluación Bimestral - Segundo Periodo - Séptimo - Tipo 1Document4 paginiEvaluación Bimestral - Segundo Periodo - Séptimo - Tipo 1Andrés AparicioÎncă nu există evaluări
- 1.1. Conocete A Ti Mismo. (Quién Soy) - Mauro LunaDocument4 pagini1.1. Conocete A Ti Mismo. (Quién Soy) - Mauro LunaMauro Alessandro Luna Aquino 143Încă nu există evaluări
- Fi7 - Ejercicio Plano Inclinado+tornoDocument3 paginiFi7 - Ejercicio Plano Inclinado+tornoKærlighedÎncă nu există evaluări
- Evaluacion 1Document10 paginiEvaluacion 1Alex Ivan Riva MejiaÎncă nu există evaluări
- Correccion - Guia 1 - Leyes de NewtonDocument4 paginiCorreccion - Guia 1 - Leyes de Newtonmiguel parraÎncă nu există evaluări
- Matriz AdyacenciaDocument3 paginiMatriz AdyacenciaDiana TorresÎncă nu există evaluări