Documente Academic
Documente Profesional
Documente Cultură
Guia Ejercicios Ley de Hess
Încărcat de
Jorge Luis0 evaluări0% au considerat acest document util (0 voturi)
305 vizualizări4 paginiLey de hess ejercicios.
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentLey de hess ejercicios.
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
305 vizualizări4 paginiGuia Ejercicios Ley de Hess
Încărcat de
Jorge LuisLey de hess ejercicios.
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 4
Guía Ejercicios
Profesor: Jorge Martínez
Objetivos de Aprendizajes:
Aplicar conceptos de entalpía y ley de Hess vistos en clases.
Nombre: …………………………………………………………………………… Curso: Fecha:…………………
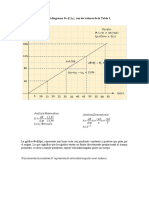
La Ley de Hess, es un método indirecto de calcular el Calor de Reacción o Entalpia de
Reacción.
La ley de Hess se puede enunciar como sigue: cuando los reactivos se convierten a productos, el
cambio de entalpía es el mismo, independientemente de que la reacción se efectúe en una paso o
en una serie de pasos.
En el ejemplo siguiente veremos la aplicación de la Ley de Hess.
Se quiere calcular la Entalpía de reacción para la reacción:
2 C(s) + H2(g) → C2H2(g)
Nos proporcionan los datos siguientes:
Planteamos las ecuaciones correspondientes a las entalpías dadas:
Ubicamos en ellas a los reactantes y productos de la reacción química que buscamos:
Ahora debemos acomodar las ecuaciones:
la ecuación (1) la debemos invertir (recuerden que también se invierte el valor de la entalpía)
la ecuación (2), debemos multiplicarla por 2 (recuerden se multiplica toda la ecuación, tanto
reactantes como productos y el valor de la entalpía, pues es propiedad extensiva.
la ecuación (3), la dejamos igual.
La sumatoria de las ecuaciones acomodadas debe darnos la ecuación problema.
Se suman o se anulan los reactantes y productos.
Las entalpías se suman algebraicamente.
Basándonos en la Ley de Hess, hemos podido encontrar el:
La Ley de Hess basa su principio en que la variación de la entalpía es una función de
estado.
Por lo tanto,
es independiente del número de pasos y de la naturaleza específica de cada uno de
ellos.
Ejercicios
1. Calcula la entalpia estándar de la reacción: C (s) + 2 H2 (g) → CH4 (g) a partir de los
siguientes datos:
C (s) + O2 (g) → CO2 (g) ΔH0= -393,5 kJ
H2 (g) +1/2 O2 (g) → H2O (l) ΔH0= -285,8 kJ
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l) ΔH0= -890,4 kJ
2. Calcula la entalpia estándar de la reacción de síntesis del disulfuro de carbono,
CS2 (l), a partir de sus elementos, C (s), y azufre, S (s), a partir de estos datos:
C (s) + O2 (g) → CO2 (g) ΔH0= – 393,5 kJ
S (s) + O2 (g) → SO2 (g) ΔH0 = -296,1 kJ
CS2 (l) + 3 O2 (g) → CO2 (g) + 2 SO2 (g) ΔH0 = – 1072 kJ
3. Calcule el ΔH para la siguiente reacción:
C(s) + S(s) → CS2(l)
Sabiendo que:
C(s) + O2(g) → CO2(g) ΔH = - 393.5 kJ
SO2(g) → S(s) + O2(g) ΔH = 296.8 kJ
CS2(l) + 3O2(g) → CO2(g) + 2SO2(g) ΔH = - 1076.8 kJ
4. Calcular la entalpia de formación de óxido de cinc a partir de los siguientes datos.
Ejercicios adicionales
3) Ejercicios adicionales para practicar la Ley de Hess
a) H2O + CO2=>H2CO + O2 ΔH=?
H2CO3=>H2O + CO2 ΔH= 46.5KJ
H2CO3=>H2CO + O2 ΔH= 84KJ
b) NH (g) + H O(l)=>NO (g) + H (g) ΔH=?
3 2 2 2
2NH3(g)=>N2(g) + 3H2(g) ΔH= 207KJ
2NO2(g)=>N2(g) + 2O2(g) ΔH= 148.5KJ
H2O(l)=>H2(g) + 1/2O2(g) ΔH= -78.7KJ
c) H2S(g) + O2(g)=> S(s) + H2O(l) ΔH=?
H SO (l)=>H S(g) + 3/2O (g) ΔH= 204KJ
2 3 2 2
H2O(l) +SO2(g)=>H2SO3(l) ΔH= - 62KJ
S(s) + O2(g)=>SO2(g) ΔH= - 297KJ
d) NH3(g)=>N2(g) + H2(g) ΔH=?
2NO2(g) + 7H2(g)=>2NH3(g) + 4H2O(l) ΔH= 128.2KJ
2NO2(g)=>N2(g) + 2O2(g) ΔH= 74.3KJ
H2(g) + 1/2O2(g)=>H2O(l) ΔH= 39.3KJ
S-ar putea să vă placă și
- Prueba Entalpía 3° Medio Fila ADocument3 paginiPrueba Entalpía 3° Medio Fila ADaniela Andrea Aros BarriosÎncă nu există evaluări
- Energias Libres Problemas ResueltosDocument2 paginiEnergias Libres Problemas ResueltosJuan VargasÎncă nu există evaluări
- EX PARCIAL QU114 2005 2aDocument1 paginăEX PARCIAL QU114 2005 2aLuis Fernando Chalco RamosÎncă nu există evaluări
- Segundo Examen Departamental BME - 2013-2014Document7 paginiSegundo Examen Departamental BME - 2013-2014JMGHÎncă nu există evaluări
- Tarea 3 FisicoquimicaDocument3 paginiTarea 3 FisicoquimicaKaren GEÎncă nu există evaluări
- 13 Equilibrio Test PDFDocument13 pagini13 Equilibrio Test PDFPedro Amigo HeidiÎncă nu există evaluări
- TQG (Estequiometria y Reacciones Quimicas)Document5 paginiTQG (Estequiometria y Reacciones Quimicas)camiÎncă nu există evaluări
- Acidobase ProblemasDocument7 paginiAcidobase ProblemasRobert OcrospomaÎncă nu există evaluări
- GUIA Entropia y Energia Libre de GibbsDocument9 paginiGUIA Entropia y Energia Libre de GibbsluzmooreÎncă nu există evaluări
- Problemario U2Document6 paginiProblemario U2JUAN GERARDO CIGARROA RENDONÎncă nu există evaluări
- Apuntes de Balances de Materia y Energía 1Document117 paginiApuntes de Balances de Materia y Energía 1Erick Garcia100% (1)
- Problemas de WhittenDocument9 paginiProblemas de WhittenVivian100% (1)
- Guía Orgánica I 2020Document67 paginiGuía Orgánica I 2020giuliana0% (1)
- Certamen 1 Pauta de CorrecciónDocument2 paginiCertamen 1 Pauta de CorreccióngerardtobarÎncă nu există evaluări
- Ejercicios Medicina VeterinariaDocument9 paginiEjercicios Medicina VeterinariaMariana Lagos RosendeÎncă nu există evaluări
- Ejercicios Propiedades ColigativasDocument4 paginiEjercicios Propiedades ColigativasJhonatan Dávila100% (1)
- QuimicaDocument1 paginăQuimicaAdriana UribeÎncă nu există evaluări
- Peso Equival SolucDocument2 paginiPeso Equival SolucEsteban TerrazasÎncă nu există evaluări
- Estequiometria Problemas 02Document1 paginăEstequiometria Problemas 02andres_old_condeÎncă nu există evaluări
- Quimica Inorganica Complejos 1ra ParteDocument90 paginiQuimica Inorganica Complejos 1ra Partedaniela estefiÎncă nu există evaluări
- Ejercicios de Cinética QuímicaDocument5 paginiEjercicios de Cinética QuímicaMabel HernandezÎncă nu există evaluări
- Ejercicios Ley de Charles, Gas IdealDocument1 paginăEjercicios Ley de Charles, Gas IdealClases particulares en la LagunaÎncă nu există evaluări
- Ejercicios de Ley de RaoultDocument1 paginăEjercicios de Ley de RaoultClases particulares en la Laguna100% (2)
- Tema4-Metodos Gravimetricos Ejercicios ResueltosDocument20 paginiTema4-Metodos Gravimetricos Ejercicios ResueltosConus GeographusÎncă nu există evaluări
- Ejercicios modelo átomo Bohr hidrógenoDocument1 paginăEjercicios modelo átomo Bohr hidrógenoErick GomezÎncă nu există evaluări
- Termodinámica Química Aplicada Ingeniería Química - CUCEI: Tarea No. 1Document7 paginiTermodinámica Química Aplicada Ingeniería Química - CUCEI: Tarea No. 1FATIMA SARAY QUEZADA REYESÎncă nu există evaluări
- Resolución de Problemas N5 - Grupo AmatistaDocument4 paginiResolución de Problemas N5 - Grupo AmatistaSam SepiolÎncă nu există evaluări
- Taller Fisica 1 LaboratorioDocument9 paginiTaller Fisica 1 LaboratorioJuan Felipe BonillaÎncă nu există evaluări
- BalancesDocument4 paginiBalancesNestor Ricardo Chi Hernandez0% (2)
- Cinetica HomogeneaDocument111 paginiCinetica HomogeneaLeslie Zavaleta BazanÎncă nu există evaluări
- Tarea (9) GrupoDocument8 paginiTarea (9) GrupoKevin AndresÎncă nu există evaluări
- BalanceDocument8 paginiBalanceAlex Pascual ToapantaÎncă nu există evaluări
- Problemas Resueltos de Soluciones BuffersDocument9 paginiProblemas Resueltos de Soluciones BuffersStefanny Yohana Pablo ArzapaloÎncă nu există evaluări
- Taller Primera Ley de La TermodinamicaDocument1 paginăTaller Primera Ley de La TermodinamicaAntonio MejiaÎncă nu există evaluări
- Guía #4 - Energía Libre - Clausius Clapeyron 2021Document4 paginiGuía #4 - Energía Libre - Clausius Clapeyron 2021Andreina RicattoÎncă nu există evaluări
- Taller PropiedadescoligativasDocument1 paginăTaller PropiedadescoligativasArley Mateus0% (1)
- TEMA 3termoquimicaDocument16 paginiTEMA 3termoquimicaCarolina CastilloÎncă nu există evaluări
- Ejercicios de disoluciones y cálculos químicosDocument3 paginiEjercicios de disoluciones y cálculos químicosFrancisco Arcturus100% (1)
- Otros ExamnesDocument9 paginiOtros ExamnesEliseo FloresÎncă nu există evaluări
- PiritaDocument3 paginiPiritaSamiirOx Xz' Méndez LimayÎncă nu există evaluări
- Preguntas de Equilibrio Quimico - PDFDocument26 paginiPreguntas de Equilibrio Quimico - PDFDagne PovedaÎncă nu există evaluări
- Probtermas de TermodinamicaDocument13 paginiProbtermas de TermodinamicawalterperelmanÎncă nu există evaluări
- Termodinamica ExamenesDocument21 paginiTermodinamica ExamenesRicardo Anibal Arroyo Flores100% (1)
- TP 10 Cinética Por Polarimetría - ActualizadaDocument7 paginiTP 10 Cinética Por Polarimetría - ActualizadaMicaela Vicente DiazÎncă nu există evaluări
- Tarea Ciclo de Born - HaberDocument3 paginiTarea Ciclo de Born - HaberSantiago PérezÎncă nu există evaluări
- Respuestas Cap. 20 QuimicaDocument2 paginiRespuestas Cap. 20 QuimicaManuel Alejandro Jojoa BucheliÎncă nu există evaluări
- Formulación de compuestos químicosDocument6 paginiFormulación de compuestos químicosJuan ÁlvarezÎncă nu există evaluări
- PROBLEMARIO VolumetríaDocument5 paginiPROBLEMARIO VolumetríaVerónica LópezÎncă nu există evaluări
- Ejercicios de Soluciones IDocument3 paginiEjercicios de Soluciones IDanielita DanielaÎncă nu există evaluări
- Examen Parcial de Fisicoquímica 1 (Teoría) UNMSM - IQDocument2 paginiExamen Parcial de Fisicoquímica 1 (Teoría) UNMSM - IQAyudaFIQ-SMÎncă nu există evaluări
- Compuestos de CordinacionDocument28 paginiCompuestos de CordinacionNehemias job Ruiz mamaniÎncă nu există evaluări
- Cuestiones y Problemas Del Tema 6: Equilibrio QuímicoDocument21 paginiCuestiones y Problemas Del Tema 6: Equilibrio QuímicoBlueStorsÎncă nu există evaluări
- Problemas de Soluciónes Con RespuestaDocument3 paginiProblemas de Soluciónes Con RespuestaAnthonyKleinNuñezAlarconÎncă nu există evaluări
- Mafer 2Document3 paginiMafer 2Bryan RochaÎncă nu există evaluări
- S 3 Q1216 (10-1)Document4 paginiS 3 Q1216 (10-1)los sabiosÎncă nu există evaluări
- Taller Proteinas Bioquimica ResueltoDocument12 paginiTaller Proteinas Bioquimica ResueltoSebastián ArenasÎncă nu există evaluări
- Taller 6 EquilibrioDocument3 paginiTaller 6 Equilibrioliz100% (1)
- Termoquímica IIDocument30 paginiTermoquímica IIALI EDSON MARTINEZ ZEGARRAÎncă nu există evaluări
- Unidad Tematica 5 - TermoquimicaDocument6 paginiUnidad Tematica 5 - TermoquimicaAlberto AlvarezÎncă nu există evaluări
- Semana N°3 Termoquimica Ii 2022-20Document31 paginiSemana N°3 Termoquimica Ii 2022-20Mishel Dayana Arroyo ChambergoÎncă nu există evaluări
- RedoxDocument9 paginiRedoxJorge LuisÎncă nu există evaluări
- Clase 2 Soluciones MolaridadDocument19 paginiClase 2 Soluciones MolaridadJorge LuisÎncă nu există evaluări
- No Se Que Wea Es EstoDocument1 paginăNo Se Que Wea Es EstoJorge LuisÎncă nu există evaluări
- HXH Prueba 3Document20 paginiHXH Prueba 3Jorge LuisÎncă nu există evaluări
- Neurogénesis AdultaDocument10 paginiNeurogénesis Adultajidu63Încă nu există evaluări
- Polímeros Naturales y SintéticosDocument22 paginiPolímeros Naturales y SintéticosJorge LuisÎncă nu există evaluări
- GuiaCNEstudiantes PDFDocument52 paginiGuiaCNEstudiantes PDFMaría Isabel Tesla Salgado Ayala100% (1)
- Clase 19 Química Orgánica I Propiedades Del Carbono e Hidrocarburos 2016Document27 paginiClase 19 Química Orgánica I Propiedades Del Carbono e Hidrocarburos 2016Jorge LuisÎncă nu există evaluări
- Guia Ejercicios de Organica Qui020 y Qui022 PDFDocument128 paginiGuia Ejercicios de Organica Qui020 y Qui022 PDFmichael camilo100% (1)
- Taller EstequimetriaRL REDocument2 paginiTaller EstequimetriaRL REJorge LuisÎncă nu există evaluări
- Experiencia Entalpía de VaporizaciónDocument2 paginiExperiencia Entalpía de VaporizaciónJorge LuisÎncă nu există evaluări
- Adhesión y Migracion CelularDocument28 paginiAdhesión y Migracion CelularJorge LuisÎncă nu există evaluări
- Guia DocentesDocument48 paginiGuia DocentesLucio RodriguezÎncă nu există evaluări
- Guia Solidos CristalinosDocument2 paginiGuia Solidos CristalinosJorge LuisÎncă nu există evaluări
- TESISROXAJARADocument268 paginiTESISROXAJARAJorge LuisÎncă nu există evaluări
- Guia Lab PolimerosDocument2 paginiGuia Lab PolimerosJorge LuisÎncă nu există evaluări
- Informe BiologiaDocument2 paginiInforme BiologiaJorge LuisÎncă nu există evaluări
- GestiondeProcesos 201522Document163 paginiGestiondeProcesos 201522Jorge LuisÎncă nu există evaluări
- Drogas 2Document4 paginiDrogas 2Jorge LuisÎncă nu există evaluări
- Simbiosis Como Mecanismo de Evolución Por Ricardo GuerreroDocument4 paginiSimbiosis Como Mecanismo de Evolución Por Ricardo GuerreroJorge LuisÎncă nu există evaluări
- Biopolimeros 1 2011Document30 paginiBiopolimeros 1 2011Jorge LuisÎncă nu există evaluări
- Un Angel Enviado Por DiosDocument1 paginăUn Angel Enviado Por DiosJorge LuisÎncă nu există evaluări
- Auditori ADocument9 paginiAuditori AJorge LuisÎncă nu există evaluări
- Informe de CierreDocument1 paginăInforme de CierreJorge LuisÎncă nu există evaluări
- Género LíricoDocument35 paginiGénero LíricoPaulinaNNÎncă nu există evaluări
- Espectro Óptico y Espectro AuditivoDocument19 paginiEspectro Óptico y Espectro AuditivoJorge LuisÎncă nu există evaluări
- Fisica LuzDocument16 paginiFisica LuzJorge LuisÎncă nu există evaluări
- Componentes de La TierraDocument1 paginăComponentes de La TierraJorge LuisÎncă nu există evaluări
- El TimbreDocument11 paginiEl TimbreJorge LuisÎncă nu există evaluări
- Gases IdealesDocument25 paginiGases IdealespieroxomyÎncă nu există evaluări
- Cuestionario MCUDocument3 paginiCuestionario MCURoberto SuárezÎncă nu există evaluări
- Elementos de Eje Curvo y de Sección VariableDocument11 paginiElementos de Eje Curvo y de Sección VariableJosephJaramillodelAguilaÎncă nu există evaluări
- Antecedentes Históricos de La EnergiaDocument6 paginiAntecedentes Históricos de La Energiainterfaz777100% (1)
- Geologia Sirve - 2019 EmiDocument560 paginiGeologia Sirve - 2019 EmiAnonymous nyxNr3fkÎncă nu există evaluări
- Dilatacion TermicaDocument12 paginiDilatacion TermicaFernando MacedaÎncă nu există evaluări
- Plan de Area Ciencias Naturales - 2019Document75 paginiPlan de Area Ciencias Naturales - 2019MIRLEIDYS PABA RUIZÎncă nu există evaluări
- Mecánica Cuántica-Espectroscopías de Resonancia Magnética IIDocument26 paginiMecánica Cuántica-Espectroscopías de Resonancia Magnética IIAraujo ThiagoÎncă nu există evaluări
- Problemas Resueltos de Maquinas Electricas ML 202 para El ParcialDocument20 paginiProblemas Resueltos de Maquinas Electricas ML 202 para El Parcialcorpses88Încă nu există evaluări
- Centrales hidroeléctricas de EdegelDocument38 paginiCentrales hidroeléctricas de EdegelLesly Anyeline FernandezÎncă nu există evaluări
- Fuerza magnética entre conductoresDocument18 paginiFuerza magnética entre conductoresricardoÎncă nu există evaluări
- Intensivo 05Document4 paginiIntensivo 05Gerardo Gonzalo Sanchez FloresÎncă nu există evaluări
- Práctica No. 3 - Lab. de Física EM-CBF212LDocument10 paginiPráctica No. 3 - Lab. de Física EM-CBF212LAmbar SantanaÎncă nu există evaluări
- Numeros ComplejosDocument11 paginiNumeros ComplejosJESON MIGUEL OLVERA RAMIREZÎncă nu există evaluări
- TD4-intercambiadores-y-valvulas EnonceDocument6 paginiTD4-intercambiadores-y-valvulas EnonceLuc AusterÎncă nu există evaluări
- Problema 1 1Document26 paginiProblema 1 1Diana MorenoÎncă nu există evaluări
- Teoría de la relatividad general de EinsteinDocument3 paginiTeoría de la relatividad general de EinsteinMussuline G. Tenorio AÎncă nu există evaluări
- Electrostatica - Breve Teoria PDFDocument42 paginiElectrostatica - Breve Teoria PDFAgus VegettiÎncă nu există evaluări
- Informe Final PandeoDocument10 paginiInforme Final PandeoMartin AtoraÎncă nu există evaluări
- Cinemticadelmovimientomandibular - Parte 1Document30 paginiCinemticadelmovimientomandibular - Parte 1SOFIA CASTRO DELFINÎncă nu există evaluări
- TERMODINAMICADocument3 paginiTERMODINAMICARoSe-NeLlY0% (1)
- Motores, conceptos básicos y métodos de arranqueDocument4 paginiMotores, conceptos básicos y métodos de arranqueContreras Ramirez Jea DaniÎncă nu există evaluări
- Fundamento Numero de ReynoldsDocument2 paginiFundamento Numero de ReynoldsLuis GironÎncă nu există evaluări
- Daniel Jacob El Fuego de KundaliniDocument17 paginiDaniel Jacob El Fuego de KundaliniHernan LedesmaÎncă nu există evaluări
- LABORATORIOHIDRAULICA1Document6 paginiLABORATORIOHIDRAULICA1Leonel OrellanaÎncă nu există evaluări
- Ciclo Brayton y factores que afectan el empuje y consumo específico de un motor de reacciónDocument7 paginiCiclo Brayton y factores que afectan el empuje y consumo específico de un motor de reacciónmarcosÎncă nu există evaluări
- Tema 2Document39 paginiTema 2José Lobato TrujilloÎncă nu există evaluări
- Rueda MaxwellDocument2 paginiRueda MaxwellEsteban VargasÎncă nu există evaluări
- Fisica Dinamica de RotacionDocument21 paginiFisica Dinamica de Rotacionfreivel3190100% (4)
- SISMOSDocument42 paginiSISMOSAtalayaRimacJudithJeidyÎncă nu există evaluări