Documente Academic
Documente Profesional
Documente Cultură
Art Oncogenetica PDF
Încărcat de
F Elipe de SouzaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Art Oncogenetica PDF
Încărcat de
F Elipe de SouzaDrepturi de autor:
Formate disponibile
oncogenética
Para onde caminha a oncogenética?
– Oportunidades e desafios
O futuro chegou? câncer; (2) o diagnóstico e classificação molecular
T
ALVEZ AINDA NÃO TRATEMOS CADA PESSOA IN- dos tumores, com implicação prognóstica; (3) a
DIVIDUALMENTE, MAS CERTAMENTE ENORMES suscetibilidade do indivíduo aos efeitos do trata-
AVANÇOS RECENTES VÊM TORNANDO A MEDICINA mento; e (4) a predição de benefício com o uso de
baseada na genética uma realidade. Será que nós, agentes farmacológicos farão cada vez mais parte de
oncologistas clínicos, teremos que nos tornar tam- nossas rotinas.
bém oncogeneticistas? A aquisição de conhecimen-
tos nessa área será, sem dúvida, necessária até A herança do câncer esporádico
mesmo para entendermos o desenho dos novos es- O reconhecimento de que as variações genéticas
tudos clínicos. Acredito que vamos direcionar herdadas de nossos ancestrais nos caracterizam
nosso aprendizado segundo nossas áreas de atuação como únicos – não apenas na aparência externa,
clínica e de interesse. mas também na forma como reagimos a estímulos
Antecipando a necessidade de formação nas endógenos, ambientais e genéticos e a suas intera-
áreas de oncogenética e biologia molecular, essas ções – é o campo explorado pela epidemiologia
matérias foram incluídas como parte do currículo molecular. Mesmo nos tumores esporádicos, o
mínimo recomendado pela ACCO (ASCO Core componente genético pode influenciar a carcinogê-
Divulgação
Curriculum Outline), que define pontualmente as nese no desenvolvimento de subtipos específicos
competências mínimas para oncologistas clínicos de tumores, na idade de desenvolvimento e tam-
em treinamento, sendo a primeira delas: “I. Princí- bém no seu comportamento biológico. À luz dos
pios científicos básicos; incluindo biologia do conhecimentos atuais, a etiologia dos tumores, o
câncer e genética, etiologia do câncer, imunologia risco e as medidas para o controle do câncer devem
tumoral, e epidemiologia”. ser compreendidos considerando-se o indivíduo e
A ASCO (American Society of Clinical Oncolo- sua família em seus aspectos regionais.
gy), juntamente com a ESMO (European Society for
José Cláudio Casali da Rocha Medical Oncology), recentemente definiu no do- Câncer hereditário: individualizando
cumento Global Core Curiculum as habilidades a prevenção e o tratamento
* Doutorado em oncologia, Fundação que devem ser desenvolvidas por oncologistas clíni- No campo dos tumores hereditários, o nosso nível
Antonio Prudente, São Paulo; de compreensão vem melhorando com o reconhe-
cos, alcançadas em três níveis de conhecimento:
pós-doutor em farmacogenética,
St Jude Children’s Hospital, EUA; essencial (básico); competência para atuar clinica- cimento das variações clínicas de síndromes here-
diretor do CGEN – Centro de mente, do diagnóstico clínico/molecular até as con- ditárias conhecidas e a partir da possibilidade de
Genética, São Paulo; oncogeneticista dutas de rastreamento e prevenção (médio); e bases testagem de mutações genéticas germinativas nos
da Clínica COI e da Clínica Salus, epidemiológicas e biológicas (avançado). Além dos genes de predisposição ao câncer nos probandos
Rio de Janeiro; pesquisador do afetados e nos seus familiares assintomáticos (teste
princípios científicos básicos acima, o currículo
Hospital Erasto Gaertner, Curitiba.
Autor do livro Oncologia Molecular prevê habilidades na área de patologia/medicina preditivo). É interessante que, a cada semana, novos
laboratorial/biologia molecular. genes sejam associados a síndromes hereditárias e
O fato é que precisamos nos preparar nas várias novas síndromes de predisposição ao câncer sejam
Contato: joseclaudior@uol.com.br vertentes do conhecimento em oncogenética, já que descritas. Pouco ainda se conhece sobre as princi-
(1) o uso de biomarcadores de predisposição ao pais síndromes de câncer hereditário no Brasil, com
28 outubro/novembro 2011 Onco&
séries de casos pequenas ou restritas a uma região. Embora a maioria
das famílias brasileiras com síndromes de câncer hereditário relatadas
até agora desenvolva um padrão sindrômico semelhante ao de outras Câncer de mama
Câncer de ovário
populações, algumas variações fenotípicas, mutações genéticas e riscos
de tumores peculiares da população brasileira também têm sido des-
critos. Estudos futuros devem explorar as características étnicas, clínicas
e genéticas de populações de alto risco, melhorando o cuidado espe-
cializado e intradisciplinar e garantindo o direito ao aconselhamento
genético e o acesso aos testes moleculares.
Um dos obstáculos que precisamos superar ainda hoje é o reco-
nhecimento de indivíduos com diagnóstico ou suspeita de câncer
hereditário. A coleta adequada da história familiar de tumores, más-for-
mações congênitas e patologias recorrentes, a representação da estrutura
familiar com a confecção do heredograma (ou árvore genealógica) e sua
interpretação são considerados conhecimentos essenciais. É fundamental
fornecer orientação ao paciente com câncer sobre (1) seus riscos e de Figura 1 Heredograma de uma família com a síndrome do
seus familiares, prevenindo sinistros futuros; e (2) os riscos de transmis- câncer de mama e ovário hereditários (HBOC, na sigla em
são à prole e de recorrência. O diagnóstico clínico e molecular, assim inglês) associada principalmente com mutações nos genes
como medidas individualizadas de rastreamento e prevenção, inclusive BRCA1 e BRCA2 (~20%), mas também com envolvimento
de outros genes ainda pouco explorados, como PTEN,
cirurgias redutoras de risco, deve ser definido.
CHK2, ATM, BRIP1, PALB2, RAD51C, RAD51D, FANC e
Devido à raridade de estudos clínicos e ao baixo poder estatístico CDKN2A, com contribuições <1% cada um
pelo número de participantes nos estudos, os consensos de especia-
listas guiam muitas dessas condutas. Antes de tudo, é importante que
as recomendações estejam adequadas aos riscos relativos e aos perce-
bidos pelo indivíduo. A experiência prática na área de oncogenética
facilita o reconhecimento das principais síndromes hereditárias no
dia a dia e a referência ao oncogeneticista para o aconselhamento
genético (Figuras 1 e 2).
Assinaturas genéticas
O escore de recorrência baseado na assinatura de genes expressos por
tumores vem sendo cada vez mais aplicável na prática clínica. Um
exemplo disso é o painel de 21 genes OncotypeDx, disponível comer-
cialmente para identificar um grupo de mulheres com carcinoma de
mama localizado, receptores hormonais de estrogênio ou progesterona
positivos, com extensão para um a três linfonodos axilares, que não terão
nenhum benefício com quimioterapia, e que derruba o paradigma con-
temporâneo de que toda paciente com comprometimento axilar deve
receber quimioterapia adjuvante. O uso cada vez maior de painéis de
genes classificadores para predição de resposta ao tratamento e/ou de
resistência tumoral identificará os pacientes que terão grande benefício
de tratamento adjuvante e aqueles com baixo escore, que, consequente- Figura 2 Via BRCA. As vias de interação das proteínas BRCA1
mente, poderiam ser poupados dos efeitos adversos do tratamento. e BRCA2 com outras proteínas celulares facilitam o conceito
O rápido desenvolvimento de novas tecnologias para análises de que mutações de diferentes componentes da mesma via
genéticas com alta performance e de aplicativos de bioinformática genética podem causar fenótipos semelhantes
trouxe para o presente a possibilidade de avaliar genomas de tumores
(Figuras 3 e 4). Uma lacuna de oportunidades existe para explorar o
Onco& outubro/novembro 2011 29
imenso abismo que separa o avanço tecnológico e a aplicação prática definição do benefício de um tratamento específico. Além da classifi-
dos novos conhecimentos adquiridos. cação dos tumores por suas características histopatológicas, a expressão
de proteínas (por imuno-histoquímica) e os métodos moleculares (pCR,
Biomarcadores moleculares preditores de sensibilidade sequenciamento, FISH, microarray) trouxeram para o presente a pos-
O avanço na clínica do uso de biomarcadores vem sendo demonstrado, sibilidade do uso rotineiro de detecção de mutações genéticas, ampli-
entre outras aplicações, para a classificação molecular dos tumores e a ficações e fusões gênicas dos tumores com relevância clínica.
Um crescente número de agentes terapêuticos direcionados a alvos
específicos nas células tumorais vem sendo desenvolvido, revolucio-
nando a forma como se tratam diferentes tipos de câncer, tendo como
alvo mutações e/ou vias genéticas. Vários estudos demonstraram que
a seleção de pacientes com base em características genéticas presentes
no tumor identifica aqueles indivíduos que mais se beneficiarão do
uso desses agentes. Com a crescente complexidade da rede de inte-
rações de vias genéticas e dos mecanismos de escape biológicos dos
tumores, será necessário desenvolver uma forma abrangente de se
compreender o espectro de alterações genéticas distintas do câncer.
Só assim será possível traçar estratégias personalizadas voltadas para
subgrupos de pacientes com maior chance de obter benefício com um
tratamento específico ou combinado (Tabela 1).
Farmacogenética
A variabilidade de resposta dos indivíduos aos medicamentos é a base
Figura 3 Mapa genômico de uma linhagem tumoral de câncer dos princípios que suportam a farmacogenética. Enquanto os estudos
de mama (HCC1954). O gráfico circular representa os resultados clínicos procuram definir a janela terapêutica, e a dose do medicamento
do sequenciamento do exoma da linhagem, onde os segmentos é normalmente baseada na dose máxima tolerada, a farmacogenética
definidos no contorno representam os cromossomos, e as linhas
procura adaptar o tratamento com a dose mínima eficaz segundo as ca-
que interligam cromossomos representam as fusões intra ou
intercromossômicas racterísticas do indivíduo. A variação de resposta tumoral desejada e a
toxicidade tolerada pelos tecidos normais podem ser explicadas por varia-
Figura 4 Evolução dos avanços
genômicos ao longo dos últimos
anos. A tecnologia permitiu
a mudança de resolução da análise
genética cromossômica para o
nível de nucleotídeos. Além disso,
o avanço tecnológico também
permitiu aumentarmos o
processamento para as
análises genômicas globais
e o sequenciamento genômico
30 outubro/novembro 2011 Onco&
ções genéticas comuns (polimorfismos) presentes nos genes responsáveis medicamentos com base em análises farmacogenéticas também é uma
por absorção, transporte, distribuição, metabolismo (bioativação e inati- perspectiva da medicina personalizada.
vação) e eliminação dos fármacos, bem como nos genes que regulam as
funções celulares, como o ciclo celular e a capacidade de reparo aos danos Conclusão
do DNA. As variações genéticas potencialmente modulam a disponibili- Ainda temos muitos desafios pela frente até alcançarmos na prática a
dade do agente terapêutico nas células normais e tumorais do indivíduo chamada medicina personalizada. Com a perspectiva real de regermos os
e têm sido incorporadas à prática clínica, como a genotipagem dos genes cuidados ao paciente com câncer e seus familiares, presenciaremos cada
TPMT (metabolismo das tiopurinas); UGT1A1 (irinotecano); DPD, TS, vez mais mudanças no desenho de estudos clínicos. Devemos aproveitar
MTHFR, RFC, entre outros do ciclo do ácido fólico (fluoropirimidinas); para discutir as implicações da medicina personalizada no sistema de
e CYP2D6 (tamoxifeno). O desafio de ajustar as doses e a escolha de saúde público e privado, bem como os seus aspectos éticos e legais.
Tabela 1: Marcadores genéticos de relevância terapêutica em oncologia
Alteração genética Gene envolvido Fenótipo (câncer) Agente alvo direcionado
Translocação/fusão BRC-ABL LMC Imatinibe, dasatinibe, nilotinibe
PML-RARa Leucemia promielocítica aguda Ácido retinoico All-trans (ATRA)
EML4-ALK Mama, colorretal, pulmão Crizotinibe (fase III), foretinibe (fase II)
FIP1L1-PDGFR Leucemia eosinofílica crônica Imatinibe
Amplificação EGFR Pulmão, colorretal, glioblastoma, pâncreas Cetuximabe, gefitinibe, erlotinibe,
panitumumabe, lapatinibe
ErbB2 Mama, ovário Trastuzumabe, lapatinibe
KIT GIST, glioma, hepatocarcinoma, rim, LMC Imatinibe, nilotinibe, sunitinibe, sorafenibe
SRC Sarcoma, LMC, LLA Dasatinibe
PIK3CA Mama, ovário, colorretal, endométrio Inibidores PI3-kinase; experimental: LY294002
Mutação pontual EGFR Pulmão, glioblastoma Cetuximabe, gefitinibe, erlotinibe,
panitumumabe, lapatinibe
KIT GIST, glioma, hepatocarcinoma, rim, LMC Imatinibe, nilotinibe, sunitinibe, sorafenibe
PDGFR GIST, glioma, hepatocarcinoma, rim, LMC Imatinibe, nilotinibe, sunitinibe, sorafenibe
BRAF Melanoma, astrocitoma pediátrico PLX4032 (fase III)
MET Pulmão Cresatinibe (fase III), foretinibe (fase II)
KRAS Colorretal, pâncreas, estômago, pulmão Resistência a erlotinibe, cetuximabe (colorretal)
RAS/RAF Linfoma de células T cutâneo Selumetinib (fase II)
PTEN (mTOR) Câncer de endométrio, próstata, pulmão NSCLC, rim Ridaforolimo, temsirolimo, everolimo
PI3K/Akt Câncer de endométrio, próstata, pulmão NSCLC, rim Ridaforolimo, temsirolimo, everolimo
(mTOR)
PTCH1, SMO Carcinoma basocelular GDC-0449 (vismodegib) (fase II)
(Hedgehog)
Genótipo VEGF-2578 Mama Bevacizumabe
VEGF-1154 Mama Bevacizumabe
Referências bibliográficas http://www.asco.org/ASCOv2/Department%20Content/International%20Af-
fairs/Downloads/ESMO_ASCO_log_book%20final.pdf.
1. Curriculum for Medical Oncology. ACCO: ASCO Core Curriculum 3. MacConaill, LE; Van Hummelen, P; Meyerson M; Hahn, WC. Clinical Im-
Outline http://www.asco.org/ascov2/Education+&+Training/ASCO+ plementation of Comprehensive Strategies to Characterize Cancer Genomes:
Program+Guidelines. Opportunities and Challenges. Cancer Discovery; 1(4): 297–311, 2011.
2. ESMO-ASCO Global Core Curriculum for Training in Medical Oncology 4. Em: Oncologia Molecular. Ferreira, CG; Casali da Rocha, JC. Editora
Log Book. Atheneu, 2a edição, 2010.
Onco& outubro/novembro 2011 31
S-ar putea să vă placă și
- Tipos de AmbulançiaDocument25 paginiTipos de AmbulançiaJose Marcos Pereira da SilvaÎncă nu există evaluări
- 15 Pop Limpeza e Desinfecção de Superfícies FixasDocument1 pagină15 Pop Limpeza e Desinfecção de Superfícies FixasNadyelle CapraÎncă nu există evaluări
- Abrace Esperança - Home Lista de Profissionais Amigos Da ABRACEDocument33 paginiAbrace Esperança - Home Lista de Profissionais Amigos Da ABRACEelton tabusoÎncă nu există evaluări
- Moldagem Anatômica e Moldagem Funcional - OdontoUpDocument1 paginăMoldagem Anatômica e Moldagem Funcional - OdontoUpJuan Augusto Fernández TarazonaÎncă nu există evaluări
- Cirurgias Seguras Salvam VidasDocument2 paginiCirurgias Seguras Salvam VidasThays Moraes100% (3)
- Aplicações da lâmpada de Wood na dermatologiaDocument3 paginiAplicações da lâmpada de Wood na dermatologiaWidigiane FernandesÎncă nu există evaluări
- Gabarito Bolsista 2016Document6 paginiGabarito Bolsista 2016Juliana LimaÎncă nu există evaluări
- Manual MedianavNX 1023-5 NX PTBDocument62 paginiManual MedianavNX 1023-5 NX PTBelcio_sousaÎncă nu există evaluări
- Educação: Artigo 57Document18 paginiEducação: Artigo 57F Elipe de SouzaÎncă nu există evaluări
- Composiçao Do SangueDocument2 paginiComposiçao Do SangueF Elipe de SouzaÎncă nu există evaluări
- Receitas Molhos PDFDocument12 paginiReceitas Molhos PDFF Elipe de SouzaÎncă nu există evaluări
- Artropódes 2Document33 paginiArtropódes 2F Elipe de SouzaÎncă nu există evaluări
- Regulamento EmbasaDocument47 paginiRegulamento EmbasaManoel MessiasÎncă nu există evaluări
- Artropódes 2Document33 paginiArtropódes 2F Elipe de SouzaÎncă nu există evaluări
- Receitas Molhos PDFDocument12 paginiReceitas Molhos PDFF Elipe de SouzaÎncă nu există evaluări
- Edital PC 2018Document49 paginiEdital PC 2018F Elipe de SouzaÎncă nu există evaluări
- Segredos CespeDocument6 paginiSegredos CespePACABEAÎncă nu există evaluări
- Apostila PCRDocument52 paginiApostila PCRAda Urdapilleta100% (1)
- DiarioDocument1 paginăDiarioF Elipe de SouzaÎncă nu există evaluări
- Apostila Do Código de Ética Do Servidor Civil Federal, ComentadoDocument17 paginiApostila Do Código de Ética Do Servidor Civil Federal, ComentadoAchei ConcursosÎncă nu există evaluări
- SaudadeDocument1 paginăSaudadeF Elipe de SouzaÎncă nu există evaluări
- Como o médico faz o diagnóstico do câncer de colo do úteroDocument3 paginiComo o médico faz o diagnóstico do câncer de colo do úterotottinenaÎncă nu există evaluări
- Cúbito VaroDocument20 paginiCúbito VaroDias Neto DiasÎncă nu există evaluări
- Normas hospitalaresDocument4 paginiNormas hospitalaresNicolas AndreyÎncă nu există evaluări
- Perfil de Médica Especializada em PsiquiatriaDocument2 paginiPerfil de Médica Especializada em PsiquiatriaVivy TellesÎncă nu există evaluări
- Radiografia do Tornozelo, Pé e CalcâneoDocument65 paginiRadiografia do Tornozelo, Pé e CalcâneoBira ViannaÎncă nu există evaluări
- Prova Acesso DiretoDocument11 paginiProva Acesso DiretoLeticia MeloÎncă nu există evaluări
- Fluoroscopia e Procedimentos IntervencionistasDocument25 paginiFluoroscopia e Procedimentos IntervencionistasTalison MatosÎncă nu există evaluări
- MET-CARE - Carta de Apresentação de ServiçosDocument3 paginiMET-CARE - Carta de Apresentação de ServiçosTadeu T.DÎncă nu există evaluări
- ASO - Atestado de Saúde OcupacionalDocument3 paginiASO - Atestado de Saúde OcupacionalFabio MomessoÎncă nu există evaluări
- NeurocirurgiaDocument2 paginiNeurocirurgiaEugenio FerrazÎncă nu există evaluări
- Mae ParanaenseDocument56 paginiMae ParanaenseBeatriz Diniz NavarroÎncă nu există evaluări
- Guia Convênio Atualizado (005) 23 09 2021Document44 paginiGuia Convênio Atualizado (005) 23 09 2021Anderson SousaÎncă nu există evaluări
- Procedimentos em APSDocument47 paginiProcedimentos em APSraydenÎncă nu există evaluări
- Psioclogia Da Gravidez e Maternidade/Paternidade - 4 (Aspecttos Psicológicos Dos 3 Trimestres de Gravidez)Document102 paginiPsioclogia Da Gravidez e Maternidade/Paternidade - 4 (Aspecttos Psicológicos Dos 3 Trimestres de Gravidez)CDuqueÎncă nu există evaluări
- Distocia de Ombros VVDocument43 paginiDistocia de Ombros VVElizangela Dias Sousa AntunesÎncă nu există evaluări
- SES-SP RM 2024 Edital 1 Abertura AtualizadoDocument56 paginiSES-SP RM 2024 Edital 1 Abertura AtualizadoKaique VelosoÎncă nu există evaluări
- Profissionais FUSExDocument9 paginiProfissionais FUSExVânius FranzonÎncă nu există evaluări
- Declaracao OtomizadosDocument2 paginiDeclaracao OtomizadosErva AgridoceÎncă nu există evaluări
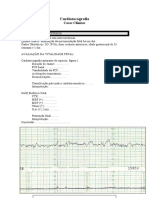
- Cardiotocografia: 4 casos clínicosDocument4 paginiCardiotocografia: 4 casos clínicosCARLOS EDUARDO DO NASCIMENTO MARTINSÎncă nu există evaluări
- Decifrar Pessoas EbookDocument2 paginiDecifrar Pessoas EbookSaulofiscalÎncă nu există evaluări
- Coleta Sangue LaboratórioDocument3 paginiColeta Sangue LaboratórioHanna CarolinaÎncă nu există evaluări
- Termo de Responsabilidade TecnicaDocument1 paginăTermo de Responsabilidade TecnicaDr. João Vitor SoaresÎncă nu există evaluări
- Disruptive case reportDocument4 paginiDisruptive case reportGoretti Rodrigues de SousaÎncă nu există evaluări