Documente Academic
Documente Profesional
Documente Cultură
Organica
Încărcat de
Camila Florido FajardoTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Organica
Încărcat de
Camila Florido FajardoDrepturi de autor:
Formate disponibile
Revista Cubana de Química
ISSN: 0258-5995
revcubanaquimica@cnt.uo.edu.cu
Universidad de Oriente
Cuba
León-Cedeño, F.; Menes-Arzate, M.; García-Ortega, H.
SÍNTESIS DE 5,10,15,20-TETRAFENILPORFIRINA Y SUS DERIVADOS METÁLICOS.
EXPERIMENTO A MICROESCALA PARA EL LABORATORIO DE QUÍMICA ORGÁNICA
HETEROCÍCLICA
Revista Cubana de Química, vol. XVIII, núm. 2, 2006, pp. 140-143
Universidad de Oriente
Santiago de Cuba, Cuba
Disponible en: http://www.redalyc.org/articulo.oa?id=443543704044
Cómo citar el artículo
Número completo
Sistema de Información Científica
Más información del artículo Red de Revistas Científicas de América Latina, el Caribe, España y Portugal
Página de la revista en redalyc.org Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto
SÍNTESIS DE 5,10,15,20-TETRAFENILPORFIRINA Y SUS DERIVADOS METÁLICOS.
EXPERIMENTO A MICROESCALA PARA EL LABORATORIO DE QUÍMICA
ORGÁNICA HETEROCÍCLICA
F. León-Cedeño, M. Menes-Arzate, H. García-Ortega.
Depto. Química Orgánica, DEPg, Facultad de Química, UNAM.
Av. Universidad 3000, Copilco El Bajo, 04510, Coyoacán, México, D. F., México.
e-mail: hector.garcia@servidor.unam.mx
Resumen.
En el presente trabajo reportamos la síntesis en microescala de la 5,110,15,20-tetrafenilporfirina y
de algunos derivados metálicos. Esta técnica resulta factible realizarla en una sesión de enseñanza en
el laboratorio de química orgánica heterocíclica de cuatro horas. Los resultados obtenidos son
satisfactorios de tal forma que se realiza la síntesis, reactividad y caracterización de compuestos
porfírinicos.
Palabras clave: Heterocíclica, Porfirinas, Síntesis Orgánica, TPP, Microescala.
Introducción.
La síntesis de porfirinas es de gran importancia y continuamente aumentan las investigaciones
realizadas sobre los aspectos orgánicos, inorgánicos, físicos y biológicos de este tipo de compuestos.
Las porfirinas han sido usadas sistemas modelo para estudiar la transferencia de carga1 y la
fotoactivación in vivo de precursores de algunos fármacos2, en diodos orgánicos de emisión de luz3,
como fotosensibilizadores en el tratamiento del cáncer4 y en la formación de agregados altamente
ordenados5, además de ser una de las estructuras principales para que la vida pueda continuar
(clorofila y hemo).
En la bibliografía se pueden encontrar varias referencias6 que abarcan la química y usos de
porfirinas. Por ser un heterociclo tan importante creemos que el poder acercar al alumno a la
química de este tipo de compuestos, tanto en su síntesis, como en su reactividad, reforzará el
conocimiento que adquiera sobre este anillo heterocíclico. Aunado a esto, el poder realizar dichas
prácticas en un corto tiempo y a nivel microescala aumenta las ventajas en el aprovechamiento del
conocimiento que los estudiantes adquieren7, lo cual refuerza el proceso enseñanza-aprendizaje.
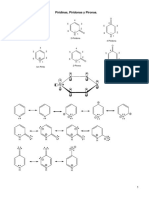
El diseño que presentamos (Figura 1) es una síntesis sencilla de la 5,10,15,20-tetrafenilporfina
(TPP) y de sus derivados metálicos de Co(II), Cu(II), Mn(II) y Zn(II), así como la caracterización
por medio de sus propiedades espectroscópicas tales como RMN-1H, RMN-13C, IR, EM y UV/Vis.
Además el UV/Vis nos permite observar la formación de agregados y las diferencias que hay entre
la porfirina base libre y su metaloporfirina correspondiente.
Vol. XVIII, No 2, 2006
140
4
N
H
CH3CH2CO2H NH N
+ + 4 H2O
Temp. reflujo,
N HN
CHO
Aire
M1 = (CH3COO)2Co,
DMF
M1 (CH3COO)2Cu,
Temp. reflujo
(CH3COO)2Mn
N N (CH3COO)2Zn
M
N N
M = Co, Cu, Mn, Zn
Figura 1.
Parte Experimental.
El pirrol, el benzaldehído, el ácido propiónico y los acetatos metálicos fueron adquiridos de Aldrich.
Preparación de la 5,10,15,20-tetrafenilporfirina (TPP). Colocar 15-20 mL de ácido propiónico en
un matraz bola de 50 mL acoplado a un refrigerante Liebig y agitación magnética, calentar a reflujo.
Utilizando pipetas Pasteur, adicionar simultáneamente por el refrigerante 0.328 g (4.8 mmol) de
pirrol (985) y 0.509 g (4.8 mmol) de benzaldehído1, procurando minimizar el exceso momentáneo
P P
de alguno de los reactivos (Nota: es importante que se inicie la adición de los reactivos en el
momento en que ya este a reflujo el ácido propiónico). Después de calentar la mezcla de reacción
durante 30 minutos, se enfría a temperatura ambiente, se filtra al vacío y se lava el precipitado con
Vol. XVIII, No 2, 2006
141
metanol hasta que el disolvente salga incoloro. El producto obtenido se seca al vacío. Calcular el
rendimiento de la reacción y caracterizar el producto por cromatografía en capa fina (SiO2, CH2Cl2) B B B B B B
y por espectroscopia UV/Vis en CH2Cl2. Determinar el valor de ε para cada uno de los máximos de
B B B B
absorción que aparecen entre 350 y 750 nm, para poder preparar las disoluciones puede considerarse
que aproximadamente εmax= 5x105. Repetir el espectro agregando una gota de base (por ejemplo
B B P P
trietilamina) a una alícuota de la disolución de porfirina. Si no se observan diferencias con respecto
al primer espectro, repetirlo agregando ahora una gota de HCl concentrado a otra alícuota de
porfirina. Analizar los espectros de RMN-1H, RMN-13C, IR, EM y la serie de espectros de UV/Vis a P P P P
diferente concentración (1x10-4 – 1x10-7 M) que le proporcionará su profesor.
P P P P
Preparación de los complejos metálicos de la 5,10,15,20-tetrafenilporfirina (MTPP). Se calienta
a ebullición 10 mL de DMF en un matraz bola de 50 mL acoplado a un refrigerante Liebig y
agitación magnética. Agregar 100 mg de TPP y 100 mg de acetato metálico (Co(II), Cu(II), Mn(II) y
Zn(II)). El calentamiento se mantiene a reflujo durante 10 minutos, después se enfría en un baño de
hielo durante 15 minutos y se diluye con 120 mL de agua fría. Se filtra al vacío y el precipitado se
lava con agua fría y se seca al vacío. Calcular el rendimiento de la reacción y caracterizar el
producto por cromatografía en capa fina (SiO2, CH2Cl2) y por espectroscopia de UV/Vis en CH2Cl2. B B B B B B B B B B
Determinar el valor de ε para cada uno de los máximos de absorción que aparecen entre 350 y 750
nm, para preparar las disoluciones puede considerar que aproximadamente εmax = 8x105. Repetir el B B P P
espectro agregando 3 gotas de base (trietilamina) a una alícuota de la disolución de la porfirina. Si
no se observan diferencias con respecto al primer espectro, repetirlo agregando ahora una gota de
disolución diluida de H2SO4 a otra alícuota de porfirina. Analizar los espectros de RMN-1H, RMN-
B B B B P P
13
P C, IR, EM y la serie de espectros de UV/Vis a diferente concentración (1x10-4 – 1x10-7 M) que le
P P P P P
proporcionará su profesor.
Discusión de Resultados.
Los reactivos y disolventes utilizados en esta práctica no requieren de cuidados especiales, sin
embargo es conveniente que el pirrol y el benzaldehído se destilen previamente y el experimento se
realice con buena ventilación, bata y lentes de seguridad.
La preparación de porfirinas meso-tetrafenil sustituidas a partir de la condensación de un aldehído y
pirrol y su posterior oxidación se realiza utilizando un proceso de “un solo paso” con reflujo de 30
minutos en un sistema abierto y aislando la porfirina después de enfriar y filtrar la mezcla de
reacción. Los rendimientos que se obtienen son del 20-30%, no son muy cuantitativos, pero esto
depende de que tan hábil sea el alumno al realizar la práctica. Sin embargo, se logra obtener la
cantidad suficiente de TPP para poder realizar la reacción de metalación.
Para preparar las metaloporfirinas se utilizan las sales metálicas (los acetatos respectivos) en un
disolvente orgánico y a temperaturas de reflujo. El aspecto más útil de esta reacción de metalación
radica en su simplicidad, que facilita la separación de un gran exceso de la sal metálica, necesaria en
los procedimientos convencionales de metalación y en los cuales usualmente es necesario separar el
producto de metalación por repetidas precipitaciones, por diálisis o por cromatografía en columna.
Los rendimientos que se obtienen para esta reacción oscilan entre el 80 y 90%.
El análisis de los espectros de RMN-1H, RMN-13C, IR, EM y UV/Vis permiten al alumno P P P P
caracterizar los productos obtenidos y familiarizarse con el uso de los métodos normales de
caracterización. Además, la comparación y el análisis de los espectros de UV/Vis, en medio neutro,
básico y ácido y a diferentes concentraciones, permiten explicar las diferencias que existen entre las
porfirinas en forma de base libre y las porfirinas metaladas. Además, a partir de una cierta
concentración (1x10-5 M) dan un indicio de la presencia de nuevas especies en disolución al
P P
Vol. XVIII, No 2, 2006
142
observarse nuevas bandas de absorción y/o el desplazamiento de las bandas observadas a
concentraciones bajas, debido a la formación de agregados tipo H de las porfirinas.
Conclusiones.
La preparación del macrociclo de porfirina (TPP y las diferentes MTPP) por condensación de
benzaldehído y pirrol con la posterior metalación con el acetato correspondiente y junto con el
análisis de los espectros de los productos obtenidos es un excelente experimento para realizarlo en
los laboratorios de química orgánica heterocíclica. Los estudiantes adquieren experiencia práctica al
trabajar con cantidades a microescala y obtienen moléculas complejas a partir de reactivos sencillos.
Además, la amplia variedad y fácil manipulación de los aldehídos puede permitir disponer de
diversas porfirinas sin la necesidad de síntesis largas para obtener precursores sintéticos y los grupos
funcionales incorporados en el aldehído utilizado amplían el uso de las porfirinas en nuevas
estrategias sintéticas.
Bibliografía.
1. J. Seth, V. Palaniappan, T. E. Johnson, S. Prathapan, J. S. Lindsey, D. F. Bocian. “Investigation
of electronic communication in multi-porphyrin light-harvesting arrays”. J. Am. Chem. Soc.
116/23: 10578-10592 (1994).
2. R. Bonnett. “Photosensitizers of the porphyrin and phthalocyanine series for photodynamic
therapy”. Chem. Soc. Rev. 24/1: 19-33 (1995).
3. Y. Harima, H. Okazaki, Y. Kunugi, K. Yamashita. “Formation of Schottky barriers at interfaces
between metals and molecular semiconductors of p- and n-type conductances”. Appl. Phys. Lett.
69/8: 1059-1061 (1996).
4. a) T. J. Dougherty. Advances in Photochemistry. D. H. Volmar, G. S. Hammnond and D. C.
Neckers Eds., Wiley, New York, p. 275 (1992). b) F. Ricchelli, S. Gobbo, G. Moreno, C. Salet,
L. Brancaleon, A. Mazzini. “Photophysical properties of porphyrin planar aggregates in
liposomes”. Eur. J. Biochem. 253/3: 760-765 (1998).
5. J. M. Ribó, J. Crusats, F. Sagues, J. Claret, R. Rubires. “Chiral sign induction by vortices during
the formation of mesophases in stirred solutions”. Science 292/5524: 2063-2066 (2001).
6. a) Porphyrin Handbook, Vol. 1-10. K. M. Kadish, K. M. Smith and R. Guilard Eds., Academic
Press, San Diego (2000). b) L. R. Milgrom. The Colours of Life –An Introduction to the
Chemistry of Porphyrins and Related Compounds. Oxford University Press, Oxford (1997).
7. A. J. F. N. Sobral. “Synthesis of meso-octamethylporphyrinogen: An undergraduate laboratory
mini-scale experiment in organic heterocyclic chemistry”. J. Chem. Educ. 82/4: 618-619 (2005).
Vol. XVIII, No 2, 2006
143
S-ar putea să vă placă și
- Ejercicios PiridinasDocument17 paginiEjercicios PiridinasCamila Florido FajardoÎncă nu există evaluări
- MicrobiologiaDocument11 paginiMicrobiologiaCamila Florido FajardoÎncă nu există evaluări
- Preguntas de PruebasDocument2 paginiPreguntas de PruebasCamila Florido FajardoÎncă nu există evaluări
- Guia Ejercicios RetrosintesisDocument3 paginiGuia Ejercicios RetrosintesisCamila Florido FajardoÎncă nu există evaluări
- MicrobiologiaDocument11 paginiMicrobiologiaCamila Florido FajardoÎncă nu există evaluări
- Seriequimicaheterociclica 11541Document12 paginiSeriequimicaheterociclica 11541Anibal Izak Vazkez KamarenahÎncă nu există evaluări
- Laboratorio PrecipitacionDocument7 paginiLaboratorio PrecipitacionCamila Florido FajardoÎncă nu există evaluări
- Química Orgánica - Tercero de BachilleratoDocument13 paginiQuímica Orgánica - Tercero de BachilleratoPotato Pato100% (1)
- Accion Enzimatica de La CatalasaDocument8 paginiAccion Enzimatica de La CatalasaclaudioÎncă nu există evaluări
- Biologia UNAGDocument4 paginiBiologia UNAGCarlos MolinaÎncă nu există evaluări
- Orga Ultimo ReporteDocument3 paginiOrga Ultimo ReporteosmairynÎncă nu există evaluări
- TAREA Metodos de Prueba Vino Tinto Laura MéndezDocument4 paginiTAREA Metodos de Prueba Vino Tinto Laura MéndezDianaÎncă nu există evaluări
- Arrastre Por Vapor PrevioDocument7 paginiArrastre Por Vapor Previoaxel martinezÎncă nu există evaluări
- TD TR121 - SpanishDocument2 paginiTD TR121 - SpanishLuis Garcia MÎncă nu există evaluări
- Preguntas PAU NúcleoDocument5 paginiPreguntas PAU NúcleoPilar HidalgoÎncă nu există evaluări
- Proceso de HalogenaciónDocument6 paginiProceso de HalogenaciónJuan Cubillos100% (1)
- DESINFECCIÓNDocument7 paginiDESINFECCIÓNkatia cisneros palmaÎncă nu există evaluări
- Cartel Practica 2Document1 paginăCartel Practica 2Jonathan MartínezÎncă nu există evaluări
- Seminario de Mecanismos IDocument4 paginiSeminario de Mecanismos Itere_figueroaÎncă nu există evaluări
- ADN Original. Revista C. Cuántica-Edicion JULIO 2021 ESDocument96 paginiADN Original. Revista C. Cuántica-Edicion JULIO 2021 ESPerla Acosta100% (1)
- TESIS Aprov de Residuos Agricolas de Banano para Obtener NanocelulosaDocument77 paginiTESIS Aprov de Residuos Agricolas de Banano para Obtener NanocelulosaLuz Vera SilvaÎncă nu există evaluări
- Estereoquímica PDFDocument16 paginiEstereoquímica PDFEvelyn Paguay CarrilloÎncă nu există evaluări
- Coloración Del Cabello (VII) - Coloración Permanente (1 Parte)Document2 paginiColoración Del Cabello (VII) - Coloración Permanente (1 Parte)Rojas Evert Alonso100% (1)
- 1111 Informe CiclohexenoDocument5 pagini1111 Informe Ciclohexenokarol burbanoÎncă nu există evaluări
- Hoja de Seguridad EtanolDocument3 paginiHoja de Seguridad EtanolMaribel Ramos MolinaÎncă nu există evaluări
- Cuestionario de RepasoDocument6 paginiCuestionario de RepasoDANIELA GELVEZÎncă nu există evaluări
- Glosario de BOTANICADocument23 paginiGlosario de BOTANICARami JuarezÎncă nu există evaluări
- Aminoácidos en BovinosDocument34 paginiAminoácidos en BovinosEfrén Flores PicosÎncă nu există evaluări
- Manual de Peleteria y CurtiembreDocument12 paginiManual de Peleteria y CurtiembreJeniffer Moreira GarcésÎncă nu există evaluări
- Analisis de Frutas y Hortalizas - Presentacion 15 SepDocument9 paginiAnalisis de Frutas y Hortalizas - Presentacion 15 SepAnna Linda AlcalaÎncă nu există evaluări
- Bebidas No CongenéricasDocument4 paginiBebidas No CongenéricasJessica Bogarin SalinasÎncă nu există evaluări
- Consignas de BioquimicaDocument8 paginiConsignas de Bioquimicaapi-257767200Încă nu există evaluări
- Traducción: El Cromosoma Eucariótico PDFDocument3 paginiTraducción: El Cromosoma Eucariótico PDFVictor Hugo Díaz SandovalÎncă nu există evaluări
- Proyecto de Biologia CabelloDocument30 paginiProyecto de Biologia CabellojuanacristinaÎncă nu există evaluări
- Alcoholes. Parte IIDocument33 paginiAlcoholes. Parte IIMarvin 'RmirezÎncă nu există evaluări
- Modulo de Quimica OrganicaDocument18 paginiModulo de Quimica OrganicaSiulFranciscoOzarazilZerreitugÎncă nu există evaluări
- Quimica 4 Periodo 11°Document5 paginiQuimica 4 Periodo 11°mariaÎncă nu există evaluări