Documente Academic
Documente Profesional
Documente Cultură
Discus I Ones
Încărcat de
Chris GuzmanTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Discus I Ones
Încărcat de
Chris GuzmanDrepturi de autor:
Formate disponibile
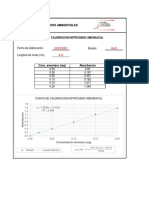
GRUPO A [FUENTE DE SUSTRATO SACAROSA]
SACAROSA
N° ABS 540 nm
(2g/l)
1 4 0.804
2 3.5 0.659
3 3 0.594
4 2.5 0.509
5 2 0.322
6 1.5 0.253
7 1 0.168
8 0 0
TABLA Nº 01- CURVA DE CALIBRADO DNS
DNS y = 0.2029x - 0.0302
R² = 0.9876
0.9
0.8
0.7
0.6
ABSORBANCIA
0.5
0.4
0.3
0.2
0.1
0
-0.1 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5
CONCENTRACION
GRAFICA Nº 01: CURVA DE CALIBRADO DEL DNS
Abs 640nm X (g/L)
0 0.000
0.081 0.053
0.143 0.094
0.222 0.147
0.439 0.290
0.579 0.382
0.829 0.547
0.957 0.632
TABLA Nº 02- CURVA DE CALIBRADO D.O.S cerevisiae
Subgrupo A-1
1.600 Concentracion Celular Sustrato 7.00
1.400 6.00
1.200
5.00
1.000
4.00
X (G/L)
S (G/L)
0.800
3.00
0.600
2.00
0.400
0.200 1.00
0.000 0.00
0 2 4 6 8 10 12 14
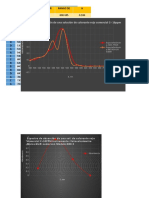
GRAFICA Nº 03 Crecimiento cinético y consumo del sustrato con Saccharomyces
cerevisiae ATCC 4126 utilizando sacarosa como fuente de carbono.
Linealidad de cinetica de crecimiento Ln(X/Xo)
1
0.8 y = 0.1228x - 0.5955
0.6 R² = 0.9938
0.4
0.2
0
-0.2 0 1 2 3 5 6 7 8 9 11 13
-0.4
-0.6
Ln/X/Xo) Linear (Ln/X/Xo))
GRAFICA Nº 04 Curva del crecimiento celular con los puntos lineales para
determinar el umax con Saccharomyces cerevisiae ATCC 4126 utilizando
sacarosa como fuente de carbono.
Y x/s (g/g) Umax (h-1) Qx ( g/h)
0.206002 0.1228 0.09515052
GRAFICA Nº 05: Obtención de etanol en el vial 4, de acuerdo al cromatógrafo.
DISCUSIONES
En la curva de consumo de sustrato en el subgrupo A1, se observa que en el
transcurso de las cinco primeras horas de fermentación existe una fase de
latencia(Lag), subgrupo A2, se observa las siete primeras horas de fermentación
existe una fase de latencia(Lag), y en el subgrupo A3, se observa las 5 primeras
horas de fermentación existe una fase de latencia(Lag) cual indica el periodo de
adaptación del microorganismo hacia el medio. En donde el crecimiento es bajo.
Debido a la transferencia del inoculo al nuevo medio, este puede verse afectado
por cambios de pH, aumento en el suministro de nutrientes y descenso en los
inhibidores de crecimiento. Por ende, decimos que el subgrupo A1 tuvo menos
crecimiento microbiano en la fase Lag en un tiempo de siete horas.
Posterior a esta etapa se inicia el crecimiento exponencial de biomasa, el
cual se desarrolla de manera constante hasta la concentración de
1.395g/L en el subgrupo A1, 1.601g/L en el subgrupo A2 y 2,198 g/L en el
subgrupo A3, esperando que esta siga desarrollando su crecimiento, sin
embargo, hay que tomar en cuenta que, si se observa un descenso
durante el crecimiento microbiano, indica de la ausencia de sustrato. A su
vez, ello indica el ingreso a la etapa de decaimiento, careciendo de la zona
estacionaria. A pesar de ello, se obtiene nuevamente un aumento de
biomasa, considerándose el anterior una toma de muestra errónea;
debido a que en ese tiempo aún se cuenta con sustrato por lo que debe
continuar crecimiento.
En la etapa de crecimiento exponencial, la velocidad de crecimiento es
máxima y el tiempo de generación es mínimo. En esta fase el crecimiento
permanece constante. El crecimiento de las células se puede describir
cuantitativamente como la duplicación del número de células o biomasa
por unidad de tiempo. A través de esta fase las células alteran el medio
constante tomando los sustratos y excretando los productos
metabolizados. La velocidad de crecimiento es independiente de la
concentración de sustrato mientras exista sustrato en el medio. Durante
esta fase las bacterias consumen a velocidad máxima los nutrientes del
medio (Duarte, 1998) (1).
La fase estacionaria que no se dio en nuestro caso por falta de tiempo,
ocurre cuando se agota una sustancia nutritiva y el sustrato se ha
metabolizado, cuando se han formado sustancias tóxicas o ha ocurrido un
cambio de condiciones como el pH, temperatura, y concentración de
oxígeno disuelto.
A su vez, en la figura N°1 se observa que la cinética de consumo de
glucosa se encuentra en función a la velocidad de crecimiento de la
Saccharomyces Cerevisiae ATCC 4126, tal es así que se muestra el
consumo de sustrato en el medio de fermentación; que comienza con una
caída lentamente en la primera hora, motivo por el cual anteriormente se
observó una fase de latencia en el crecimiento celular.
El descenso de la concentración de sustrato, es un indicador de que la
fuente de carbono es destinada a la formación de productos o a la
manutención de las células para su respiración.
Por otro lado, sabemos que las condiciones de máximo crecimiento de
biomasa para nuestra experiencia son de 2 g/L, en base al cual fue
diseñado nuestro medio, dando como resultado una concentración menor
de 1.395g/L(A1) y 1.601g/L(A2), esto se debe a que existió menor
cantidad de sustrato; sin embargo, en el subgrupo A3 no se consiguió
dicha concentración final, ya que este sobrepasó (2.198g/L), esto se debe
a que existió mayor cantidad de sustrato inicial.
Se estudió la conversión de sacarosa en etanol por Saccharomyces
Cerevisiae ATCC 4126. Se evaluó el medio de fermentación compuesto por
MgSO4 · 7H2O, extracto de levadura, (NH4)2SO4, KH2PO4 y solución de
sales a un pH de 4.5. Se obtuvo el valor de µmáx de 0.2582 h-1 muy por debajo
del valor teórico µmáx 0.3 h-1, este valor se debe a una baja concentración de
sustrato inicial, debido a la influencia de los demás nutrientes que aportan
más fuente de carbono al medio.
Con respecto a la productividad se determinó un Qx= 0.797 g/L.h,
relativamente alto comparado con la productividad de las otras mezclas. Esto
debido a una alta concentración celular (biomasa).
- Condiciones de aireación
Muchos microorganismos, tanto levaduras como bacterias, crecen en
condiciones anaeróbicas y el oxígeno en exceso tiene un efecto negativo
sobre la producción de etanol. En las bacterias, por ejemplo, la aireación
induce la producción de subproductos incluyendo acetatos, acetaldehídos
y lactatos, además, el oxígeno tiene un efecto inhibitorio sobre el consumo
de sustrato y el crecimiento microbiano. A bajas concentraciones de
sustrato, las velocidades de crecimiento y el rendimiento de biomasa son
independientes de la presencia de oxígeno. De forma opuesta, a altas
concentraciones de sustrato, decrecen los parámetros de crecimiento.
Chandraraj, K. et al. (2004) (2)
Según Brock, T. & Madigan, M., 1993 nos dice que: El pH es un factor
importante en la fermentación, debido a su importancia en el control de la
contaminación bacterial como también al efecto en el crecimiento de las
levaduras, en la velocidad de fermentación y en la formación de alcohol. Durante
la fermentación la levadura toma el nitrógeno de los aminoácidos orgánicos,
perdiendo su carácter anfótero y pasando a ácidos, lo cual origina una
disminución del pH del medio. Cuanto más bajo el pH del medio, tanto menor el
peligro de infección, pero si se trabaja con pH muy bajos la fermentación es muy
lenta, ya que la levadura no se desarrolla de la forma conveniente.
Producción de etanol
Para los ensayos de producción de etanol, se adquirió muestras de
sobrenadante del caldo fermentado, a distintas horas de cinética de
fermentación, centrifugadas a 4000 rpm por 15 minutos, reservadas en
viales enumerados según la hora de cinética. Se procedió a la lectura en el
cromatógrafo de gases, previamente filtradas con un microfiltro
conteniendo 1ml de muestra para el análisis.
El factor de rendimiento de etanol (YP/S, g / g) se calculó mediante la
relación entre la concentración de etanol (g/L) y el sustrato (sacarosa)
consumida (g /L). La productividad volumétrica de etanol (QP, g /Lh) se
definió por la relación entre la concentración máxima de etanol (g /L) y el
tiempo de fermentación respectivo (h).
- En la determinación de etanol, el cromatógrafo de gases detectó, que
el subgrupo A1, la muestra contenida en el vial 4 una concentración
de 0.051 g/L de etanol y en subgrupo A3, la muestra contenida en el
vial 9 una concentración de 0.044g/L. Asumimos que tales resultados
se deben a la agitación del medio de fermentación, ya que después
del sembrado la velocidad de agitación fue 150 rpm y 250 rpm
(durante 10 horas) ambos a temperatura de 30ºC. La disminución de
producción de etanol en el cultivo Saccharomyces Cerevisiae ATCC
4126 se debe al efecto del oxígeno incorporado al medio durante la
agitación (aireación), esto explica el comportamiento de la que
prefiere oxidar la sacarosa en presencia de oxígeno (para su
respiración celular) antes que fermentarla. Entonces, para casos
prácticos la producción de etanol podría ser controlado mediante la
tasa de aireación.
- Debido a que la levadura sintetiza el sustrato para dos afines:
respiración y fermentación, el etanol generado se debería a una baja
actividad de las enzimas respiratorias (especialmente la piruvato
deshidrogenasa, acetaldehído deshidrogenasa y la acetil-CoA
sintetasa) como resultado de la limitación de oxígeno en el medio,
entonces se asume que las muestras contenidas en los viales 4 y 9,
correspondientes a las horas respectivas de 4 y 9 después de la
activación del medio, presentaban más contenido de oxígeno que el
vial 10 (relacionado a 10 horas de cinética celular) produciendo
crecimiento celular en lugar del producto; del cual también se observa
la influencia del tiempo en la producción de etanol.
Según Nagodawithana & Steinkraus (1976)3, la tolerancia al etanol
depende de la habilidad de la célula de levadura para exportar el
etanol producido hacia el exterior, un proceso que depende de la
composición y fluidez de la membrana citoplasmática del
microorganismo.
Un factor importante a considerar en el cultivo de Saccharomyces cerevisiae es la
aireación de medio de cultivo. En condiciones anaerobias, sin embargo, el crecimiento es
lento y el piruvato producido durante el catabolismo es procesado por la piruvato
descarboxilasa a acetaldehido y CO2. Se produce entonces etanol a partir de acetaldehido
mediante la reducción por la alcohol deshidrogenasa. Los sistemas discontinuos para la
producción de etanol se inician aeróbicamente para obtener la máxima biomasa, ya que
si las condiciones anaerobias comienzan demasiado pronto la densidad de la población
no será lo suficientemente alta para obtener una velocidad de conversión. Puede ser
incluso necesaria la aireación forzada durante un tiempo corto a fin de evitar pérdidas de
rendimiento.
BIBLIOGRAFIA
1. Duarte, 1998. Microbiología Industrial. Editor EUNED. Pág. 50
2. Chandraraj K, Gunasekaran P (2004) Bacterial alcoholic
fermentation. In: Ashok P. (ed) concise encyclopedia of bioresource
technology. Food Products Press, New York.
3. Gupta A. & G.A. Rao. 2003. Study of oxygen transfer in shake
flasks using a non-invasive oxygen sensor. Biotechnology and
Bioengineering, 84(3): 351–358.
4. Nikakhtari H. & G. Hill. 2006. Closure effects on oxygen transfer
and aerobic growth in shake flasks. Biotechnology and
Bioengineering, 95(1): 15–21.
5. Nagodawithana T.W. & K. Steinkraus. 1976. Influence of the rate
ethanol production and accumulation on the viability of
Saccharomyces cerevisiae in rapid fermentation. Applied and
Environmental Microbiology, 31: 158–162.
6. Hansen E.H., P. Nissen, P. Sommer, et al. 2001. The effect of
oxygen on the survival of non-Saccharomyces yeasts during mixed
culture fermentations of grape juice with Saccharomyces
cerevisiae. Journal of Applied Microbiology, 91: 541–547.
7. Quintero R., Rodolfo. (1981). Ingeniería bioquímica. México 13,
D.F.: Editorial Alhambra Mexicana. (Biblioteca central, UNS)
S-ar putea să vă placă și
- MONOGRAFIA MermeladaDocument29 paginiMONOGRAFIA MermeladaChris Guzman100% (2)
- Informe 1Document12 paginiInforme 1ZENAIDA ALEXANDRA CCAMA CCAHUANAÎncă nu există evaluări
- Examen Parcial de Laboratorio de Fisicoquimica 2, Adrian QuispeDocument7 paginiExamen Parcial de Laboratorio de Fisicoquimica 2, Adrian QuispeAdrian QuispeÎncă nu există evaluări
- Cinetica 9Document9 paginiCinetica 9GiovanniÎncă nu există evaluări
- Práctica 1 - Lab. Instrumental FotometriaDocument7 paginiPráctica 1 - Lab. Instrumental FotometriaAnny Hieraldyn Guapacha CastroÎncă nu există evaluări
- Hierro DiegoDocument10 paginiHierro Diegoharold diazÎncă nu există evaluări
- Lab Quimica Clinica Curvas Calibración y ConcentraciónDocument6 paginiLab Quimica Clinica Curvas Calibración y ConcentraciónJaime LoyolaÎncă nu există evaluări
- Practica SISTEMA MULTIPLEDocument5 paginiPractica SISTEMA MULTIPLEGoOfysS FLGÎncă nu există evaluări
- Práctica Semana 3 Ingeniería de Bioprocesos Grupo FDocument2 paginiPráctica Semana 3 Ingeniería de Bioprocesos Grupo FRoden SeisÎncă nu există evaluări
- Practica #4 TerminadoDocument6 paginiPractica #4 Terminadomarco antonioÎncă nu există evaluări
- 01 - Datos ExperimentalesDocument17 pagini01 - Datos Experimentalesalejandro vidal sanclementeÎncă nu există evaluări
- DETERMINACION ESPECTROFOTOMETRICA DE Fe (II)Document10 paginiDETERMINACION ESPECTROFOTOMETRICA DE Fe (II)EMERSONÎncă nu există evaluări
- Ejercicio InyeccionDocument18 paginiEjercicio InyeccionRaul Guzman SasariÎncă nu există evaluări
- Cinetica 9Document9 paginiCinetica 9jonathan H.Încă nu există evaluări
- Balance de Prueba en BotellaDocument2 paginiBalance de Prueba en Botellagsefferson pavel marin lpezÎncă nu există evaluări
- Calculo Sismo Resistente EtabsDocument9 paginiCalculo Sismo Resistente EtabsRaul Arroyo PalaciosÎncă nu există evaluări
- Actividad 3Document3 paginiActividad 3Eduardo SalazarÎncă nu există evaluări
- Determinacion de FosforoDocument10 paginiDeterminacion de FosforoCamila Jackelyne ApazaÎncă nu există evaluări
- Curso Espectroscopia ClasesDocument12 paginiCurso Espectroscopia ClasesJESSICA NATALIA VARGAS GOMEZÎncă nu există evaluări
- Practica 4. ABTDocument10 paginiPractica 4. ABTIsa Fernández BedoyaÎncă nu există evaluări
- Ejercicio AplicativoDocument3 paginiEjercicio Aplicativomartin lopezÎncă nu există evaluări
- NCh433 1729Document9 paginiNCh433 1729Domingo Alfonso Nuñez VieitesÎncă nu există evaluări
- Resultados de RefractometriaDocument6 paginiResultados de RefractometriakathrinÎncă nu există evaluări
- P1. Metodos de AnalisisDocument7 paginiP1. Metodos de AnalisisJavier PinedaÎncă nu există evaluări
- Gráfica 3 Espectro de Absorción de La Solución de Sulfato de Níquel Al 20%Document3 paginiGráfica 3 Espectro de Absorción de La Solución de Sulfato de Níquel Al 20%Irving PinedaÎncă nu există evaluări
- Deber EorDocument6 paginiDeber EorEdison LduÎncă nu există evaluări
- Asig. N°2Document13 paginiAsig. N°2HILARIO JUNIOR CACERES MEDINAÎncă nu există evaluări
- Taller Quimiometria 1.2Document13 paginiTaller Quimiometria 1.2BlasÎncă nu există evaluări
- Curva Nitrogeno AmoniacalDocument1 paginăCurva Nitrogeno AmoniacalSantiago SuarezÎncă nu există evaluări
- Sistema MultipleDocument8 paginiSistema MultipleAndy ChÎncă nu există evaluări
- Informe #4 AnalisisDocument6 paginiInforme #4 AnalisisSAYRA SCHMITT SÁNCHEZ PEÑAÎncă nu există evaluări
- Bioprocesos Tarea 4Document19 paginiBioprocesos Tarea 4camoÎncă nu există evaluări
- Diseño Resistividad VillaranDocument10 paginiDiseño Resistividad VillaranRemy Castañeda RamosÎncă nu există evaluări
- Informes de Analisis Juan YallerccoDocument34 paginiInformes de Analisis Juan Yallerccotransportesrosa2020Încă nu există evaluări
- A6, Curvas de Absorción Por EspectrofotometríaDocument5 paginiA6, Curvas de Absorción Por EspectrofotometríaSARAHI V. PEREZ LUISÎncă nu există evaluări
- Absorcion Atomica. Hierro en Multivitaminico.Document11 paginiAbsorcion Atomica. Hierro en Multivitaminico.Verónica MartínezÎncă nu există evaluări
- Determinacion de Colorante en Bebida PDFDocument5 paginiDeterminacion de Colorante en Bebida PDFAndrea Arboleda MonsalveÎncă nu există evaluări
- Taller de 2016Document13 paginiTaller de 2016paolaÎncă nu există evaluări
- Actividad 8Document6 paginiActividad 8Crisman Llamo TantaleanÎncă nu există evaluări
- Determinación Espectrofotométrica de Azul de Timol Mediante Curva de Calibración de Estándar ExternoDocument12 paginiDeterminación Espectrofotométrica de Azul de Timol Mediante Curva de Calibración de Estándar ExternoBrenda KarenÎncă nu există evaluări
- Eercicios AASDocument18 paginiEercicios AASAbel PachecoÎncă nu există evaluări
- Informe Instrumental (1) 2020Document17 paginiInforme Instrumental (1) 2020Luis Espinoza PortuguezÎncă nu există evaluări
- DETERMINACION DE HIERRO EN MEDICAMENTOS Final PDFDocument6 paginiDETERMINACION DE HIERRO EN MEDICAMENTOS Final PDFAndrea Arboleda MonsalveÎncă nu există evaluări
- Metodos, Practica EspectrofotometroDocument4 paginiMetodos, Practica EspectrofotometroKevin EjsmÎncă nu există evaluări
- Informe N6 Estabilidad Térmica de EnzimasDocument7 paginiInforme N6 Estabilidad Térmica de EnzimasVanessa PerezÎncă nu există evaluări
- Curvas de CalibraciónDocument3 paginiCurvas de CalibraciónMilagros Berenice Toga MedinaÎncă nu există evaluări
- Graficas DestilacionDocument13 paginiGraficas DestilacionJuan Sebastian Orozco GomezÎncă nu există evaluări
- Calculos, Tablas y GraficasDocument11 paginiCalculos, Tablas y GraficasReymundo SeguraÎncă nu există evaluări
- Fact. Que Afectan Un Metodo EspectofotometricoDocument11 paginiFact. Que Afectan Un Metodo EspectofotometricoReymundo SeguraÎncă nu există evaluări
- Examen 3 Cinetica GeoDocument10 paginiExamen 3 Cinetica GeoRicardo RondonÎncă nu există evaluări
- Analisis Espectrofométrico Simultáneo de Dos Componentes en Una MezclaDocument19 paginiAnalisis Espectrofométrico Simultáneo de Dos Componentes en Una MezclaSergio Luis Rivero TrujilloÎncă nu există evaluări
- Ejercicio ParcialDocument15 paginiEjercicio ParcialJoansalome CampañaÎncă nu există evaluări
- Ejercicios de Ajuste de CurvasDocument3 paginiEjercicios de Ajuste de CurvasMiroslav Alulema CuestaÎncă nu există evaluări
- Método de AndrewsDocument3 paginiMétodo de AndrewsRicardo LòpezÎncă nu există evaluări
- Nec EspectroDocument11 paginiNec EspectroCristian GonzalezÎncă nu există evaluări
- Ejercicios de Ajustes de CurvasDocument3 paginiEjercicios de Ajustes de CurvasAna Arias TorresÎncă nu există evaluări
- Matriz de Confusion TeledeteccionDocument20 paginiMatriz de Confusion TeledeteccionCarlo ZapataÎncă nu există evaluări
- 1 - 1 Anexo Agua Potable GenesisDocument26 pagini1 - 1 Anexo Agua Potable GenesisDiego Armando Aponte LeandroÎncă nu există evaluări
- Practica ResueltaDocument12 paginiPractica ResueltaSTEVEN FERNANDO NICOLAS CERONÎncă nu există evaluări
- Cinetica Enzimatica 3Document3 paginiCinetica Enzimatica 3Massiel Marley LOPEZ RODRIGUEZÎncă nu există evaluări
- Comercialización de La Papa (Solanum Tuberosum L.) en Dos Comunidades Del Distrito de San Jerónimo de AndahuaylasDocument84 paginiComercialización de La Papa (Solanum Tuberosum L.) en Dos Comunidades Del Distrito de San Jerónimo de AndahuaylasChris GuzmanÎncă nu există evaluări
- Analisis Sensorial Guia 01Document1 paginăAnalisis Sensorial Guia 01Chris GuzmanÎncă nu există evaluări
- Scielo - Almidon de PapaDocument18 paginiScielo - Almidon de PapaChris GuzmanÎncă nu există evaluări
- HACCPDocument4 paginiHACCPChris GuzmanÎncă nu există evaluări
- Insuficiencia Renal Aguda y CrónicaDocument6 paginiInsuficiencia Renal Aguda y CrónicaChris GuzmanÎncă nu există evaluări
- Cereales INFORMEDocument30 paginiCereales INFORMEChris GuzmanÎncă nu există evaluări
- Semana 10 Analisis SensorialDocument9 paginiSemana 10 Analisis SensorialChris GuzmanÎncă nu există evaluări
- Elaboracion de Cerveza Artesanal Red Ale Tipo PilsenDocument2 paginiElaboracion de Cerveza Artesanal Red Ale Tipo PilsenChris Guzman100% (1)
- MermeladaDocument7 paginiMermeladaChris GuzmanÎncă nu există evaluări
- Florez Jalixto Marco AntonioDocument108 paginiFlorez Jalixto Marco AntonioChris GuzmanÎncă nu există evaluări
- FresaDocument26 paginiFresaChris Guzman100% (2)
- Practica N 06Document3 paginiPractica N 06Chris GuzmanÎncă nu există evaluări
- Practica N 04 PDFDocument5 paginiPractica N 04 PDFChris GuzmanÎncă nu există evaluări
- Informe de Aplicación de La Ley de Beer-LambertDocument9 paginiInforme de Aplicación de La Ley de Beer-LambertEsteban MalamboÎncă nu există evaluări
- INFORME 3 Preparacion de SolucionesDocument13 paginiINFORME 3 Preparacion de Solucionesdaniela valencia amadoÎncă nu există evaluări
- Guia Quimica Analitica Ii FBDocument70 paginiGuia Quimica Analitica Ii FBCristian CamposÎncă nu există evaluări
- GuiaunidadesfísicasguiaDocument1 paginăGuiaunidadesfísicasguiaCristian DuránÎncă nu există evaluări
- Ejemplo Resuelto AbsorciónDocument10 paginiEjemplo Resuelto AbsorciónHenry Daniel CukierÎncă nu există evaluări
- Titulacion QuimicaDocument2 paginiTitulacion QuimicaRosa SatoÎncă nu există evaluări
- Ejercicios Resueltos. Unidad 5 - QuímicaDocument4 paginiEjercicios Resueltos. Unidad 5 - QuímicaRamiro ReinaldoÎncă nu există evaluări
- Ultimo Lab oDocument12 paginiUltimo Lab oAlvaro Espinoza Torres100% (1)
- Guia de Ejercicios 6 - Qui1105Document2 paginiGuia de Ejercicios 6 - Qui1105PATRICIO MORONI SOLAR DIAZÎncă nu există evaluări
- Factores Que Afectan La Estabilizacion de Farmacos en DisoluciónDocument16 paginiFactores Que Afectan La Estabilizacion de Farmacos en DisoluciónabriljimzÎncă nu există evaluări
- Informe N°2Document18 paginiInforme N°2KASSANDRA NAYELI FLORES COAQUIRAÎncă nu există evaluări
- Metodo de Calibración Sencilla o Estándar Externo by Antrackz!Document11 paginiMetodo de Calibración Sencilla o Estándar Externo by Antrackz!Rikardo Guerrero RobleroÎncă nu există evaluări
- Planiquimica 2ºDocument9 paginiPlaniquimica 2ºGeovanna Clemencia Velasco TulcanazaÎncă nu există evaluări
- 2020 10 28 22 04 46 1034576536 1006 Joseph Yael Mendieta Avila Laboratorio de Estequiometria y Soluciones QuimicasDocument10 pagini2020 10 28 22 04 46 1034576536 1006 Joseph Yael Mendieta Avila Laboratorio de Estequiometria y Soluciones QuimicasMARCOS GABRIEL GAMA SANTAMARIA100% (1)
- Encurtido de PepinillosDocument5 paginiEncurtido de PepinillosFlorencia Muñoz PrietoÎncă nu există evaluări
- Desarrollo Paso 2 FundamentaciónDocument6 paginiDesarrollo Paso 2 FundamentaciónAdriana MartinezÎncă nu există evaluări
- Recurso 6Document5 paginiRecurso 6Cesar Lenin Honores VásquezÎncă nu există evaluări
- Resumen Química (EAES)Document23 paginiResumen Química (EAES)Marcos EndaraÎncă nu există evaluări
- 1er Laboratorio de Físico Quimica MetalúrgicoDocument14 pagini1er Laboratorio de Físico Quimica MetalúrgicoBryan De La Cruz ArredondoÎncă nu există evaluări
- Practica 2 - Preparicon de Soluciones Valoradas y TitulacionDocument10 paginiPractica 2 - Preparicon de Soluciones Valoradas y TitulacionJhean Pierre FuentesÎncă nu există evaluări
- AnaliticaDocument124 paginiAnaliticaKevin EncarnacionÎncă nu există evaluări
- Guia de Laboratorio de Bioquimica-I. Editada Prof. CarrascoDocument28 paginiGuia de Laboratorio de Bioquimica-I. Editada Prof. CarrascoPedro AntonioÎncă nu există evaluări
- Valoraci Microbio VitaminasDocument17 paginiValoraci Microbio VitaminasMarco cuzcanoÎncă nu există evaluări
- Práctica 3 Determinación de La Constante Del Producto de Solubilidad Del Hidróxido de CalcioDocument9 paginiPráctica 3 Determinación de La Constante Del Producto de Solubilidad Del Hidróxido de CalcioSANDRA NAYELI PAGUAY TAIMALÎncă nu există evaluări
- Laboratorio 6. Calor Diferencial de SoluciónDocument11 paginiLaboratorio 6. Calor Diferencial de SoluciónDIAM 57Încă nu există evaluări
- P HDocument2 paginiP HYudith ContrerasÎncă nu există evaluări
- Nom 116 StpsDocument16 paginiNom 116 StpsAmerica ChavezÎncă nu există evaluări
- GravimetriaDocument17 paginiGravimetriaJuan TopoÎncă nu există evaluări
- 6 - Disoluciones II - Unidades Quimicas de Concentración y Dilución.Document21 pagini6 - Disoluciones II - Unidades Quimicas de Concentración y Dilución.jenyÎncă nu există evaluări
- Ejercicios Sobre SolucionesDocument6 paginiEjercicios Sobre SolucionescristinaÎncă nu există evaluări