Documente Academic
Documente Profesional
Documente Cultură
Informe de Laboratorio Práctica 2 Quimica General Espol
Încărcat de
Bryan Paul Ortiz ValarezoTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Informe de Laboratorio Práctica 2 Quimica General Espol
Încărcat de
Bryan Paul Ortiz ValarezoDrepturi de autor:
Formate disponibile
ESCUELA SUPERIOR POLITÉCTICA DEL LITORAL
Departamento de Ciencias Químicas y Ambientales
Laboratorio de Química General 1
Informe de Laboratorio N° 2
1. TEMA: Determinación de la Solubilidad de los Sólido.
2. MARCO TEÓRICO:
Previamente para la elaboración de la práctica de laboratorio se debe
conocer algunas definiciones. Algunas de las definiciones que representa es
la solubilidad, que es la capacidad física que posee una sustancia para poder
disolverse en otra. Se la representa en moles por litro, gramos por litro o
también en porcentaje de soluto. En general, para lograr hacer que el soluto
se disuelva se procede a calentar la muestra, con el fin, que la sustancia
llamada soluto se disuelva completamente en la sustancia donde se va a
disolver llamada disolvente.
Tenemos que conocer las concentraciones de soluto que diluimos en la
solución, se clasifican en concentradas, saturadas, sobre saturadas.
Una solución concentrada es la que contiene una cantidad parcialmente
grande del soluto, la solución diluida es la que contiene una cantidad
parcialmente pequeña del soluto.
Saturadas, son las que una disolución estás saturada a una definida
temperatura, es el momento que ya no admite más cantidad del soluto
diluido.
Sobresaturadas, una solución en estas condiciones contiene un exceso de
soluto con respecto a la cantidad que podría contener si se mantendría en
equilibrio, podemos decir que este sistema no es estable por la razón que no
se encuentra en equilibrio, se puede precipitar soluto al fondo del recipiente
donde estemos haciendo la mezcla, el equilibrio se suele establecer con
bastante rapidez cuando no hay un cristal en el que pueden adherirse
aquellos iones.
Factores que intervienen en la solubilidad:
Estructuras entre el soluto y disolvente, podemos hablar que una de ellas es
que, si ambas son polares, o apolares, no podemos mesclar una sustancia
polar con una apolar, tenemos el claro ejemplo del agua y el aceite. Si al
lograr mezclarse dos líquidos son miscibles ejemplo el agua y la acetona
constituyendo una mezcla homogénea y las que no se mezclan como lo
dijimos anteriormente son inmiscibles, también podemos mencionar que es
muy fundamental el tipo de fuerzas intermoleculares que intervienen en la
disolución, con lo cual le da propiedades a la misma.
Bryan Paúl Ortiz Valarezo Paralelo: 125
Presión, aquellos cambios de presión ordinarios no poseen mayor causa en
la solubilidad de los líquidos y de los sólidos, la solubilidad en gases es
directamente proporcional a la presión. Suponer que poseemos una
sustancia gaseosa repartida entre las fases gaseosa y disolución, en el
momento que entra en el equilibrio la rapidez con las que las moléculas de
dicho gas acceden en la disolución es igual a la rapidez con que moléculas
del soluto desaparecen de la disolución para acceder en la fase gaseosa.
Temperatura, este es un factor muy importante, porque al momento de
calentar la disolución aumentamos la rapidez y el grado de solubilidad por el
simple hecho a que favorece al incremento del movimiento de las moléculas
tanto del soluto como el del disolvente.
3. OBJETIVO GENERAL:
Establecer la solubilidad de una s ustancia sólida a distintas temperaturas
interviniendo una curva para reconocer los factores que predominan en la
solubilidad.
4. OBJETIVOS ESPECÍFICOS:
a) Implementar estrictamente las normas de seguridad de laboratorio.
b) Ensamblar y utilizar correctamente el sistema de evaporación, si tiene
alguna duda no dude en preguntar a la persona encargada.
c) Determinar correctamente las medidas para evitar futuros errores.
5. MATERIALES, REACTIVOS Y EQUIPOS:
Cápsula de porcelana.
Vaso de precipitación de 100 Ml y 1000 Ml.
Soporte universal.
Mechero de Bunsen.
Malla.
Aro de calentamiento.
Balanza analítica.
Reactivos (Nitrato de Potasio)
Equipos de Protección.
o Gafas.
o Guantes Térmicos.
Bryan Paúl Ortiz Valarezo Paralelo: 125
6. PROCEDIMIENTO:
Ya una vez que tengamos los materiales e instrumentos procederemos a
realizar la practica en los siguientes pasos.
1. Proceder a pesar una capsula de porcelana con exactitud + 0.1 g. Anotar
como M1
2. Introducir 10 Ml de agua en un vaso de precipitación de 100 Ml y
comenzar a añadir pequeñas cantidades de la muestra (sal) agitando,
hasta que ya no se disuelva.
3. Para preparar el ‘’Baño María’’ insertar el vaso de precipitación con la
solución en otro vaso de precipitación (de 1000 m L) que contenga agua
hasta las ¾ partes de su capacidad total. Asentar el sistema conformado
por ambos vasos y colocarlo sobre una malla de calentamiento, soportada
por un aro de calentamiento que está sujetado a un soporte universal.
4. Calentar con la ayuda del mechero Bunsen el vaso precipitado de 1000
ml hasta la temperatura indicada por el docente. Recuerde siempre
regular la intensidad de la llama del mechero, de manera que dicha
temperatura del baño se mantenga constante.
5. Ubicar un termómetro que registrará la temperatura del baño y con lo cual
procederá a añadir más soluto a la solución en el vaso precipitado de 100
ml. Continuar agregan soluto y agitar hasta que permanezca un exceso
visible en la solución, tomando en cuanta haber llegado a dicha
temperatura.
6. Apartar el vaso de precipitación con la solución del baño María, agitar
firmemente para verificar que el exceso no se disuelva, luego registrar la
temperatura que deberá corresponder a la asignada.
7. Vaciar rápidamente la parte líquida en la capsula de evaporación como
masa (M1), luego pesar el conjunto asignándolo con masa (M2).
8. Ubicar la capsula de evaporación con la solución adentro en la malla de
calentamiento calentando con la llama moderada hasta evaporar
completamente el solvente (agua), es decir, hasta que podamos observar
solamente el sólido. (soluto)
9. Mitigar la llama del mechero cuando el sólido empiece a fundirse, esperar
a que el sistema se enfríe por completo para proceder a pesar la capsula
de evaporación con el soluto, trasladando la capsula con la ayuda de la
pinza. Apuntar la nueva masa obtenida como (M3).
10. Ahora con los datos obtenidos, elaborar una curva de solubilidad:
Temperatura en (°C) vs, Solubilidad (g/100 g de agua).
Bryan Paúl Ortiz Valarezo Paralelo: 125
7. Resultados:
En lo siguiente se mostrarán todos los resultados obtenidos en la practicas
con sus correspondientes cuadros.
Agregar 10 m L de agua, En el vaso precipitado de
Pesar la capsula de 1000 ml llenarlo hasta
luego agregar sal, hasta
porcelana: 107.5 g sus ¾ partes.
que ya no se disuelva más
Verter la disolución en la
capsula de evaporación, y Temp. Experimental 33 °C,
Preparación del baño María,
registrar su peso. (122,3 g) agregar más soluto hasta
llevar la temperatura del agua
que ya no se disuelva más hasta la temp indicada (30°)
Proceder a evaporar, Masa de la cápsula
calentando la capsula con el con el soluto 112,9 g
mechero.
Bryan Paúl Ortiz Valarezo Paralelo: 125
Cálculos:
M1= capsula de evaporación.
M1= 107 g
M2= M1 + masa disolución M2= 107 g + 15,3 g= 122,3 g
M3= M1 + masa soluto M3= 107 g + 5,4 g= 112,9 g
Obtener la masa del soluto por cada 100 g de solvente.
𝑚 𝑠𝑜𝑙𝑢𝑡𝑜 × .𝑔 𝑠𝑜𝑙𝑢𝑡𝑜
=
𝑚 𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒 100 𝑔 𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒
5,4 𝑔 𝑥 .𝑔 𝑠𝑜𝑙𝑢𝑡𝑜
=
9,4 𝑔 100 𝑔 𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒
𝑔 𝑠𝑜𝑙𝑢𝑡𝑜
𝑥 = 57,44
100 𝑔 𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒
Datos
Masa Capsula evaporación 107,5 g
Masa de capsula con la disolución 122,3 g
Masa de la capsula son el soluto 112,9 g
Temperatura Teórica 30 °C
Datos de Resultados
Masa del soluto 5,4 g
Masa del disolvente 9,4 g
Masa del soluto (g)/100 g disolvente 57,44 g/100 g agua
Temperatura experimental (°C) 33°C
Tabla de Resultados
E Temperaturas (°C) Masa de Masa de Masa de soluto por
Q Teórica Experimental Soluto Solvente Cada 100 g de solvente
(g soluto/100g Agua)
A Ambiente 32 4,5 10 45
B 30 33 5,4 9,4 57,44
C 35 35 6,8 7 68,44
D 40 42 10,2 9,5 107 -
E 45 45 5,7 7,9 72,15
F 50 52 4,4 5,8 75,83
G 55 55 6,8 2,1 323,83
H 60 60 13,4 9,7 138,14
Bryan Paúl Ortiz Valarezo Paralelo: 125
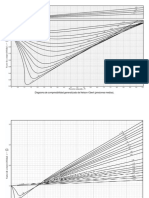
Solubilidad vs Temperatura (Teórica)
8. ANÁLISIS Y RESULTADOS:
Los resultados obtenidos muestran la solubilidad de la sustancia en
diferentes temperaturas. He planteado en primer lugar la secuencia del
procedimiento proporcionando algunos detalles cuantitativos en el transcurso
del mismo. Luego hay tablas con detalle en la experimentación con las
Bryan Paúl Ortiz Valarezo Paralelo: 125
respectivas cantidades de M1, M2, M3, proporcionado la masa del soluto,
solvente y disolución respectivos, con lo cual pude determinar la solubilidad
de la sustancia, dando comparaciones con la gráfica de Temperatura vs
solubilidad, obteniendo al final resultados aberrantes en el cálculo de la
solubilidad a la temperatura de 40°C y 52°C; estos valores los podemos
observar en la gráfica experimental mostrando estos puntos críticos
comparando con la grafica teórica.
9. CONCLUSIONES Y RECOMENDACIONES:
Por lo tanto, la solubilidad es una propiedad física que tienen las sustancias
al momento de disolverse en ella influye muchos factores importantes que
son, la naturaleza del soluto y el disolvente, la presión y la temperatura que
interviene en un factor muy importante, a mayor temperatura mayor cantidad
de soluto por cada 100g de solvente en este caso (H20). Conociendo a la vez
distintos tipos de soluciones: solución diluida, solución saturada y solución
sobresaturada.
Realizar las correctas mediciones de las masas de la capsula de
evaporación, disolución, soluto y solvente. Y por último llegar a la correcta
temperatura indicada.
Manipular con precaución el mechero de Bunsen, evitar posibles pérdidas de
gas.
Regular la intensidad de la llama para evitar sobrecalentamientos
innecesarios.
10. BIBLIOGRAFÍAS:
Brown, T. LeMay, H. Bursten, B. (2004). Química, la ciencia central, novena
edición. México: Pearson Educación.
Ralph A. Burns. (2003). Fundamentos de química, cuarta edición. México:
Pearson Educación.
Cárdenas, S. Carlos, A. (1999). Química y ambiente 1, segunda edición.
Colombia: Mc Graw Hill.
Atkins, J. (2003). Principios de química, tercera edición. España: Medica
Panamericana.
Chang, R. (2002). Química, segunda edición. Colombia: Mc Graw Hill
Bryan Paúl Ortiz Valarezo Paralelo: 125
S-ar putea să vă placă și
- Calorimetría: Determinación de capacidades caloríficas y calor de reaccionesDocument7 paginiCalorimetría: Determinación de capacidades caloríficas y calor de reaccionesShiSha Medina MagüesÎncă nu există evaluări
- Informe 2 Liquidos y Solidos CDocument5 paginiInforme 2 Liquidos y Solidos CShiSha Medina MagüesÎncă nu există evaluări
- INFORME-5 - Viscosidad MetanolDocument6 paginiINFORME-5 - Viscosidad MetanolErika GabrielaÎncă nu există evaluări
- Taller Productos de Origen AnimalDocument4 paginiTaller Productos de Origen AnimalValentina GonzalezÎncă nu există evaluări
- Rendimiento de Cristalizacion PDFDocument14 paginiRendimiento de Cristalizacion PDFAraceli FloresÎncă nu există evaluări
- Informe Determinación de La Solubilidad en SólidosDocument6 paginiInforme Determinación de La Solubilidad en SólidosGeovanny Moisés PanchanaÎncă nu există evaluări
- Identificación de sustancias ácidas, básicas o neutras mediante experimento de magnesioDocument2 paginiIdentificación de sustancias ácidas, básicas o neutras mediante experimento de magnesioHumber Leon100% (1)
- Física 1 Examen MejoramientoDocument9 paginiFísica 1 Examen MejoramientoMariuxi VivianaÎncă nu există evaluări
- Ejercicios de Química General PAO II 2023 SIN RESOLUCIÓN, Equilibrio QuímicoDocument5 paginiEjercicios de Química General PAO II 2023 SIN RESOLUCIÓN, Equilibrio QuímicoXyZÎncă nu există evaluări
- Informe Quimica PDFDocument11 paginiInforme Quimica PDFChristian Marcelo Macías AguiarÎncă nu există evaluări
- Tarea EquilibrioQuimicoDocument6 paginiTarea EquilibrioQuimicojaviereduardosalcedo0431Încă nu există evaluări
- Ejercicios Resueltos ResnickDocument17 paginiEjercicios Resueltos Resnickmoro monteroÎncă nu există evaluări
- PRINCIPIO DE LE CHATELIER-Práctica 2Document14 paginiPRINCIPIO DE LE CHATELIER-Práctica 2angie carolina cabrera PinedaÎncă nu există evaluări
- Informe III Preparacion de Metano Por Reduccion de CloroformoDocument3 paginiInforme III Preparacion de Metano Por Reduccion de CloroformoValentina Sanín RestrepoÎncă nu există evaluări
- Tarea de QuimicaDocument23 paginiTarea de QuimicaAbigail CortezÎncă nu există evaluări
- Informe 10Document17 paginiInforme 10CRUZ ARGOTE GUSTAVO ELIOÎncă nu există evaluări
- Ejercicios Tema 6 - 22-23Document6 paginiEjercicios Tema 6 - 22-23agustin cabreraÎncă nu există evaluări
- Cap 9 13 35 40 41 42 55 64Document6 paginiCap 9 13 35 40 41 42 55 64WoldreidÎncă nu există evaluări
- Curva de Solubilidad Del KClO3Document3 paginiCurva de Solubilidad Del KClO3Daniel MusumeciÎncă nu există evaluări
- SintesisdeCuSalen 26386 PDFDocument1 paginăSintesisdeCuSalen 26386 PDFzettamcÎncă nu există evaluări
- Calorímetro Articulo Cientifico - FinalDocument5 paginiCalorímetro Articulo Cientifico - FinalRuben Mejía AlmeidaÎncă nu există evaluări
- ProblemasDocument6 paginiProblemasLAURA GUERRERO SAUCEÎncă nu există evaluări
- Informe 3 DisolucionesDocument7 paginiInforme 3 DisolucionesShiSha Medina MagüesÎncă nu există evaluări
- Entalpia Casos de EstudioDocument3 paginiEntalpia Casos de EstudioRobert Joaquin Medina RamosÎncă nu există evaluări
- InformeDocument9 paginiInformemomentodepruebaÎncă nu există evaluări
- Soluciones de ácidos y basesDocument6 paginiSoluciones de ácidos y basesCarlos DelafuenteÎncă nu există evaluări
- Informe CalorimetriaDocument6 paginiInforme CalorimetriaMorella Moya MoreiraÎncă nu există evaluări
- Cuestionario Punto de FusionDocument3 paginiCuestionario Punto de FusionALEJANDRA CESPEDES PEREZÎncă nu există evaluări
- Sistemas de oxidación-reducción: reacciones redox y celdas electroquímicasDocument14 paginiSistemas de oxidación-reducción: reacciones redox y celdas electroquímicasMontserrat Concepción Portilla MarínÎncă nu există evaluări
- Práctica 4Document7 paginiPráctica 4Alejandro ReyesÎncă nu există evaluări
- Guía de ejercicios de potencial celular y pHDocument3 paginiGuía de ejercicios de potencial celular y pHHernando Villavicencio0% (1)
- Guía EquilibrioDocument3 paginiGuía EquilibrioConstanza Marian0% (1)
- Un Combustible Formado Por Etano C2H6 y CH4 en Proporciones Desconocidas Se Quema en Un Horno Utilizando Aire Enriquecido Que Contiene 50 1Document2 paginiUn Combustible Formado Por Etano C2H6 y CH4 en Proporciones Desconocidas Se Quema en Un Horno Utilizando Aire Enriquecido Que Contiene 50 1Marco Antonio Campos VeraÎncă nu există evaluări
- Trabajo de Fenomenos Conductividades1Document6 paginiTrabajo de Fenomenos Conductividades1VILCACHUMBESÎncă nu există evaluări
- Informe Propiedades ColigativasDocument13 paginiInforme Propiedades ColigativasNatasha Arcos0% (1)
- Práctica 3 (Solubilidad)Document4 paginiPráctica 3 (Solubilidad)Jaime FarfanÎncă nu există evaluări
- Informe Viscosímetro HopplerDocument3 paginiInforme Viscosímetro HopplerKarina GarciaÎncă nu există evaluări
- Ejercicios de entropía y cambios de faseDocument3 paginiEjercicios de entropía y cambios de faseRoosvel Soto DiazÎncă nu există evaluări
- Informe de Laboratorio Determinacion de Curva de SolubilidadDocument4 paginiInforme de Laboratorio Determinacion de Curva de SolubilidadJose MoraÎncă nu există evaluări
- Iv. Reporte de Resultados Experiencia N°1: Densidad Del Agua y Etanol. Datos ExperimentalesDocument7 paginiIv. Reporte de Resultados Experiencia N°1: Densidad Del Agua y Etanol. Datos ExperimentalesLiz Angela Tintaya Alvarez100% (1)
- IsotermasDocument6 paginiIsotermasSamu Benito100% (1)
- SOLUCION 1er Parcial QGI Mi Rcoles 5 Diciembre 2007Document6 paginiSOLUCION 1er Parcial QGI Mi Rcoles 5 Diciembre 2007Luis VacaÎncă nu există evaluări
- Refractometria Lab. FisicoquimicaDocument26 paginiRefractometria Lab. FisicoquimicaEdson DiazÎncă nu există evaluări
- Práctica 5 COEFICIENTE DE CONDUCTIVIDAD TÉRMICADocument10 paginiPráctica 5 COEFICIENTE DE CONDUCTIVIDAD TÉRMICAjulian aruquipaÎncă nu există evaluări
- Física 2: CalorimetríaDocument3 paginiFísica 2: CalorimetríaMirely Juleysi Guevara BecerraÎncă nu există evaluări
- Sol T4Document2 paginiSol T4Brenda CruzÎncă nu există evaluări
- Informe Tema 9Document15 paginiInforme Tema 9Daniel Vargas TrujilloÎncă nu există evaluări
- Calorimetría: Combustiones y Reacciones QuímicasDocument3 paginiCalorimetría: Combustiones y Reacciones QuímicasAbrahan Arias LarcoÎncă nu există evaluări
- Ejercicios MejoramientoDocument4 paginiEjercicios MejoramientoLuis Vaca100% (1)
- Tarea #2 Liquidos y Solidos - ESTUDIANTESDocument11 paginiTarea #2 Liquidos y Solidos - ESTUDIANTESAnthony EstradaÎncă nu există evaluări
- Practica3 Viscosidad de Los HidrocarburosDocument8 paginiPractica3 Viscosidad de Los HidrocarburosMiguel Potosí MndzÎncă nu există evaluări
- Consulta PreviaDocument3 paginiConsulta PreviaDaniela OsorioÎncă nu există evaluări
- Coleccion Ejercicios - AnaliticaDocument19 paginiColeccion Ejercicios - AnaliticamadecarupuÎncă nu există evaluări
- 2 Informe 2 Densidad de Los GasesDocument6 pagini2 Informe 2 Densidad de Los GasesJorge Stban PerezÎncă nu există evaluări
- Constantes de equilibrio y cálculos termodinámicos de reacciones químicasDocument9 paginiConstantes de equilibrio y cálculos termodinámicos de reacciones químicasSherlin Almanza Obregon0% (1)
- Informe Fisicoquímica-Laboratorio 2Document7 paginiInforme Fisicoquímica-Laboratorio 2Heidy Montes GalarzaÎncă nu există evaluări
- Gráfica Generalizada de Compresibilidad de Nelson-Obert (Versión 2) PDFDocument2 paginiGráfica Generalizada de Compresibilidad de Nelson-Obert (Versión 2) PDFcartking89Încă nu există evaluări
- PRÁCTICA 2. Determinacion Del Punto de EbullicionDocument27 paginiPRÁCTICA 2. Determinacion Del Punto de EbullicionChristian Torres Chávez100% (1)
- Reporte DestilaciónDocument15 paginiReporte DestilaciónYael Hernandez LopezÎncă nu există evaluări
- Solubilidad de Los SólidosDocument5 paginiSolubilidad de Los SólidosRenato Luna AguilarÎncă nu există evaluări
- Informe de Laboratorio de Química # 5Document8 paginiInforme de Laboratorio de Química # 5DavidFer DuraznoÎncă nu există evaluări
- Guia de Laboratorio Ensayo de Solidos SedimentablesDocument4 paginiGuia de Laboratorio Ensayo de Solidos SedimentablesCarol Stefany Sierra LopezÎncă nu există evaluări
- MSDS PinturaDocument7 paginiMSDS PinturaMauricio CordiÎncă nu există evaluări
- Alcaloides, Generalidades y CaracteristicasDocument3 paginiAlcaloides, Generalidades y CaracteristicasJuan Pardo0% (1)
- TEMA Análisis Gravimétrico - Factor Gravimétrico KPS, SolubilidadDocument14 paginiTEMA Análisis Gravimétrico - Factor Gravimétrico KPS, SolubilidadFrancisco Alvarado TapiaÎncă nu există evaluări
- Titulación y Valoración de SolucionesDocument9 paginiTitulación y Valoración de Solucionesritcarr100% (1)
- Sistemas TernariosDocument10 paginiSistemas TernariosJosé M Yanez MÎncă nu există evaluări
- Solubilidad de compuestos orgánicosDocument5 paginiSolubilidad de compuestos orgánicosNataliaÎncă nu există evaluări
- Eflorescencias en El HormigónDocument5 paginiEflorescencias en El HormigónNaara GonzalezÎncă nu există evaluări
- UNIDAD 1 ConduccionDocument61 paginiUNIDAD 1 ConduccionDavid DomínguezÎncă nu există evaluări
- PRACTICAS QuimicaDocument111 paginiPRACTICAS QuimicaHavva Veve100% (1)
- Informe 6 QuímicaDocument13 paginiInforme 6 QuímicaCarbajal JavierÎncă nu există evaluări
- Acido Fosforico MSDSDocument5 paginiAcido Fosforico MSDSJulioCandiaÎncă nu există evaluări
- Obtencion Del Acido AcetilsalicilicoDocument9 paginiObtencion Del Acido Acetilsalicilicofernando77% (13)
- El Carbonato de LitioDocument5 paginiEl Carbonato de LitioCamila Constanza Contador SagredoÎncă nu există evaluări
- Matrero 240-HDSMDocument7 paginiMatrero 240-HDSMeternidadÎncă nu există evaluări
- Ley de BoyleDocument19 paginiLey de Boylefuckumodafaka100% (1)
- 24kt Msds SpanishDocument10 pagini24kt Msds Spanishalph05Încă nu există evaluări
- InformeLaboratorioMezclasHomogeneasHeterogeneasDocument22 paginiInformeLaboratorioMezclasHomogeneasHeterogeneaskelly gonzalezÎncă nu există evaluări
- Azufre FundidoDocument4 paginiAzufre FundidoLevi MuñozÎncă nu există evaluări
- Tema 1 DisolucionesDocument24 paginiTema 1 DisolucionesJerry Isaac Guerra HilarioÎncă nu există evaluări
- Great Review ESDocument35 paginiGreat Review ESAndrés Felipe ÁvilaÎncă nu există evaluări
- Materia 9Document14 paginiMateria 9Kevin PerdomoÎncă nu există evaluări
- MSDS 5. Alcohol IsopropilicoDocument4 paginiMSDS 5. Alcohol IsopropilicoSos contingencias sasÎncă nu există evaluări
- Informe Lab Org 1Document6 paginiInforme Lab Org 1David RojasÎncă nu există evaluări
- Volumetria Oxido Reduccion Yodo-YodimetriaDocument3 paginiVolumetria Oxido Reduccion Yodo-YodimetriaAndresFelipeChinguadObandoÎncă nu există evaluări
- Marcha Cationes 4to y 5to GrupoDocument6 paginiMarcha Cationes 4to y 5to GrupoJosé Elías Paima dahuaÎncă nu există evaluări
- 3.4.diagramas de Fases 2011Document42 pagini3.4.diagramas de Fases 2011Mariangely Caraballo0% (1)
- Aceite CocoDocument4 paginiAceite CocoVincent RosaÎncă nu există evaluări
- Obtencion de Acido PicricoDocument6 paginiObtencion de Acido PicricoLa Ruta del CaminanteÎncă nu există evaluări