Documente Academic
Documente Profesional
Documente Cultură
Complexo Me Tria
Încărcat de
michaelDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Complexo Me Tria
Încărcat de
michaelDrepturi de autor:
Formate disponibile
7.
CUESTIONARIO
7.1. DEFINA TITULACION COMPLEJIMETRICA
Valoración complexométrica (o Quelatometría) es una forma de análisis volumétrico
basado en la formación de compuestos poco disociados: 1 halogenuros de mercurio,
cianuro de plata, fluoruro de aluminio. Se suele utilizar la formación de un complejo
coloreado para indicar el punto final de la valoración. Las valoraciones
complexométricas son particularmente útiles para la determinación de una mezcla de
diferentes iones metálicos en solución. Generalmente se utiliza un indicador capaz de
producir un cambio de color nítido para detectar el punto final de la valoración.
VOLUMETRIA COMPLEXOMETRICA
En la volumetría complexométricas se mide el volumen de solución tipo,
necesario para formar un complejo con un catión metálico del compuesto que
se analiza.
Muchos cationes metálicos reaccionan con especies dadoras de electrones
llamadas ligando, para formar compuestos de coordinación o complejos. El
ligando debe tener por lo menos un par de electrones sin compartir.
Los complejos llamados quelatos, se producen por la coordinación de un catión
y un ligando, en los que el catión (metálico) es parte de uno o varios anillos de
cinco o seis miembros.
Los compuestos orgánicos más conocidos que forman quelatos utilizables en
análisis cuantitativo son el ácido nitrilotriacetico, el ácido
etilendiaminotetraacetico (EDTA) y la sal disodica del EDTA; estos compuestos
se conoces comercialmente con los nombres de Tiriplez I, II y III
respectivamente; también se utilizan los nombres de complexonas, bencenos o
secuestrones.
7.5. CUANDO SE DICE QUE EL AGUA ES DURA Y CUANDO QUE EL AGUA ES
BLANDA
Se conoce como agua dura a aquella que dificulta el desarrollo de espuma al estar en
contacto con jabón, debido a que presenta una elevada cantidad de bicarbonatos y
carbonatos de magnesio y de calcio. Para calcular la dureza del agua, se suelen
sumar las concentraciones de magnesio y de calcio que están presentes en cada litro
de agua.
Lo opuesto al agua dura es el agua blanda: el líquido que tiene una cantidad muy
reducida de sales minerales. Cuando en el agua no existe ningún mineral (es decir,
cuando está formada solo por hidrógeno y oxígeno), se habla de agua destilada.
8. PROBLEMAS DE APLICACIÓN
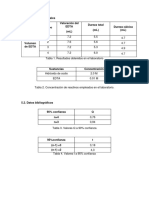
8.4. En la titulación de los iones Ca y Mg de una muestra de 50 ml de agua dura se
gastaron 22.35 ml de EDTA 0.01115 M. una segunda alícuota de 50 ml se alcalinizo
fuertemente con NaOH para precipitar el Mg como Mg (OH)2. El sobrante se tituló con
15.19 ml de solución de EDTA calcular:
a. la dureza total de la muestra de agua, expresada como ppm de CaCO3
SOLUCION:
a. la dureza total de la muestra de agua, expresada como ppm de CaCO3
V EDTA x M EDTA x PMCaCO 3 x 1000 mg/g
DTOT =
V H 2O
Donde:
o DTOTAL: Dureza total (mg CaCO3/L H2O)
o VEDTA: Volumen de EDTA consumido en la titulación (mL).
o MEDTA : molaridad del EDTA utilizado como titulante (mol /L).
o PM CaCO3 : Peso molecular del carbonato de calcio ( g/mol)
o VH2O: Volumen de agua (mL).
g mg
(22.35 ml) x (0.01115 M ) x (100.0869 ) x (1000 )
mol g
DTOT =
50 ml
DTOT =498.83811
S-ar putea să vă placă și
- Libro DP1Document2 paginiLibro DP1michaelÎncă nu există evaluări
- Paper InkaborDocument8 paginiPaper InkabormichaelÎncă nu există evaluări
- Laboratorio #10Document9 paginiLaboratorio #10michaelÎncă nu există evaluări
- Esquema de La Exposición SPDocument2 paginiEsquema de La Exposición SPmichaelÎncă nu există evaluări
- DECLARACIONDocument1 paginăDECLARACIONmichaelÎncă nu există evaluări
- ArteDocument3 paginiArtemichaelÎncă nu există evaluări
- Produccion Agua PotableDocument34 paginiProduccion Agua PotableDenisÎncă nu există evaluări
- Capitulo 1 Biodiesel y Su Produccion IndustrialDocument57 paginiCapitulo 1 Biodiesel y Su Produccion IndustrialmichaelÎncă nu există evaluări
- 2.b Flujo de FluidosDocument24 pagini2.b Flujo de FluidosmichaelÎncă nu există evaluări
- MicroscopioDocument11 paginiMicroscopioफर्नांडीज कीटÎncă nu există evaluări
- Normas Seguridad Aviso Labs ElectDocument1 paginăNormas Seguridad Aviso Labs ElectAndrea JimenezÎncă nu există evaluări
- Oxidación Del EtilenoDocument63 paginiOxidación Del EtilenoMelitza GonzalezÎncă nu există evaluări
- Tema III Guia de Problemas 2016Document6 paginiTema III Guia de Problemas 2016Anonymous QmMrcdFÎncă nu există evaluări
- Tema 9 VirusDocument2 paginiTema 9 Virusdavid joel soncco tintayaÎncă nu există evaluări
- Tema III Guia de Problemas 2016Document6 paginiTema III Guia de Problemas 2016Anonymous QmMrcdFÎncă nu există evaluări
- Informe de Modulo de AgitacionDocument11 paginiInforme de Modulo de AgitacionmichaelÎncă nu există evaluări
- Contaminacin AtmsferaDocument48 paginiContaminacin AtmsferaPeluche VivancoÎncă nu există evaluări
- Czapek Dox AgarDocument2 paginiCzapek Dox AgarmichaelÎncă nu există evaluări
- Agente EtiológicoDocument4 paginiAgente EtiológicomichaelÎncă nu există evaluări
- Analisis Economico-Social Del Pais de VenezuelaDocument4 paginiAnalisis Economico-Social Del Pais de VenezuelamichaelÎncă nu există evaluări
- Rendimiento de Pha en GlucosaDocument1 paginăRendimiento de Pha en GlucosamichaelÎncă nu există evaluări
- Informe Determinacion de SiliceDocument6 paginiInforme Determinacion de SilicemichaelÎncă nu există evaluări
- Practica 1Document7 paginiPractica 1michaelÎncă nu există evaluări
- FARMACOPEADocument2 paginiFARMACOPEAmichael100% (1)
- Ix.-Ilustraciones: Imagen 1Document2 paginiIx.-Ilustraciones: Imagen 1michaelÎncă nu există evaluări
- AzucaresDocument9 paginiAzucaresHugo Ramírez SicheÎncă nu există evaluări
- Sulfonacion Apunte Def 2007Document20 paginiSulfonacion Apunte Def 2007para_esÎncă nu există evaluări
- Biosorción de Metales Pesados Mediante El Uso de Biomasa MicrobianaDocument13 paginiBiosorción de Metales Pesados Mediante El Uso de Biomasa MicrobianaangelluishfÎncă nu există evaluări
- Problemas PropuestosDocument2 paginiProblemas PropuestosmichaelÎncă nu există evaluări
- 01 Clasificacion de AguasDocument20 pagini01 Clasificacion de AguasFrancoMagneIquiseÎncă nu există evaluări
- Volumetría Por ComplejometriaDocument3 paginiVolumetría Por ComplejometriaRoberto Carlos EspinozaÎncă nu există evaluări
- Determinación de La Dureza Del AguaDocument9 paginiDeterminación de La Dureza Del AguaAnonymous 28dbytÎncă nu există evaluări
- LaboratorioN°2 PlantaDocument14 paginiLaboratorioN°2 PlantaNicole Flores GenebrozoÎncă nu există evaluări
- Tratamiento Quimico de Aguas en Sistemas de Generacion de Vapor (CALDEROS)Document63 paginiTratamiento Quimico de Aguas en Sistemas de Generacion de Vapor (CALDEROS)juan carlosÎncă nu există evaluări
- SOS RefrigeranteDocument11 paginiSOS RefrigeranteManuelÎncă nu există evaluări
- Informe Hidrogeologico de La Meseta Del SomuncuraDocument12 paginiInforme Hidrogeologico de La Meseta Del SomuncuravascoleÎncă nu există evaluări
- Lab-1 Procesos 1Document54 paginiLab-1 Procesos 1Nari AdnarimÎncă nu există evaluări
- Analisis de Riesgos Del Tratamiento Del Agua para CalderasDocument96 paginiAnalisis de Riesgos Del Tratamiento Del Agua para CalderasLuis Enrique VallejoÎncă nu există evaluări
- EdtaDocument4 paginiEdtaSara Vertel BenitezÎncă nu există evaluări
- Tesis Ing Planta Agua Atlantico IlusionesDocument133 paginiTesis Ing Planta Agua Atlantico IlusionesAroldo Pérez CantoÎncă nu există evaluări
- Ablandamiento Con CalDocument5 paginiAblandamiento Con CalAna Maria Landaeta RamosÎncă nu există evaluări
- Problemas AguasDocument1 paginăProblemas Aguasantony_3_31Încă nu există evaluări
- ES EL EXITO de QuimicaDocument48 paginiES EL EXITO de QuimicaAdrián MoralesÎncă nu există evaluări
- Practica 1. Analisis Fisico-Quimico AguasDocument4 paginiPractica 1. Analisis Fisico-Quimico AguasJosé Burgos0% (2)
- Calculo Del Indice de Langelier PDFDocument4 paginiCalculo Del Indice de Langelier PDFLupitaYAÎncă nu există evaluări
- Manual de Fluidos Baroid 16 - Lodos Base AguaDocument28 paginiManual de Fluidos Baroid 16 - Lodos Base AguaCARLOSELSOARES0% (1)
- Unidad 1 Introducción. Importancia Del Suministro de AguaDocument51 paginiUnidad 1 Introducción. Importancia Del Suministro de AguaFray Tejada0% (1)
- Agua para Industria AutomotrizDocument17 paginiAgua para Industria AutomotrizEleazarRomero0% (1)
- Resultados y DiscusionDocument3 paginiResultados y DiscusionLiseth Hinostroza VidalÎncă nu există evaluări
- Manual Acumulador Sanitario (Simple - Doble Serpentina)Document34 paginiManual Acumulador Sanitario (Simple - Doble Serpentina)Julian CorreaÎncă nu există evaluări
- Intercambio IónicoDocument69 paginiIntercambio IónicochapuchinoÎncă nu există evaluări
- Los Metales de Los Grupos 1 - Quimica InorganicaDocument21 paginiLos Metales de Los Grupos 1 - Quimica InorganicafredgccÎncă nu există evaluări
- Objetivos:: Determinacion de La Dureza Del AguaDocument4 paginiObjetivos:: Determinacion de La Dureza Del AguaCr CrÎncă nu există evaluări
- Control de Parametros Fisicoquimico de Una PiscinaDocument28 paginiControl de Parametros Fisicoquimico de Una PiscinaSandra Osorio DelgadoÎncă nu există evaluări
- El CrisolDocument323 paginiEl CrisolAdrian Rosas100% (1)
- Laboratorio 5 - Qco - Capacidad de LimpiezaDocument10 paginiLaboratorio 5 - Qco - Capacidad de LimpiezaXimena GutierrezÎncă nu există evaluări
- Ablandamiento QuimicoDocument3 paginiAblandamiento QuimicoJose Alberto GutierrezÎncă nu există evaluări
- AguaDocument5 paginiAguaAndrew BrownÎncă nu există evaluări