Documente Academic
Documente Profesional
Documente Cultură
Falta Ale
Încărcat de
Alejandra Hdz MontesTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Falta Ale
Încărcat de
Alejandra Hdz MontesDrepturi de autor:
Formate disponibile
ENZIMAS
Las enzimas son proteínas especializadas que tienen como función la aceleración
de reacciones químicas.
Una enzima es una proteína que actúa como catalizador de una reacción química
acelerándola. Las enzimas son protagonistas fundamentales en los procesos del
metabolismo celular. Las enzimas unen su sustrato en el centro reactivo o
catalítico, que suele estar protegido del agua para evitar interacciones no
deseadas. En el centro reactivo la disposición espacial y los tipos de cadenas
laterales de aminoácidos son fundamentales para orientar correctamente el
sustrato y poder interaccionar de la forma deseada para llevar a cabo la catálisis
de la reacción. Las enzimas son muy selectivas en relación a los sustratos que
modifican. Las enzimas suelen ser mucho más grandes que sus sustratos y en
muchas ocasiones requieren de la participación de otras moléculas más pequeñas
no polipeptídicas como las coenzimas (biotina, NADH entre otros) o los iones
metálicos llamados cofactores.
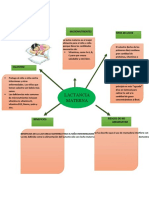
Las enzimas presentan una alta especificidad
Un apoenzimas es la parte proteica de la enzima carente de grupos prostéticos o
cofactores que son necesarios para que la enzima sea activa, es decir, apoenzima
es catalíticamente inactivo.
Cofactor: son moléculas pequeñas organicas o inorgánicas que son necesarios
para la actividad del apoenzima. Ej: linasa oxidasa
Coenzima: son cofactores orgánicos con características no proteicas sintetizadas
por lo general a partir de vitaminas. Las coenzimas se unen de manera transitoria
al sitio activo de la enzima para promover su actividad. La coenzima define el tipo
de reacción en la que participa la enzima.
Las vitaminas son moléculas orgánicas complejas, indispensables para el funcionamiento
adecuado de los seres vivos e indispensables en cantidades mínimas, pero sin funciones
estructurales ni energéticas. En general, no son sintetizadas por los animales y, por lo tanto,
deben obtenerse de los alimentos; en la naturaleza las vitaminas son producidas por las bacterias
y los vegetales. La estructura química y las funciones de las vitaminas son muy diversas; muchas
actúan como coenzimas y, cuando no se ingieren en cantidades adecuadas, se observan cuadros
clínicos de deficiencia. En la actualidad, aun 380 en los países muy atrasados, es difícil ver
carencias de una sola vitamina, como ocurría en el pasado, cuando por falta de vitamina C
aparecía el escorbuto, o por carencia de tiamina se producía el beriberi en los pueblos orientales,
cuya alimentación se basaba en el arroz descascarillado.
EJEMPLOS DE VITAMINAS QUE SON SINTETIZADAS PARA SER
COENZIMAS Y DONDE PARTICIPAN
https://es.wikipedia.org/wiki/Nicotinamida_adenina_dinucle%C3%B3tido
OBLIGATORIO LEER PARA EXPLICAR UN EJEMPLO COMPLETO DE
COENZIMA POR LA TABLA
Vitamina B1 o tiamina. Forma parte de las coenzimas (la parte no proteica
de las holoenzimas) que participan en el metabolismo de glúcidos y lípidos.
Las fuentes alimentarias en las que se puede encontrar vitamina B1 son:
cereales completos (como harinas y granos), leguminosas, levaduras y
carnes en general.Una carencia importante y duradera produce una
enfermedad llamada beriberi, que afecta al sistema nervioso y que se
caracteriza por debilidad muscular, pérdida de reflejos, parálisis, problemas
de sensibilidad e insuficiencia cardiaca, entre otras afecciones.
Vitamina B2 o riboflavina. Forma parte de coenzimas que participan en la
respiración celular, proceso por el que se obtiene energía; participa también
en los procesos de crecimiento.Se puede encontrar en casi todos los
alimentos, como la leche y sus derivados, huevo, hígado de animales,
vegetales, levadura de panadería, etc. La deficiencia de esta vitamina
produce lesiones en las mucosas, dermatitis, irritabilidad de mejillas y
lengua, trastornos oculares y retraso en el crecimiento.
Vitamina B3 o factor PP o niacina. Participa en la síntesis (anabolismo) y
degradación (catabolismo) de los ácidos grasos, los glúcidos y los
aminoácidos, ya que forma parte de dos coenzimas que intervienen en
estos procesos.Está contenida en numerosos alimentos, como carnes y
vísceras, pescados, leche, leguminosas, cereales completos, etc.La
demanda de esta vitamina es bastante importante durante la adolescencia,
la gestación y los periodos de crecimiento en general, por lo que en estas
etapas debe aumentarse su ingesta diaria.Es la única vitamina hidrosoluble
que puede provocar algún trastorno si se ingiere en exceso, por ejemplo
enrojecimiento y picores en la piel. Por el contrario, su déficit puede
producir una enfermedad denominada pelagra, que se conoce como la
enfermedad de las cuatro «d» por los trastornos que conlleva: diarreas,
dermatitis, demencia y, en casos extremos, defunción.
Vitamina B5 o ácido pantoténico. Forma parte de una coenzima
imprescindible para la degradación de ciertos glúcidos, ácidos grasos y
aminoácidos.Se encuentra presente en todos los tejidos animales, donde se
almacena, y en prácticamente todos los alimentos, sobre todo en la
levadura de cerveza, en las vísceras, en la yema de huevo y en la jalea
real.La carencia de esta vitamina es muy rara, ya que se encuentra en
multitud de productos, pero en el caso de producirse, sus síntomas serían
dermatitis, despigmentación de la piel, anemia (disminución de algunos
componentes de la sangre) y problemas de circulación sanguínea en las
extremidades inferiores.
Vitamina B6 o piridoxina. Es una coenzima que forma parte de las enzimas
que participan en el metabolismo de los aminoácidos. Principalmente se
encuentra en los vegetales de hojas verdes, los cereales completos, el
hígado, los cacahuetes y otros frutos grasos. En menor cantidad, se puede
encontrar en frutas como el plátano.Las cantidades recomendadas a tomar
diariamente de esta vitamina varían mucho a lo largo de la vida, siendo más
elevadas durante el embarazo y la lactancia.Su déficit, aunque raro, puede
provocar alteraciones en el sistema nervioso, como irritabilidad,
depresiones, trastornos del sueño, etc. También puede provocar dermatitis
en la piel.
Vitamina B8 o vitamina H o biotina. Es también coenzima de enzimas, y
participa en el metabolismo de grasas, aminoácidos y glúcidos.Está
presente en multitud de alimentos, sobre todo en vegetales, en el hígado de
animales y en el huevo. Es producida por las bacterias que se encuentran
en la flora de la pared intestinal, por lo que los animales la pueden obtener
a través de ella.Si no se ingiere suficiente vitamina B8 se pueden producir
trastornos como dermatitis, alopecia o caída del cabello, anemia, vómitos y
anorexia.
Vitamina B9 o ácido fólico. Es coenzima de enzimas implicadas en la
síntesis de las bases nitrogenadas que forman los ácidos nucleicos, las
purinas y las pirimidinas. También se ha podido estudiar su participación en
el crecimiento y en la formación de los glóbulos rojos de la sangre
Holoenzima: Enzima activo, tiene lugar gracias a la adicion de cofactores o
grupos prostéticos a la apoproteina
La molécula sobre la que actúa una enzima para formar un producto se le
denomina sustrato
Algunas enzimas presentan variantes denominadas isoenzimas, son proteínas
con diferente estructura pero que catalizan la misma reacción. Con frecuencia, las
isoenzimas son oligomeros de diferentes cadenas peptídicas, y usualmente
difieren en los mecanismos de regulación y en las características cinéticas.
Centro alostérico: Región de una enzima donde interacciona una determinada
molécula, produciendo la activación o la inhibición de la enzima.
Centro activo: el centro activo o sitio activo es el lugar donde se une el sustrato y
ocurre la acción catalítica
Grupo Prostético: Un grupo prostético es el fragmento de una proteína que no
posee naturaleza aminoacídica. En estos casos, la proteína se denomina
“heteroproteína” o proteína conjugada
Importancia
Las enzimas son importantes debido a que, cada etapa de una vía metabólica está
catalizada por una enzima. Además de que la medida de la actividad enzimática
en fluidos biológicos o tejidos es importante para el diagnóstico de muchas
enfermedades.
ESTAS SON UNAS CARACTERISTICAS QUE ENCONTRÉ
La mayoría están constituidas por más de 100 aminoácidos, lo que
confieren a la molécula una masa mayor a 10 K dalton y un diámetro de
más de 25 A°.
Disminuye la energía de activación, facilitando el inicio de una reacción, es
decir, son Catalizadores. Oswald los define como agentes que afectan una
reacción química, sin participar como reactantes y sin aparecer en los
productos finales de la reacción.
Se requieren en cantidades mínimas
Pueden ser regulables o alostéricas
El modelo de Michaelis-Menten ayudó mucho al desarrollo de la química de
las enzimas gracias a su simplicidad y aplicabilidad. Sin embargo, este
modelo no explica las propiedades cinéticas de muchas enzimas. Un grupo
de enzimas que no obedecen la cinética de Michaelis-Menten son las
enzimas alostéricas, estas enzimas tienen varias subunidades y varios
sitios activos.
En las enzimas alostéricas la unión de un sustrato a un sitio activo puede
afectar las propiedades de otros sitios activos en la misma molécula. Un
posible resultado de esta interacción entre subunidades es que la unión del
sustrato resulte cooperativo, es decir que la unión del sustrato en un sitio
activo facilita la unión de los otros sustratos en los sitios activos vecinos.
Susceptibles a ser inhibidas por diversas sustancias o abolir su actividad
Un inhibidor enzimático es algún compuesto que impide que alguna, o
algunas, enzimas catalicen. Este tipo de compuestos son específicos, o sea
que pueden inhibir a un grupo de enzimas pero no tener ninguna actividad
con otras enzimas. Los inhibidores, dependiendo de la forma en que actúan
se han clasificado en dos grandes grupos:
Este tipo de compuestos se unen, de manera irreversible, con el grupo R de
algún aminoácido de la enzima, formando un complejo enzima - inhibidor
(EI), el cual es incapaz de llevar a cabo el acto de catálisis
A diferencia de los inhibidores irreversibles, los reversibles reaccionan con
la enzima, pero el complejo enzima inhibidor producido puede separarse
para formar la enzima libre más el inhibidor.
modifican la estructura química del sustrato según el tipo de reacciones que
catalicen.
Es un ejemplo :v
No alteran el equilibrio de las reacciones Equilibrio químico es la
denominación que se hace a cualquier reacción reversible cuando se
observa que las cantidades relativas de dos o más sustancias permanecen
constantes, es decir, el equilibrio químico se da cuando la concentración de
las especies participantes no cambia, de igual manera, en estado de
equilibrio Capaces de intercambiar diferentes formas de energía
S-ar putea să vă placă și
- Trabajo LípidosDocument7 paginiTrabajo LípidosSherly LunaÎncă nu există evaluări
- ANTIOXIDANTESDocument5 paginiANTIOXIDANTESKaterin Rondo TolentinoÎncă nu există evaluări
- Wuolah Free IB Biologia Unidad 2Document11 paginiWuolah Free IB Biologia Unidad 2ssssssÎncă nu există evaluări
- Precios Lacteos y Margarinas 2021 JunioDocument23 paginiPrecios Lacteos y Margarinas 2021 JunioHenry Andres Cortes PeñaÎncă nu există evaluări
- Examen Final de La Química y La Vida Marzo 2013Document2 paginiExamen Final de La Química y La Vida Marzo 2013Carlos Alfredo LópezÎncă nu există evaluări
- Vitamina ADocument2 paginiVitamina Arosmy altamiranoÎncă nu există evaluări
- Mapa Metabolico ResumidoDocument1 paginăMapa Metabolico ResumidoAnanda SilvaÎncă nu există evaluări
- LipidosDocument19 paginiLipidosespanadiego332Încă nu există evaluări
- Dogma Central de La Biología MolécularDocument3 paginiDogma Central de La Biología MolécularRicardo BautistaÎncă nu există evaluări
- Mapa BioquimicaDocument1 paginăMapa BioquimicaJanetzy AlvarezÎncă nu există evaluări
- Digestión, Absorción y Transporte de LípidosDocument3 paginiDigestión, Absorción y Transporte de LípidosAndy GÎncă nu există evaluări
- Ejemplos de Partidas ArancelariasDocument6 paginiEjemplos de Partidas ArancelariasMargot Huanca TorresÎncă nu există evaluări
- Metabolitos Primario y Secundarios - MonograficoDocument7 paginiMetabolitos Primario y Secundarios - MonograficoKelly Panduro HoyosÎncă nu există evaluări
- 2do Parcial Química BiológicaDocument8 pagini2do Parcial Química BiológicaEzequiel RiverosÎncă nu există evaluări
- Lipidos MCDocument1 paginăLipidos MCJennifer Ching Pacheco100% (1)
- Trabajo para La Mocosa EngreidaDocument1 paginăTrabajo para La Mocosa EngreidaRodrigo E GuerraÎncă nu există evaluări
- 2022.unidad 2 Lipidos - ActividadesDocument4 pagini2022.unidad 2 Lipidos - ActividadesSofia CotrerasÎncă nu există evaluări
- AnticuerpoDocument6 paginiAnticuerpocarolinaÎncă nu există evaluări
- Repaso ProteinasDocument20 paginiRepaso ProteinasAnaÎncă nu există evaluări
- Sesion 6-BiologiaDocument4 paginiSesion 6-BiologiabrendixfaÎncă nu există evaluări
- Ejercicios 2 12 Genetica MolecularDocument4 paginiEjercicios 2 12 Genetica MolecularAngelgamerpro superÎncă nu există evaluări
- Ft. Aceite de Salvado de Arroz.Document3 paginiFt. Aceite de Salvado de Arroz.Cesar Augusto Altahona RojasÎncă nu există evaluări
- Disposicion Se Planta S08. OffDocument11 paginiDisposicion Se Planta S08. OffJesus peña tipianÎncă nu există evaluări
- 14 y 15. Autoevaluación de Metabolismo de LípidosDocument8 pagini14 y 15. Autoevaluación de Metabolismo de LípidosCataÎncă nu există evaluări
- Taller 7. Acidos NucléicosDocument2 paginiTaller 7. Acidos NucléicosMaria Fernanda Julio HerazoÎncă nu există evaluări
- Presentacion NutricionDocument11 paginiPresentacion Nutricionjose carabaliÎncă nu există evaluări
- VITAMINASDocument28 paginiVITAMINASAlejandra OviedoÎncă nu există evaluări
- 1-S2.0-S0308814622032526-Main es-ESDocument23 pagini1-S2.0-S0308814622032526-Main es-ESDanilo PinillaÎncă nu există evaluări
- Concejos para Llevar Una Vida Saludable DiapositivasDocument8 paginiConcejos para Llevar Una Vida Saludable DiapositivasDaniel PeraltaÎncă nu există evaluări
- Acidos Nucleicos AdrianaDocument42 paginiAcidos Nucleicos AdrianaJerzy AmbrizÎncă nu există evaluări