Documente Academic
Documente Profesional
Documente Cultură
Seminario 5 PDF
Încărcat de
Gabrielitha Keit SanzTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Seminario 5 PDF
Încărcat de
Gabrielitha Keit SanzDrepturi de autor:
Formate disponibile
UNIVERSIDAD NACIONAL DEL CENTRO
DE LA PROVINCIA DE BUENOS AIRES
Facultad de Ciencias Veterinarias
Carrera: Licenciatura en Tecnología de los Alimentos
Asignatura: Análisis Instrumental
SEMINARIO 5
EXTRACCIÓN CON SOLVENTES - CROMATOGRAFÍA
1) Un soluto A tiene un coeficiente de partición de 3 entre tolueno y agua (K = [A] org / [A]aq). Suponga
que 100 mL de una solución acuosa 0,01 M de A se extrae con tolueno. ¿Qué molaridad de A
resulta en la fase acuosa y qué porcentaje de A será extraído luego de: a) una extracción con 500
mL de tolueno, b) 5 extracciones con 100 mL de tolueno c/u y c) 10 extracciones con 50 mL de
tolueno c/u. Rtas. a) 93,75 %, 625 M; b) 99,90 %, 9,76 M; c) 99,99 %, 1,05 M
2) Dos extracciones realizadas con 25 mL de un solvente orgánico c/u, lograron remover el 89 % del
total de un soluto contenido en 100 mL de una solución acuosa. Calcule el coeficiente de partición
del soluto entre ambos solventes. Rta. 8,06
3) Suponga que el coeficiente de partición de una amina B (base de Lewis: B: + H+ <==>BH+) es K = 3,0
y que la constante de la base es 1 x 109. Si 50 mL de una solución acuosa 0,01 M de la amina se
extraen con 100 mL de solvente ¿Cuál será la concentración remanente de la amina en la solución
acuosa cuando: a) pH=10,0 y b) pH=8,0. ¿A qué pH es más efectiva la extracción y por qué? Rtas.
a) 0,00155 M; b) 0,00647 M
4) Un ácido HA tiene un coeficiente de partición de 12 entre un solvente orgánico y agua. A pH=4,0 se
extrae exactamente la mitad del ácido mediante un volumen del solvente igual al de la solución
acuosa. Calcule la constante de disociación del ácido. Rta. Ka = 1,1 x 10-3
5) Seleccione la mejor respuesta
a) En cromatografía, una sustancia con coeficiente de partición K = 0 puede utilizarse para estimar:
i) volumen que ocupa dentro de la columna el material de empaque
ii) volumen total de la columna
iii) volumen entre puntos de inyección y detección, excluyendo el de la fase estacionaria
iv) volumen de los poros del material de empaque
v) volumen dentro de la columna disponible para la fase móvil
b) ¿Cuál de los siguientes factores no tendrá efecto en la práctica sobre el volumen de retención de
un soluto en cromatografía gas-líquido?
i) cambio en la velocidad de flujo de la fase móvil gaseosa (gas portador)
ii) aumento del 5 al 10 % de la masa de fase estacionaria en el empaque de la columna
iii) aumento en la temperatura de la columna
iv) cambio en la naturaleza de la fase estacionaria líquida
Análisis Instrumental. Seminario 5 – Pág. 1
c) El mejor parámetro para cuantificar un soluto óptimamente separado mediante cromatografía
líquida es:
i) área de la banda de elución
ii) ancho de la línea de base de la banda de elución
iii) altura de la banda de elución
iv) volumen de retención
d) El límite de detección de un soluto en cromatografía líquida depende de:
i) tipo de proceso de distribución del soluto entre las fases
ii) sensibilidad y nivel de ruido del detector
iii) diámetro de la columna
iii) longitud de la columna
iv) sensibilidad inherente al método de detección empleado
v) volumen inyectado de muestra
6) Una mezcla de benceno, tolueno y metanol (solvente) se inyectan en un cromatógrafo gaseoso. El
metanol eluye en la forma de un pico agudo a los 42 s, mientras que el benceno requiere 251 s y el
tolueno 333 s. Hallar: a) tiempo de retención ajustado y factor de capacidad para cada soluto y b)
retención relativa de ambos solutos. Rtas. a) benceno: t’r= 209 s, k’= 4,98; tolueno: t’r= 291 s, k’=
6,93 b) 1,4
7) Un solvente pasa a través de una cierta columna en 180 s, mientras que un soluto A requiere de 9
min para atravesarla a) calcular el factor de capacidad, b) calcular el coeficiente de partición
sabiendo que el volumen de la fase estacionaria es 1/10 del volumen de la fase móvil en la
columna c) ¿qué fracción del tiempo se encuentra el soluto en la fase móvil dentro de la columna?
Rtas. a) 2 b) 0,2 c) 0,5
8) Considere una columna cromatográfica en la que Ve = Vm/5. Hallar el factor de capacidad de un
soluto X en el caso que la constante de reparto del mismo sea: a) K = 3 y b) K = 30. Interprete los
resultados. Rtas. a) 15 b) 150
9) El volumen de retención de un soluto en una columna dada es 76,2 mL. Si Vm = 16,6 mL y Ve = 12,7
mL. Calcular el coeficiente de partición y el factor de capacidad para dicho soluto. Rtas. k’= 5, K=
3,82
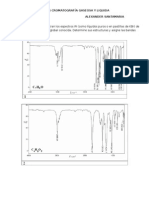
10) A partir del siguiente cromatograma, calcule: a) volumen de elución de cada soluto, b) volumen
muerto, c) factor de capacidad de cada soluto, d) ancho de pico en la base de ambos solutos (en
unidades de volumen y tiempo), e) factor de separación, f) resolución entre ambos analitos, g)
eficiencia de la columna, h) altura equivalente de plato teórico media, i) factor de capacidad para
cada soluto, en el caso que se duplicara la longitud de la columna. Rtas. a) 16,5 mL y 18,7 mL, b)
2,8 mL, c) 4,9 y 5,6, d) 4 min /1,5 mL y 5,9 min/2,2 mL, e) 1,16, f) 1,2, g) 1550
Análisis Instrumental. Seminario 5 – Pág. 2
Solvente A B
11) a) Escriba la relación entre , k1’ y k2’ para dos picos cromatográficos. b) Calcule el número de
platos teóricos necesarios para alcanzar un resolución de 1,0 si: i) = 1,05 y k2’= 5,00; ii) = 1,10 y
k2’= 5,00 y iii) = 1,05 y k2’= 10,00. c) ¿Cómo podría incrementar N, y k2’ en la práctica? d) en
este problema, qué variable tiene mayor efecto sobre la resolución, o k2’?
12) Completar la siguiente tabla:
NB kB R
100000 1,05 0,50
10000 1,10 1,50
10000 4,0 1,00
1,05 3,0 1,75
13) Los siguientes cromatogramas se obtuvieron para los compuestos A y B, utilizando en ambos el
mismo caudal y dos columnas de igual longitud:
a) ¿Qué columna tiene más platos teóricos?
b) ¿Qué columna tiene mayor altura de plato?
c) ¿Qué columna brinda mayor resolución?
d) ¿Qué columna brinda mayor retención relativa?
e) ¿Qué compuesto tiene mayor factor de capacidad?
f) ¿Qué compuesto tiene mayor coeficiente de reparto?
Análisis Instrumental. Seminario 5 – Pág. 3
14) En una columna de sílice para HPLC se encuentra que un soluto eluye prácticamente con el frente
del solvente cuando la composición de la fase móvil es hexano cloroformo 50 % v/v. a) ¿Con qué
modo de cromatografía líquida está trabajando? b) ¿Cómo modificaría la composición de la fase
móvil para obtener una retención aceptable?
15) En una columna de trimetilsilano (TMS) para HPLC un soluto eluye a los 30 minutos si la fase
móvil es metanol-agua 10% v/v. a) ¿Con qué modo de cromatografía líquida está trabajando? b)
¿Cómo modificaría la composición de la fase móvil para disminuir el tiempo de retención?
16) Un soluto con un tr de 407 s eluye de una columna de 12,2 m de longitud en la forma de un pico
con un ancho en la base de 13 s. Encuentre el número de platos teóricos y la altura de los mismos.
Rtas. 1,56 x 104 y 0,78 mm
17) Los siguientes datos corresponden a una columna para cromatografía líquida:
Longitud del relleno 24,7 cm
Caudal 0,313 mL/min
V0 1,37 mL
Vol. fase estacionaria 0,164 mL
El cromatograma de una mezcla de especies A, B, C y D obtenido mediante dicha columna,
proporciona los siguientes datos:
Soluto tr (min) wb (seg)
Solvente 3,1 --
A 5,4 25
B 13,3 64
C 14,1 70
D 21,6 103
Calcular:
a) Número de platos teóricos para cada pico. Rtas. 2687, 2487, 2337 y 2533
b) El número de platos medio de la columna.
c) Altura de plato teórico medio de la columna. Rta. 9,8 x 10-3 cm
d) El factor de capacidad para cada soluto. Rtas. 0,74; 3,3; 3,5 y 6,0
e) La constante de distribución para cada soluto. Rtas. 4,4; 19,5; 20,7 y 35,5
f) La resolución entre B y C y entre C y D. Rtas. 0,7 y 5,2
g) La selectividad entre B y C. Rta. 1,08
h) La longitud de columna necesaria para tener una resolución de 1,5 entre B y C. Rta. 1,06 m
18) Dos solutos tienen una retención relativa =1,08 y factores de capacidad de 5,0 y 5,4,
respectivamente. Asumiendo que el número de platos teóricos es prácticamente el mismo para
ambos compuestos, a) ¿Cuántos platos teóricos son necesarios para obtener una resolución de
1,5 entre ellos? ¿y de 3,0? b) Si la altura de plato teórico media es 0,20 mm, qué longitud debería
tener la columna en cada caso? Rtas. a) 9216 y 36864; b) 18,4 cm y 73,7 cm
19) La siguiente figura muestra los cromatogramas correspondientes a 5 estándares y una muestra.
Cada estándar y la muestra contienen la misma concentración de un estándar interno, la cual es
de 2,5 mg/mL. Para los 5 estándares, las concentraciones del analito son: 0,20 mg/mL; 0,40
Análisis Instrumental. Seminario 5 – Pág. 4
mg/mL; 0,60 mg/mL; 0,80 mg/mL; y 1,00 mg/mL, respectivamente. Determine la concentración
del analito en la muestra : a) ignorando el estándar interno y creando una curva de calibración de
estándar externo y b) creando una curva de calibración de estándar interno. Use las alturas de
los picos en lugar de las áreas.
20) La concentración de los hidrocarburos aromáticos policíclicos (HAPs) en el suelo son
determinados, primeramente extrayéndolos con cloruro de metileno. El extracto se diluye, de ser
necesario, y los HAPs se separan mediante HPLC utilizando un detector de fluorescencia UV/V. La
calibración se consigue usando uno o más estándares externos. En un análisis típico, una muestra
seca de 2,013 g de suelo se extrae con 20 mL de cloruro de metileno. Luego de filtrar, una
alícuota de 1,00 mL del extracto se diluye a 10,00 mL con acetonitrilo. Al inyectar 5 L del
extracto diluido en la columna cromatográfica, se obtiene una señal de 0,217 (unidades
arbitrarias) para el HAP fluoranteno. Cuando 5 L de un estándar 20 ppm de fluoranteno se
analiza bajo las mismas condiciones, se obtiene una señal de 0,258. Calcule el contenido de
fluoranteno en el suelo analizado en ppm (base seca). Rta. 1671 ppm
21) La concentración de cafeína en bebidas puede determinarse por HPLC de fase reversa, utilizando
como fase móvil una mezcla de acetonitrilo/agua 20:80 y una columa de octilsilano. Los
resultados de una serie de inyecciones de 10 L de estándares de cafeína se muestran en la
siguiente tabla:
[cafeína] área del pico
(mg/L) (unidades arbitrarias)
50.0 226 724
100.0 453 762
125.0 559 443
250.0 1 093 637
¿Cuál es la concentración de cafeína en una muestra de una bebida, si al inyectar 10 L de la
misma en el sistema cromatográfico descripto se obtiene un pico de área 424 195? Rta. 95,3 ppm
Análisis Instrumental. Seminario 5 – Pág. 5
22) La concentración de residuos de pesticida en productos frutícolas, tales como naranjas, puede
determinarse mediante CG-EM. Los residuos son extraídos de las muestras usando cloruro de
metileno, concentrando y evaporando luego el solvente. La calibración se lleva a cabo usando
antraceno como estándar interno. En un estudio para determinar las ppb de heptacloro epóxido
en naranjas, 50,0 g de corteza de naranjas se muelen y extraen con 50,00 mL de cloruro de
metileno, Luego de filtrar, se evapora parte del solvente y se le agrega una cantidad conocida del
estándar interno, diluyéndose finalmente a 10,00 mL. El análisis de la muestra dio una relación
(área de analito/área de estándar interno) de 0,108. Por otro lado, una serie de estándares de
calibración, cada uno conteniendo la misma cantidad de antraceno que la muestra, arrojó los
siguientes resultados:
Calcule los ng/g de heptacloro epóxido en las cortezas de las naranjas. Rta. 7,6 ng/g
23) Suponga que necesita separar una mezcla de ácido benzoico, aspartamo y cafeína en una bebida
gaseosa. Ud. dispone de la siguiente información:
a) Explique los cambios en la retención de cada compuesto.
b) Grafique tiempo de retención vs. pH para cada compuesto y decida a qué pH realizaría la
separación.
24) La composición de una tableta multivitamínica se determina convenientemente usando HPLC con
un detector UV-V de arreglo de diodos. Una muestra estándar conteniendo: 170 ppm de
vitamina C, 130 ppm de niacina, 120 ppm de niacinamida, 150 ppm de piridoxina, 60 ppm de
tiamina, 15 ppm de ácido fólico, y 10 ppm de riboflavina se inyecta en el equipo, generando
señales (en unidades arbitrarias) de, respectivamente: 0,22; 1,35; 0,90; 1,37; 0,82; 0,36, y 0,29.
La muestra de una tableta se prepara para el análisis moliéndola en mortero y transfiriendo el
polvo resultante a un erlenmeyer que contiene 10 mL de una solución de NH4OH al 1% v/v en
dimetil sulfóxido. Luego de sonicar en un baño (para facilitar la disolución) se adicionaron 90 mL
de ácido acético al 2% y se agitó y sonicó. El extracto luego se filtró por una membraba de 0,45
m de poro y se llevó a volumen en matraz aforado de 100 mL. La solución resultante se inyecta
en el equipo, resultando señales de 0,87 para vitamina C, 0,00 para niacina, 1,40 para
niacinamida, 0,22 para piridoxina, 0,19 para tiamina, 0,11 para ácido fólico y 0,44 para
riboflavina. Informe los mg de cada vitamina en la tableta.
Análisis Instrumental. Seminario 5 – Pág. 6
25) A continuación se describe un método para la determinación cuantitativa de vitamina A en
alimentos, utilizando HPLC de fase reversa mediante adición de estándar. 10,067 g de un cereal
se coloca en un erlenmeyer junto con 1 g de ascorbato de sodio, 40 mL de etanol, y 10 mL of KOH
al 50% m/v. Luego de un reflujo durante 30 min, se adicionan 60 mL de etanol y la solución se
enfría a T ambiente. La vitamin A se extrae usando tres porciones de hexano de 100 mL cada
una. Los extractos se combinan y se evapora a sequedad. El residuo se disuelve con metanol en
un matraz aforado de 5 mL. Una solución estándar se prepara de manera similar usando 10,093 g
de la muestra del cereal y adicionando 20 g de vitamina A. Al inyectar la muestra problema y el
estándar en el equipo de HPLC, se obtuvieron áreas de pico de 6,77 × 103 y de 1,32 × 104,
respectivamente. Calcule el contenido de vitamina A en la muestra en mg/100 g cereal.
Análisis Instrumental. Seminario 5 – Pág. 7
S-ar putea să vă placă și
- Dinámica De Fluidos Computacional Para IngenierosDe la EverandDinámica De Fluidos Computacional Para IngenierosEvaluare: 4 din 5 stele4/5 (1)
- Dinámica de estructuras: Sistemas de un grado de libertadDe la EverandDinámica de estructuras: Sistemas de un grado de libertadEvaluare: 4.5 din 5 stele4.5/5 (4)
- Guia Cromatografia Final 2018Document18 paginiGuia Cromatografia Final 2018Milu Ycyry AlvarezÎncă nu există evaluări
- Guia TA Cromatografia 2017 Definitiva PDFDocument17 paginiGuia TA Cromatografia 2017 Definitiva PDFJenniferTorreÎncă nu există evaluări
- 2do Parcial Analisis InstrumentalDocument3 pagini2do Parcial Analisis InstrumentalFer SalasÎncă nu există evaluări
- Ejercicios Del Taller de Desarrollo AnalíticoDocument36 paginiEjercicios Del Taller de Desarrollo AnalíticoBrayan José Castro GutiérrezÎncă nu există evaluări
- Espectroscopia de Absorcion Atómica y FlamometriaDocument14 paginiEspectroscopia de Absorcion Atómica y FlamometriaMelizza Bm0% (1)
- Practica 7 Cromatografia Metodos de Separacion y Normalizacion de Areas, Patrones Internos PDFDocument13 paginiPractica 7 Cromatografia Metodos de Separacion y Normalizacion de Areas, Patrones Internos PDFJuanÎncă nu există evaluări
- Clase 19-20 CromatografiaDocument19 paginiClase 19-20 CromatografiaJean Piero Bocanegra0% (1)
- Unidad III Métodos CromatográficosDocument5 paginiUnidad III Métodos CromatográficosAnonymous SiO8gwwRtoÎncă nu există evaluări
- Problem A RioDocument55 paginiProblem A RioHumberto Villa Sanchez100% (1)
- Cromatografía Ejercicios 2019-20Document23 paginiCromatografía Ejercicios 2019-20javier saizÎncă nu există evaluări
- Deber de Cromat. de Gases Marzo - Agosto 06-06-2019Document4 paginiDeber de Cromat. de Gases Marzo - Agosto 06-06-2019vladymirÎncă nu există evaluări
- Taller 3. Principios CromatografiaDocument4 paginiTaller 3. Principios CromatografiaLAURA JULIANA GAMBOA RODRIGUEZÎncă nu există evaluări
- GUÍA EJERCICIOS CromatografiaDocument8 paginiGUÍA EJERCICIOS CromatografiaFrancisca F Pizarro CorbalanÎncă nu există evaluări
- Guia 3 Cuanti Ii-2019Document13 paginiGuia 3 Cuanti Ii-2019Rodriguez Coariti Dayana AnahiÎncă nu există evaluări
- Cromatografia 2014Document13 paginiCromatografia 2014William Beder Sandi ChavezÎncă nu există evaluări
- Ejercicio de IR y CromatografiaDocument13 paginiEjercicio de IR y CromatografiaKelly CamargoÎncă nu există evaluări
- Problemario 3er ParcialDocument6 paginiProblemario 3er ParcialokÎncă nu există evaluări
- Guia de Problemas Metodos Separativos - 2015yesiDocument8 paginiGuia de Problemas Metodos Separativos - 2015yesiyesicaÎncă nu există evaluări
- Taller 3. Principios Cromatografia PDFDocument4 paginiTaller 3. Principios Cromatografia PDFNatalia GonzalezÎncă nu există evaluări
- Problemas Cromatografía Tema 13.Document3 paginiProblemas Cromatografía Tema 13.Danilo Tapia SalazarÎncă nu există evaluări
- Problemas de CromatografíaDocument23 paginiProblemas de CromatografíaJefanny Jaouhari0% (1)
- Serie de ProblemasCromatografíaDocument3 paginiSerie de ProblemasCromatografíaDavid Nieves CamañoÎncă nu există evaluări
- 7-Cromatografia Problemas ResueltosDocument10 pagini7-Cromatografia Problemas ResueltosDavid Meza Carbajal57% (7)
- Problemario Cromatografia 2010ADocument21 paginiProblemario Cromatografia 2010ASamir Castolo Sanchez100% (1)
- Serie de Cromatografía de Gases y Líquidos 19-2Document4 paginiSerie de Cromatografía de Gases y Líquidos 19-2danielÎncă nu există evaluări
- Preguntas y ProblemasDocument3 paginiPreguntas y ProblemasMaria Guadalupe Garcia SanchezÎncă nu există evaluări
- Solucin de Problema de Cromatografia SkoogDocument2 paginiSolucin de Problema de Cromatografia SkoogAlex ExpenserÎncă nu există evaluări
- Ejercicios Deber 2Document5 paginiEjercicios Deber 2PAUL JHERSON CARCAHUSTO TUMBILLOÎncă nu există evaluări
- Capitulo 24-Tarea de API 62 EjerciciosDocument24 paginiCapitulo 24-Tarea de API 62 EjerciciosJeyson Dueñas Porras100% (2)
- Problemas Rezadados 2106-2Document3 paginiProblemas Rezadados 2106-2Alexander Ccahua ZamoraÎncă nu există evaluări
- Guia Ejercicios Analisis Instrumental N°3-2022Document3 paginiGuia Ejercicios Analisis Instrumental N°3-2022ChasconaÎncă nu există evaluări
- Cuestiones Tema 12Document2 paginiCuestiones Tema 12Ale VazquezÎncă nu există evaluări
- HPLC - Practicas de Laboratorio y Cuestiones Teorico-Practicos Cuarta ParteDocument11 paginiHPLC - Practicas de Laboratorio y Cuestiones Teorico-Practicos Cuarta ParteGiancarlo DlcÎncă nu există evaluări
- Taller 4 CromatografíaDocument3 paginiTaller 4 CromatografíaSantiagoRivasÎncă nu există evaluări
- Tarea 1 PDFDocument6 paginiTarea 1 PDFQalberto01Încă nu există evaluări
- Taller #06Document3 paginiTaller #06NICOLE DORIS UNSIHUAY VILAÎncă nu există evaluări
- Compuesto, Min No Retenida 3.1 - A 5.4 0.41 B 13.3 1.07 C 14.1 1.16 D 21.6 1.72Document5 paginiCompuesto, Min No Retenida 3.1 - A 5.4 0.41 B 13.3 1.07 C 14.1 1.16 D 21.6 1.72tatianaÎncă nu există evaluări
- Ejercicios Sobre CromatografíaDocument10 paginiEjercicios Sobre CromatografíaDiego Alvarez Balladares50% (4)
- Guia 1y2Document4 paginiGuia 1y2Ivan PortugalÎncă nu există evaluări
- Deber de Cromatografía de Gases Segunda Parte Sem. Oct. - Mar. 2021Document2 paginiDeber de Cromatografía de Gases Segunda Parte Sem. Oct. - Mar. 2021Alexandra Mariño0% (1)
- Parcial Simulacro GasesDocument7 paginiParcial Simulacro Gasesestefania salinas jimenezÎncă nu există evaluări
- Guía de Problemas de Física (CNBA 2014) PDFDocument32 paginiGuía de Problemas de Física (CNBA 2014) PDFPepa LuiÎncă nu există evaluări
- Taller CromaDocument2 paginiTaller CromaJack Fernandez LangsÎncă nu există evaluări
- CAPÍTULO 26,27 y 28 Del SkoggDocument25 paginiCAPÍTULO 26,27 y 28 Del SkoggBranco Figueroa Ayala97% (34)
- PROBLEMASCROMATOGRAFIADocument19 paginiPROBLEMASCROMATOGRAFIACristobal Leyva Martinez100% (11)
- Act 10Document47 paginiAct 10Josue Ricardo Urias Lopez100% (6)
- Guia de Ejercicios CromatografiaDocument2 paginiGuia de Ejercicios CromatografiaSantiagoRivasÎncă nu există evaluări
- Balance de Materia ProblemasDocument33 paginiBalance de Materia ProblemasClavi 11 Champ100% (1)
- Curso HPLCDocument88 paginiCurso HPLCJesus AltamiranoÎncă nu există evaluări
- Ejemplo ParcialDocument1 paginăEjemplo ParcialDaniela Franco OsorioÎncă nu există evaluări
- Serie 10-QA-2019Document4 paginiSerie 10-QA-2019Candela LunaÎncă nu există evaluări
- 1º Examen de QuimicaDocument4 pagini1º Examen de QuimicaRamiro Q LluscoÎncă nu există evaluări
- Ejercicios Espectrofotometria 02Document3 paginiEjercicios Espectrofotometria 02Leonardo GiraldoÎncă nu există evaluări
- 2008 S 07 ExtraccionDocument2 pagini2008 S 07 ExtraccionGregorio Antonio Valero VerdeÎncă nu există evaluări
- Principios de transferencia de cantidad de movimientoDe la EverandPrincipios de transferencia de cantidad de movimientoÎncă nu există evaluări
- Problemas resueltos de Hidráulica de CanalesDe la EverandProblemas resueltos de Hidráulica de CanalesEvaluare: 4.5 din 5 stele4.5/5 (7)
- Introducción a los sistemas de flujo: Material de clase para mecánica de fluidosbiaDe la EverandIntroducción a los sistemas de flujo: Material de clase para mecánica de fluidosbiaÎncă nu există evaluări
- Nuevo 333Document7 paginiNuevo 333Gabrielitha Keit SanzÎncă nu există evaluări
- Determinacion de HierroDocument1 paginăDeterminacion de HierroGabrielitha Keit SanzÎncă nu există evaluări
- Ejericicios FicoDocument21 paginiEjericicios FicoGabrielitha Keit SanzÎncă nu există evaluări
- Problemas 26-30Document3 paginiProblemas 26-30Gabrielitha Keit SanzÎncă nu există evaluări
- Taller de OrganometalicaDocument4 paginiTaller de OrganometalicaGabrielitha Keit SanzÎncă nu există evaluări
- Historia de Los Entornos Virtuales de AprendizajeDocument31 paginiHistoria de Los Entornos Virtuales de AprendizajeGabrielitha Keit SanzÎncă nu există evaluări
- Actividad 1 - Saúl AguilarDocument11 paginiActividad 1 - Saúl AguilarSaúl AlejandroÎncă nu există evaluări
- ASLDASDocument12 paginiASLDASMiguel RodriguezÎncă nu există evaluări
- Adición y Sustracción de Números Reales para Tercero de SecundariaDocument3 paginiAdición y Sustracción de Números Reales para Tercero de SecundariaProf: Carlos CheroÎncă nu există evaluări
- Tarea 2Document12 paginiTarea 2asdasdasÎncă nu există evaluări
- Metodología de La Investigación Filológica en El Mundo Hispánico PDFDocument3 paginiMetodología de La Investigación Filológica en El Mundo Hispánico PDFMaríaGómezMesasÎncă nu există evaluări
- El Teorema de Residuos Calculo IntegralesDocument2 paginiEl Teorema de Residuos Calculo IntegralesAnonymous o0S9HsqÎncă nu există evaluări
- Sistemas DinamicosDocument195 paginiSistemas DinamicosImagyred MxÎncă nu există evaluări
- 2.teoria de Eroores-MediaDocument57 pagini2.teoria de Eroores-MediaBrayan CZ xKaOtiiKÎncă nu există evaluări
- Práctico 11 - Gal 1 FingDocument3 paginiPráctico 11 - Gal 1 FingBrigitte AshtonÎncă nu există evaluări
- TEMARIO Cálculo Diferencial e IntegralDocument3 paginiTEMARIO Cálculo Diferencial e IntegralDanielToOdellswanckÎncă nu există evaluări
- Analisis Basico de Variable ComplejaDocument565 paginiAnalisis Basico de Variable Complejamickef820% (1)
- TAREA 3-Aplicaciones de Las Integrales.Document33 paginiTAREA 3-Aplicaciones de Las Integrales.Melisa TarazonaÎncă nu există evaluări
- Actividad 1Document3 paginiActividad 1andresÎncă nu există evaluări
- Informe Mediciones Potenciometricas de PHDocument20 paginiInforme Mediciones Potenciometricas de PHmiguel angelÎncă nu există evaluări
- Capitulo 5Document22 paginiCapitulo 5Fidel ParedesÎncă nu există evaluări
- Tarea de Fundamentos de Investigacion 11Document5 paginiTarea de Fundamentos de Investigacion 11Victor Hugo GonzalezÎncă nu există evaluări
- Trabajo FinalDocument23 paginiTrabajo FinalRobin Vera100% (1)
- Informe Volumetría Ácido-Base - Análisis de FosfatosDocument15 paginiInforme Volumetría Ácido-Base - Análisis de FosfatosDilan ZapataÎncă nu există evaluări
- Guía 1 IntegralesDocument7 paginiGuía 1 IntegralessikarioÎncă nu există evaluări
- Parcial 2 - Corte II - Análisis Estructural 2021Document5 paginiParcial 2 - Corte II - Análisis Estructural 2021Juan Pablo GMÎncă nu există evaluări
- Cuest-Mat-II ParcialDocument13 paginiCuest-Mat-II ParcialGustavo Robles100% (2)
- Certificado de Calidad Hidol P 1000Document5 paginiCertificado de Calidad Hidol P 1000dario acasioÎncă nu există evaluări
- Soluciòn Ejercicio 5 - Análisis NuméricoDocument10 paginiSoluciòn Ejercicio 5 - Análisis Numéricoabel alexis torres veraÎncă nu există evaluări
- Ejercicios Longitud de ArcoDocument6 paginiEjercicios Longitud de ArcoHuancasKevinÎncă nu există evaluări
- Actividad HPLCDocument7 paginiActividad HPLCleotatanÎncă nu există evaluări
- 01 Medición y Teoria de Errores CFIS328 - Parte 1Document10 pagini01 Medición y Teoria de Errores CFIS328 - Parte 1Patricia Valdebenito PanesÎncă nu există evaluări
- Alonso-Métodos de Enseñanza de Lectura y EscrituraDocument11 paginiAlonso-Métodos de Enseñanza de Lectura y Escrituragise megÎncă nu există evaluări
- INFORMEDocument25 paginiINFORMEEver Bryan GutierrezÎncă nu există evaluări
- Cuadernillo No.3 Nov.-21Document4 paginiCuadernillo No.3 Nov.-21Rafael Gtz TÎncă nu există evaluări
- Matematicas Act. 1Document10 paginiMatematicas Act. 1Ramses VelazquezÎncă nu există evaluări