Documente Academic
Documente Profesional
Documente Cultură
Deber Esterilización Jorge Núñez
Încărcat de
Jorge Andrés NuñezDescriere originală:
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Deber Esterilización Jorge Núñez
Încărcat de
Jorge Andrés NuñezDrepturi de autor:
Formate disponibile
ESCUELA POLITÉCNICA NACIONAL
FACULTAD DE INGENIERÍA QUÍMICA Y AGROINDUSTRIA
DEBER DE BIOINGENIERÍA
NOMBRE: Jorge Andrés Núñez Morales
CURSO: 8vo semestre
FECHA: Quito, a 21 de febrero del 2018
TEMA: Ejercicio referente a tiempo de esterilización
Se ha determinado el número de células viables de Bacillius subtilis en función del
tiempo y de la temperatura
Determinar la energía de activación y la cte de Arrhenius.
El valor de k a 100 ºC
Estimar el tiempo necesario para destruir el 99% de células a 100 ºC.
De acuerdo a los datos experimentales de número de células se obtuvo el k para
cada temperatura siendo No el valor en celeste y Nf el valor en amarillo para cada
temperatura.
tiempo 85 90 110 120
0 2400000000 2400000000 2400000000 2400000000
0,5 2380000000 2380000000 1080000000 20500000
1 2370000000 2300000000 480000000 175000
1,5 2290000000 220000000 1300
2 2330000000 2210000000 98500000
3 2320000000 2170000000 20100000
4 2280000000 2120000000 4410000
6 2200000000 1950000000 162000
8 2190000000 1870000000 6880
9 2160000000 1790000000
𝑁𝑜
Se determinó el k para cada temperatura de acuerdo a la ecuación 𝑘 = ln(𝑁𝑓) y
los resultados se muestran en la Tabla 2.
Tabla 2. k calculado para cada temperatura
In (No/N) In (No/N) In (No/N) In (No/N)
85 90 110 120
0,0915 0,249 9,603 14,428
A continuación con los valores obtenidos de k para cada temperatura se graficó
ln k vs 1/T de acuerdo a la los resultados de la Tabla 3
Tabla 3. Valores de ln k y 1/T para la obtención de la gráfica ln(k) vs 1/T
LN (k) 1/T (°C) T °C
-4,587 0,0027 85
-3,585 0,0027 90
0,182 0,00261 110
2,263 0,00254 120
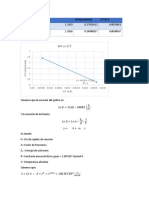
Se obtuvo la gráfica ln(k) vs 1/T como se muestra a continuación
In k vs 1/T
3
0
0.0025 0.00255 0.0026 0.00265 0.0027 0.00275 0.0028 0.00285
Ln (k)
-1
-2
-3
-4 y = -27258x + 71.508
R² = 0.9987
-5
1/T (1/°C)
Figura 1. gráfica ln(k) vs 1/T
La ecuación de la recta es y = -27258x + 71,508
Donde la Energía de activación es igual a:
𝐽
𝐸𝑎 = 𝑚 ∗ 8,314
𝑚𝑜𝑙
𝐽 𝐽
𝐸𝑎 = −27258 ∗ 8,314 = 226623,012
𝑚𝑜𝑙 𝑚𝑜𝑙
Y la constante b es igual a ln(A) por lo tanto:
ln(𝐴) = 71,502 ∴ 𝐴 = 1,12 ∗ 1031
Con los valores obtenidos de Ea y A se puede obtener la energía de activación a
100 °C con la ecuación de Arrhenius:
−𝐸𝑎
𝑘 =𝐴∗𝑒 𝑅𝑇
−226623,012𝐽/𝑚𝑜𝑙
𝐽
8,314 ∗373𝐾
𝑘 = 1,12 ∗ 1031 ∗ 𝑒 𝑚𝑜𝑙𝐾
𝑘 = 0,206𝑚𝑖𝑛−1
Para eliminar el 99% de células viables se realizó el siguiente cálculo del tiempo
necesario t
𝑁𝑓 2400000000 − 2376000000
ln ( ) = ln ( ) = −4,605
𝑁𝑜 2400000000
𝑁𝑓
(𝑁𝑜 ) −4,605
𝑡 = ln = = 22,26𝑚𝑖𝑛
𝑘 0,206𝑚𝑖𝑛−1
S-ar putea să vă placă și
- Problemas resueltos de Hidráulica de CanalesDe la EverandProblemas resueltos de Hidráulica de CanalesEvaluare: 4.5 din 5 stele4.5/5 (7)
- Dependencia de La Fuerza Electromotriz Con La Temperatura Fico II XDDocument13 paginiDependencia de La Fuerza Electromotriz Con La Temperatura Fico II XDChristian Cesar Alcantara JuarezÎncă nu există evaluări
- Ausfelder Trude - Mobbing El Acoso Moral en El TrabajoDocument93 paginiAusfelder Trude - Mobbing El Acoso Moral en El TrabajoGerman HornaÎncă nu există evaluări
- La Prueba PericialDocument39 paginiLa Prueba PericialFecsa CjpÎncă nu există evaluări
- Convenio Minamata PDFDocument12 paginiConvenio Minamata PDFAndrés Vela100% (1)
- Cinética QuímicaDocument7 paginiCinética QuímicaJorge Ariel VeraÎncă nu există evaluări
- Bioética: Historia, Principios y CorrientesDocument29 paginiBioética: Historia, Principios y CorrientesValentina Andrea CáceresÎncă nu există evaluări
- Congreso Estudiantil de Ciencias PolíticasDocument9 paginiCongreso Estudiantil de Ciencias PolíticasVladimirCalleÎncă nu există evaluări
- Tarea 5.1 Melissa RodriguezDocument6 paginiTarea 5.1 Melissa RodriguezMelissa Rodriguez100% (2)
- Prueba 8º MCMDocument3 paginiPrueba 8º MCMSebastianHormazabalÎncă nu există evaluări
- Campo eléctrico en condensadorDocument8 paginiCampo eléctrico en condensadorRonaldo Chire DuránÎncă nu există evaluări
- Cómo Lidiar Con Una Persona ManipuladoraDocument4 paginiCómo Lidiar Con Una Persona ManipuladoraqsxfthnkoÎncă nu există evaluări
- Informe Proyecto 2 Matias Navarrete, Brayan PinuerDocument13 paginiInforme Proyecto 2 Matias Navarrete, Brayan PinuerBrayan Pinuer TorrealbaÎncă nu există evaluări
- Ejercicio 8Document7 paginiEjercicio 8Milagros OlazabalÎncă nu există evaluări
- Laboratorio 1 Transferencia de CalorDocument10 paginiLaboratorio 1 Transferencia de CalorRoxangel AdamesÎncă nu există evaluări
- CINETICA COMPLEAS kCACBDocument7 paginiCINETICA COMPLEAS kCACBAna Paola SámanoÎncă nu există evaluări
- RECOBRODocument8 paginiRECOBROCristian Paredes100% (1)
- Ejercicios CinéticaDocument6 paginiEjercicios CinéticaCristian Lugo SalyrosasÎncă nu există evaluări
- Trabajo Espacial 1 - Kinverli UriarteDocument4 paginiTrabajo Espacial 1 - Kinverli UriarteKinverli UriarteÎncă nu există evaluări
- Examen de QuimicaDocument4 paginiExamen de QuimicaMar YÎncă nu există evaluări
- Diseño de Intercambiador de Doble TuboDocument10 paginiDiseño de Intercambiador de Doble TuboPedro RamirezÎncă nu există evaluări
- Practica 5 Fiica 2Document12 paginiPractica 5 Fiica 2Andres CasanovaÎncă nu există evaluări
- Ejercicio de Fisicoquímica, Velocidades y Tiempos de ReacciónDocument2 paginiEjercicio de Fisicoquímica, Velocidades y Tiempos de ReacciónTony MárquezÎncă nu există evaluări
- Informe Campo y Potencial ElectricoDocument8 paginiInforme Campo y Potencial ElectricoSamuel Valverde RiosÎncă nu există evaluări
- Informe Campo y Potencial ElectricoDocument8 paginiInforme Campo y Potencial ElectricoSamuel Valverde RiosÎncă nu există evaluări
- Informe 2 Capacitancia Limachi Mujica Abel G.Document9 paginiInforme 2 Capacitancia Limachi Mujica Abel G.Mauricio Rafael Vargas MamaniÎncă nu există evaluări
- Colisiones en Dos DimensionesDocument6 paginiColisiones en Dos DimensionesNiels MolinaÎncă nu există evaluări
- Practica Calificada Diseño R. - FinalizadoDocument6 paginiPractica Calificada Diseño R. - FinalizadoFranklin DelgadoÎncă nu există evaluări
- Aporte Ejercicios 1 2 3 4 5 9sandraDocument10 paginiAporte Ejercicios 1 2 3 4 5 9sandraLucero Forero G.Încă nu există evaluări
- TP ConductividadDocument13 paginiTP ConductividadLorena SartorÎncă nu există evaluări
- Campo ElectricoDocument8 paginiCampo ElectricoLuka Heinrich LevÎncă nu există evaluări
- Segundo Parcial de Fisicoquimic1 ModeloDocument2 paginiSegundo Parcial de Fisicoquimic1 ModeloWendy Guaman MendozaÎncă nu există evaluări
- r1 EJERCICIOSDocument6 paginir1 EJERCICIOSjoseph100% (1)
- Termodinámica: Propiedades del agua, ciclo de refrigeración, cambios de energía e interna y entalpía del metanoDocument5 paginiTermodinámica: Propiedades del agua, ciclo de refrigeración, cambios de energía e interna y entalpía del metanoIsaac SolorioÎncă nu există evaluări
- Analisis de Resultados, Circuitos RCDocument20 paginiAnalisis de Resultados, Circuitos RCYULIANA CHÁVES SUÁREZÎncă nu există evaluări
- 01 Primera Evaluación Tuni Huanca FernandoDocument5 pagini01 Primera Evaluación Tuni Huanca Fernandofrancisco rodriguezÎncă nu există evaluări
- Varon Gutierrez Andres Enrique. Primer ParcialDocument6 paginiVaron Gutierrez Andres Enrique. Primer ParcialAndres Varon GutierrezÎncă nu există evaluări
- Ea crecimiento sandíaDocument10 paginiEa crecimiento sandíaDeivis GutierrezÎncă nu există evaluări
- TaniaCadena Fase 3. 2Document12 paginiTaniaCadena Fase 3. 2Esteban IsazaÎncă nu există evaluări
- Práctica No. 3 - Lab. de Física EM-CBF212LDocument10 paginiPráctica No. 3 - Lab. de Física EM-CBF212LAmbar SantanaÎncă nu există evaluări
- LN KDocument2 paginiLN KDiana MoedanoÎncă nu există evaluări
- Reacciones ComplejasDocument26 paginiReacciones ComplejasErika Itzel C AÎncă nu există evaluări
- ASIGNACIONDocument4 paginiASIGNACIONEdinson AnilloÎncă nu există evaluări
- Evaporador Múltiple EfectoDocument49 paginiEvaporador Múltiple EfectoGONZALO MARQUEZ LIZARDOÎncă nu există evaluări
- Informe 3 Carrion Criollo Reyes VacaDocument19 paginiInforme 3 Carrion Criollo Reyes VacaSantiago DavidÎncă nu există evaluări
- Dinamica - VibracionesDocument19 paginiDinamica - VibracionesAbel Illesca AparicioÎncă nu există evaluări
- Informe Electrotecnia 1Document11 paginiInforme Electrotecnia 1Kawah Kevin MaxÎncă nu există evaluări
- Cuestionario 2 MEDDocument8 paginiCuestionario 2 MEDMadeline MedinaÎncă nu există evaluări
- Willmer Morales V12539540 - TSP1 - 326Document7 paginiWillmer Morales V12539540 - TSP1 - 326Willmer Morales100% (1)
- Ingeniería IndustrialDocument15 paginiIngeniería IndustrialRoselynTaylorMcCarthyÎncă nu există evaluări
- Christian Giovanni Cobo Criollo EjerciciDocument15 paginiChristian Giovanni Cobo Criollo EjerciciluisacarolinaÎncă nu există evaluări
- Cap3 - IncroperaDocument196 paginiCap3 - IncroperaJuan-pablo Malitaxi-urresta67% (3)
- Guia de Laboratorio - Ley de CoulombDocument14 paginiGuia de Laboratorio - Ley de CoulombRAMIRO ALBERTO MARRUGO HERRERAÎncă nu există evaluări
- Taller 1Document3 paginiTaller 1Angie FuentesÎncă nu există evaluări
- Tarea 4Document6 paginiTarea 4Krugger CossioÎncă nu există evaluări
- RECUPERATORIOS SolucionarioDocument5 paginiRECUPERATORIOS SolucionarioJhon FlorÎncă nu există evaluări
- Fase 3 - Plantear Solucion A Problemas - Rudy - LassoDocument12 paginiFase 3 - Plantear Solucion A Problemas - Rudy - LassoAndres LassoÎncă nu există evaluări
- David VeraDocument8 paginiDavid VeraBeatriz mendozaÎncă nu există evaluări
- Fisica UpcDocument3 paginiFisica UpcAlejandro Gallardo MedinaÎncă nu există evaluări
- Diseño de Reactores 2Document4 paginiDiseño de Reactores 2Raul Obando Cayllahua MendozaÎncă nu există evaluări
- Reporte 6. FICO IV PDFDocument8 paginiReporte 6. FICO IV PDFDaniel Pascual NZÎncă nu există evaluări
- Humidificación 03Document36 paginiHumidificación 03Flavio AgustoÎncă nu există evaluări
- Informe Final 4 Electricos 2Document11 paginiInforme Final 4 Electricos 2Esteban RojasÎncă nu există evaluări
- Informe 1. Campo y Potencial ElectricoDocument11 paginiInforme 1. Campo y Potencial ElectricoJULIO CESAR HERRERA ROJASÎncă nu există evaluări
- TAREA 1 Programa Rung Kutta ReaccionesDocument4 paginiTAREA 1 Programa Rung Kutta Reaccioneskevin brayan soriano pomayaÎncă nu există evaluări
- Condensador VariableDocument5 paginiCondensador VariableMarco Antonio M T100% (1)
- Control EsDocument2 paginiControl EsJorge Andrés NuñezÎncă nu există evaluări
- Reglamento Importación y Transferencia de Mercurio 25-11-2013Document13 paginiReglamento Importación y Transferencia de Mercurio 25-11-2013Jorge Andrés NuñezÎncă nu există evaluări
- Consulta Refrigeración MandarinaDocument3 paginiConsulta Refrigeración MandarinaJorge Andrés NuñezÎncă nu există evaluări
- BioingenieriaDocument3 paginiBioingenieriaJorge Andrés NuñezÎncă nu există evaluări
- Diagramas de Evans PDFDocument21 paginiDiagramas de Evans PDFJorge Andrés NuñezÎncă nu există evaluări
- Calibración de Tolvas Núñez J.Document2 paginiCalibración de Tolvas Núñez J.Jorge Andrés NuñezÎncă nu există evaluări
- Informe Visita Cervecería Nacional GeorgeDocument6 paginiInforme Visita Cervecería Nacional GeorgeJorge Andrés NuñezÎncă nu există evaluări
- Secado Jhon QuinaluisaDocument6 paginiSecado Jhon QuinaluisaJorge Andrés NuñezÎncă nu există evaluări
- John Wesley HyattDocument8 paginiJohn Wesley HyattJorge Andrés NuñezÎncă nu există evaluări
- Deber Esterilización Jorge NúñezDocument3 paginiDeber Esterilización Jorge NúñezJorge Andrés NuñezÎncă nu există evaluări
- Secado Jhon QuinaluisaDocument6 paginiSecado Jhon QuinaluisaJorge Andrés NuñezÎncă nu există evaluări
- Presentación Wallace CarothersDocument10 paginiPresentación Wallace CarothersJorge Andrés NuñezÎncă nu există evaluări
- Exposición Fermentación Propiónica GeorgeDocument7 paginiExposición Fermentación Propiónica GeorgeJorge Andrés NuñezÎncă nu există evaluări
- Informe Visita Cervecería Nacional GeorgeDocument6 paginiInforme Visita Cervecería Nacional GeorgeJorge Andrés NuñezÎncă nu există evaluări
- Deber Mercadeo NeuromarketingDocument1 paginăDeber Mercadeo NeuromarketingJorge Andrés NuñezÎncă nu există evaluări
- Cadena AgroindustrialesDocument18 paginiCadena AgroindustrialesJorge Andrés NuñezÎncă nu există evaluări
- Calibración de Tolvas Núñez J.Document2 paginiCalibración de Tolvas Núñez J.Jorge Andrés NuñezÎncă nu există evaluări
- FenolftaleínaDocument8 paginiFenolftaleínaDev LoynesÎncă nu există evaluări
- Calculos y Discusión ExtrusiónDocument3 paginiCalculos y Discusión ExtrusiónJorge Andrés NuñezÎncă nu există evaluări
- Laboratorio de Cristalización Ope 2Document5 paginiLaboratorio de Cristalización Ope 2Jorge Andrés NuñezÎncă nu există evaluări
- CopiaDocument24 paginiCopiaJorge Andrés NuñezÎncă nu există evaluări
- Análisis de Regresion LinealDocument4 paginiAnálisis de Regresion LinealJorge Andrés NuñezÎncă nu există evaluări
- Examen Carbón Activado GeorgeDocument6 paginiExamen Carbón Activado GeorgeJorge Andrés NuñezÎncă nu există evaluări
- Análisis Económico Planta Cal P 24Document2 paginiAnálisis Económico Planta Cal P 24Jorge Andrés NuñezÎncă nu există evaluări
- Ejercicio 1Document1 paginăEjercicio 1Jorge Andrés NuñezÎncă nu există evaluări
- Tabla 1.: Datos Resistencia Térmica Del Staphylococcus L3 Proporcionados en El LaboratorioDocument4 paginiTabla 1.: Datos Resistencia Térmica Del Staphylococcus L3 Proporcionados en El LaboratorioJorge Andrés NuñezÎncă nu există evaluări
- Huesitos PDFDocument1 paginăHuesitos PDFJorge Andrés Nuñez33% (3)
- Banco Preguntas Cap. 1 Al 6Document27 paginiBanco Preguntas Cap. 1 Al 6Jorge Andrés NuñezÎncă nu există evaluări
- Comentarios Al Decreto Legislativo 990 Que Modifica La Ley 27337Document10 paginiComentarios Al Decreto Legislativo 990 Que Modifica La Ley 27337Ronald SoberonÎncă nu există evaluări
- Clases DesgrabadasDocument26 paginiClases DesgrabadasMagali RoxanaÎncă nu există evaluări
- Curso SwatDocument2 paginiCurso SwatBraulio ValdiviaÎncă nu există evaluări
- El Cura de SaraguroDocument1 paginăEl Cura de SaraguroCarlos Alberto Rodeiguez mesaÎncă nu există evaluări
- Visión Lógica Del Derecho. Lorenzo Peña-335-419 PDFDocument85 paginiVisión Lógica Del Derecho. Lorenzo Peña-335-419 PDFAlfredo Bernal AlarconÎncă nu există evaluări
- Transversalidad Del CurriculoDocument55 paginiTransversalidad Del CurriculoMariaFernandaDiazRuizÎncă nu există evaluări
- COG M2 Principios Bíblicos de Integridad y de MayordomíaDocument30 paginiCOG M2 Principios Bíblicos de Integridad y de MayordomíawinsorajhuachoÎncă nu există evaluări
- Grupo 8 - ORIGEN FORMACIÓN Y CONSTITUCIÓN DEL SUELO PDFDocument7 paginiGrupo 8 - ORIGEN FORMACIÓN Y CONSTITUCIÓN DEL SUELO PDFCesarÎncă nu există evaluări
- Taller deontología profesionalesDocument5 paginiTaller deontología profesionalesEstefania Giraldo RamirezÎncă nu există evaluări
- Papanicolau: definición, anatomía, indicaciones y recomendacionesDocument9 paginiPapanicolau: definición, anatomía, indicaciones y recomendacionesShirley Maciel Vera MirandaÎncă nu există evaluări
- Modelo de Escrito - Allanamiento A La Demanda 2017Document2 paginiModelo de Escrito - Allanamiento A La Demanda 2017Skorpio_7100% (1)
- Protocolo Investigación: Definición y Pasos (40Document4 paginiProtocolo Investigación: Definición y Pasos (40ArokÎncă nu există evaluări
- EEtt Paramarca OkDocument10 paginiEEtt Paramarca OkJuanito AlcachofaÎncă nu există evaluări
- Diego FamiliaDocument4 paginiDiego FamiliaDiego Alberto Nuñez LauraÎncă nu există evaluări
- Pap Solidario Corregido (1Document18 paginiPap Solidario Corregido (1Gustavo palacio garciaÎncă nu există evaluări
- Evaluación Ciencias 2° Órganos Del Cuerpo.Document4 paginiEvaluación Ciencias 2° Órganos Del Cuerpo.Ale JandraÎncă nu există evaluări
- Funciones vectoriales: operaciones y aplicacionesDocument5 paginiFunciones vectoriales: operaciones y aplicacionesellocolocoÎncă nu există evaluări
- Conceptos Basicos Del Ruido Ambiental PDFDocument31 paginiConceptos Basicos Del Ruido Ambiental PDFJayro Michael AriasÎncă nu există evaluări
- NegociarDocument47 paginiNegociarDavid Andrès Suarez0% (1)
- Vapor WaveDocument4 paginiVapor WaveSalamanca pompilioÎncă nu există evaluări
- 28010209Document16 pagini28010209cesarÎncă nu există evaluări
- Lección #8 M-1 (La Unción Del Espíritu Santo)Document10 paginiLección #8 M-1 (La Unción Del Espíritu Santo)tadrianamg2Încă nu există evaluări
- MIELOMENINGOCELEDocument6 paginiMIELOMENINGOCELEesteba gomezÎncă nu există evaluări