Documente Academic
Documente Profesional
Documente Cultură
Diagrama entálpico: representación del estado de los fluidos condensables
Încărcat de
Junior QuispeDescriere originală:
Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Diagrama entálpico: representación del estado de los fluidos condensables
Încărcat de
Junior QuispeDrepturi de autor:
Formate disponibile
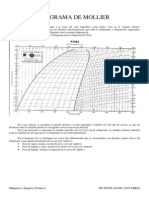
EL DIAGRAMA ENTÁLPICO
En los fluidos condensables la representación más utilizada para definir su estado es el diagrama
entálpico que relaciona su contenido energético con la presión y recoge el estado físico en que
se encuentra, como se muestra en la figura 3.2. Cada fluido condensable tiene su diagrama
entálpico propio.
En el punto “a” el fluido se encuentra en estado líquido. Si se le aporta energía (calor) a presión
constante se calienta, aun entando su entalpia, hasta que llega al punto “b” en cuyo momento
empieza a hervir, encontrándose el sistema en una situación en que de estar en estado líquido
pasa a estar parte en dicho estado y parte en estado de vapor.
A medida que se sigue aportando energía a presión constante va aun entando la cantidad de
fluido que va pasando a la fase vapor hasta llegar al punto “c” en el cual todo el fluido se
encuentra en estado de vapor.
En el tramo “be”, por tanto, el sistema está constituido por una mezcla de fase líquida y fase
vapor. En esta región se cumple la llamada “ley de la palanca”, de forma que en un punto b' se
cumpliría:
Porcentaje en estado líquido𝑥1 =
= Porcentaje en estado de vapor 𝑥2
Siendo el porcentaje en estado líquido más el porcentaje en estado de vapor igual a 100.A partir
del punto “c” todo el sistema está en forma de vapor y cualquier nuevo aporte de energía sirve
para recalentar (aumentar la temperatura) del vapor.
Figura 3.2 Diagrama entálpico de un fluido condensable
REFRIGERANTES
Las características que hay que considerar usualmente a la hora de seleccionar un refrigerante
son:
Punto de ebullición bajo.
Calor latente de vaporización alto.
Punto de congelación bajo.
Temperatura crítica alta.
Baja toxicidad.
Baja inflamabilidad.
Baja corrosividad.
Estable químicamente.
Bajo coste.
Bajo impacto ambiental.
Los refrigerantes más usados han sido el amoníaco y los compuestos dorofluocarbonados
(CFCS). Sin embargo, éstos últimos pueden emigrar a las capas altas de la atmósfera, y su
molécula puede liberar cloro por efecto de la alta tasa de radiación electromagnética existente
y el cloro daña a la capa de ozono. Por esta razón se urgen medidas para la sustitución de los
CFCs después del Protocolo de Monlreal (1987). Entre los compuestos más prometedores están
los HFCS, donde el hidrógeno sustituye al cloro. En el cuadro 3.1 se indican algunas propiedades
de los refrigerantes.
ESTUDIO DEL FRÍO MECÁNICO EN EL DIAGRAMA ENTÁLPICO
Si se tiene un fluido refrigerante, por ejemplo el 𝑁𝐻3 , en estado líquido y a la presión de1 atm,
temperatura será de -33,3 °C (punto de ebullición del NH3 a esa presión). A partir de estas
condiciones podemos estudiar el ciclo de refrigeración en las distintas etapas del sistema de
producción de frío.
A) Evaporador
En la figura 3.3 se utiliza el diagrama entálpico del amoníaco. Se supone que en el m omento de
entrar el amoníaco en el evaporador está en forma líquida a la temperatura de ebullición. Tendrá
una entalpia H 0 y el punto que lo define en el diagrama será el punto 0.
Si se pone en contacto el evaporador de un sistema de frío mecánico con un medio más caliente
(sea el alimento directamente o un fluido intermedio) se va produciendo un paso de energía
(calor) desde ese medio al NH V que lo utilizará como calor latente e irá cambiando de fase basta
evaporarse totalmente y llegar al punto B, sin que haya variado la presión ni la temperatura. Así
pues, en el evaporador se tiene un foco frío permanente de -33,3 °C. La entalpia del 𝑁𝐻3
aumenta hasta 𝐻2 .
Figura 3.3 La etapa de evaporación en el diagrama entálpico.
En el evaporador el refrigerante circula por el interior de serpentines, placas huecas, circuitos
impresos o tubos de aletas construidos con materiales buenos conductores. La transmisión del
calor a través de las paredes tiene lugar según la ecuación general:
𝑞 = 𝑈𝐴(𝑡0 − 𝑡𝑓 )
Donde q es la cantidad de calor transmitida por unidad de tiempo, U el coeficiente global de
transmisión de calor, A la superficie de contacto, 𝑡0 la temperatura del foco caliente y 𝑡𝑓 . La
temperatura del foco frío.
B) Compresor
En forma de vapor el amoníaco ha perdido su capacidad de “producir frío”, por lo que el resto
del circuito debe servir para devolverle a sus condiciones iniciales.
Para ello se comprime a una presión lo suficiente mente alta con o para que su temperatura de
ebullición-condensación sea bastante superior a la del agua corriente. Por ejemplo, a 15 atm, la
temperatura de condensación es 39 °C. Esta compresión no se realiza sin el consiguiente
aumento de entalpia, ya que debido a los rozamientos y fricciones con las paredes y partes
móviles del compresor el 𝑁𝐻3 recibe calor, aumentando su entalpia a H v Se alcanza el punto C
que corresponde al refrigerante comprimido y en estado de vapor recalentado (figura 3.4).
E l compresor realiza un trabajo sobre el refrigerante que se puede calcular a partir del aumento
de entalpia 𝐻3 − 𝐻2 y conociendo el flujo másico m del refrigerante, por la ecuación
𝑞𝑤 = 𝑚(𝐻3 − 𝐻2 )
Figura 3.4 La etapa de compresión en el diagrama entálpico.
C) Condensador
Si en las condiciones de C el refrigerante se pon e en contacto a presión constante con otro
fluido más frío, perderá calor, se enfriará y disminuirá su entalpia alcanzando la curva de
saturación (figura 3.5). Si esta pérdida de calor es suficiente, c] NH3 comenzará a condensar e
incluso pasará todo a fase líquida cuando se alcancen las condiciones del punto D.
Figura 3.5 La etapa do condensación en el diagrama entálpico.
Esto se puede conseguir, por ejemplo, pasando el 𝑁𝐻3 , p o r un serpentín enfriado con agua o
aire a temperatura ambiente, enfriándose el 𝑁𝐻3 por debajo de 39 °C, que es suficiente para
que a 15 atm condense y vuelva al estado líquido.
En el condensador, el flujo de calor 𝑞𝑒 desde el refrigerante al agua, siendo m el flujo másico
del refrigerante y II la entalpia, será igual a:
𝑞𝑒 = 𝑚(𝐻3 − 𝐻4 )
D) Válvula de expansión
La válvula de expansión permite el flujo del refrigerante líquido desde la zona de alta presión a
la de baja y lo regula. La expansión es isentálpica (figura 3.6). Al expansionarse el líquido se
encuentra a una temperatura superior a la que le corresponde en tal estado y se enfría liberando
un calor que es utilizado por el propio líquido en evaporarse parcialmente. En el caso del
amoníaco se enfría a -33,3 °C alcanzando el punto A del diagrama isoentálpico, que corresponde
a un punto en la zona L + V y al ser un proceso isoentálpico𝐻1 = 𝐻4 .
Figura 3.6 La etapa de expansión en el diagrama entálpico.
Se puede observar que nunca se llegará a las condiciones del punto O, en el cual todo el fluido
estaba en forma líquida. Ahora se obtiene una mezcla de líquido y vapor cuyas proporciones
quedan bien definidas por las distancias entre el punto A y las dos ramas de la curva de campana
y de acuerdo con la ley de la palanca. En con secuencia, excepto en la puesta en marcha del
sistema, el ciclo de producción de frío mecánico corresponde al limitado por los puntos ABCD.
Teniendo en cuenta estos límites, el flujo de calor en el evaporador será.
𝑞𝑒 = 𝑚(𝐻2 − 𝐻1 )
Siendo, como se ha indicado anteriormente, m el flujo másico y H la entalpia.
Las, dimensiones de q son de potencia, y se pueden aceptar como la medida de la potencia
enfriadora de la máquina.
A la diferencia de entalpias del refrigerante entre la salida y la entrada del evaporador (𝐻2 −
𝐻1 ) se le llama efecto de refrigeración o carga de refrigeración. Carga de frío o carga de
refrigeración q es la cantidad total de calor que el refrigerante tiene que remover por unidad de
tiempo en el evaporador para conseguir un efecto deseado. El flujo necesario de refrigerante
vendrá dado por
𝑞
𝑚=
𝐻2 − 𝐻1
Por último hay un coeficiente de funcionamiento de la máquina que se mide por la relación
𝐻2 −𝐻1
𝐶. 𝐹 =
𝐻3 −𝐻2
O sea calor removido en el evaporador en relación con el trabajo del compresor.
S-ar putea să vă placă și
- Tema IIIDocument14 paginiTema IIIadnegelÎncă nu există evaluări
- Diagrama de MollierDocument34 paginiDiagrama de MollierMarinely Oviedo100% (1)
- Diagrama de Mollier SolkaneDocument11 paginiDiagrama de Mollier SolkaneCesar Orlando Barria VeraÎncă nu există evaluări
- CongelacionDocument13 paginiCongelacionSara Gmz FdzÎncă nu există evaluări
- Diagrama de MollierDocument24 paginiDiagrama de Mollierfredy málaga100% (5)
- PRÁCTICA 3 Triple EfectoDocument42 paginiPRÁCTICA 3 Triple EfectoJessica Estephany Medina SalceÎncă nu există evaluări
- Apuntes de Curso de Reparación de Aire Acondicionado.Document73 paginiApuntes de Curso de Reparación de Aire Acondicionado.Laureano Navarro75% (4)
- Diagrama de MollierDocument30 paginiDiagrama de Mollierpmm84Încă nu există evaluări
- Ciclo de Carnot InvertidoDocument9 paginiCiclo de Carnot InvertidoDaniel Andy Copa SilvestreÎncă nu există evaluări
- Diagrama de MollierDocument34 paginiDiagrama de MollierandrademaxÎncă nu există evaluări
- Ciclo RealDocument22 paginiCiclo RealVéctor TazoÎncă nu există evaluări
- Circuito de Refrigeración PropanoDocument13 paginiCircuito de Refrigeración PropanoGuillermo BonillaÎncă nu există evaluări
- Presentacion Tema 2Document105 paginiPresentacion Tema 2Íñigo García de ElexaldeÎncă nu există evaluări
- El Ciclo de Refrigeración Por Compresión de VaporDocument26 paginiEl Ciclo de Refrigeración Por Compresión de VaporHeather FieldsÎncă nu există evaluări
- Diagrama de MollierDocument34 paginiDiagrama de Mollier'Susaana CoordoovaÎncă nu există evaluări
- El Ciclo de Refrigeración Por Compresion de VaporDocument6 paginiEl Ciclo de Refrigeración Por Compresion de VaporGIOVANIÎncă nu există evaluări
- Ciclo de Refrigeración Por Compresión de VaporDocument8 paginiCiclo de Refrigeración Por Compresión de VaporMauro PaciaÎncă nu există evaluări
- El Ciclo de Refrigeración Por Compresion de VaporDocument9 paginiEl Ciclo de Refrigeración Por Compresion de VaporKSpeak44Încă nu există evaluări
- Diagrama de Mollier: Guía completa para entender y usar este importante diagrama termodinámicoDocument7 paginiDiagrama de Mollier: Guía completa para entender y usar este importante diagrama termodinámicoArianna Boga FelixÎncă nu există evaluări
- Práctica 2 - Humidificación - L3Document7 paginiPráctica 2 - Humidificación - L3PINEDA CASTAÑEDA VANESSA DEL CARMENÎncă nu există evaluări
- Lab Oratorio 1 Me C 3338Document22 paginiLab Oratorio 1 Me C 3338Samuel Astete ChoquevillcaÎncă nu există evaluări
- Resumen Sesión 02Document8 paginiResumen Sesión 02Guilmer Rosas Estrada GuarnizÎncă nu există evaluări
- 5 Diagrama de MollierDocument34 pagini5 Diagrama de MollierCsar_ArzaÎncă nu există evaluări
- DIAGRAMA DE MOLLIER AngelDocument20 paginiDIAGRAMA DE MOLLIER AngelGJ VargasÎncă nu există evaluări
- Diagrama Suva 134ADocument19 paginiDiagrama Suva 134AMauricio Eduardo Morales MendozaÎncă nu există evaluări
- Diagrama de Mollier AngelDocument20 paginiDiagrama de Mollier AngelBrandon RVÎncă nu există evaluări
- Ciclo frigorífico CarnotDocument12 paginiCiclo frigorífico CarnotEnliel ArriolaÎncă nu există evaluări
- Diagrama MollierDocument16 paginiDiagrama MollierPatthyzhita Socalay Garcia100% (1)
- Eficiencia máxima ciclo CarnotDocument33 paginiEficiencia máxima ciclo CarnotAndres Felipe Fernandez AlvisÎncă nu există evaluări
- Ciclo de RefrigeracionDocument25 paginiCiclo de RefrigeracionAlejandro RamosÎncă nu există evaluări
- N8 Condensación de VaporDocument21 paginiN8 Condensación de VaporDaira Torrico MeleanÎncă nu există evaluări
- Diagrama de MollierDocument34 paginiDiagrama de MollierSarita JarmaÎncă nu există evaluări
- Sesion 13 Refrigeracion Diagramas de MollierDocument42 paginiSesion 13 Refrigeracion Diagramas de MollierJose Antonio100% (2)
- Diagrama Mollier p-hDocument16 paginiDiagrama Mollier p-hLheidy Katherine VegaÎncă nu există evaluări
- S04.s04 Sobrecalentamiento y Subenfriamiento 19 de SetiembreDocument98 paginiS04.s04 Sobrecalentamiento y Subenfriamiento 19 de SetiembreSilva ValdezÎncă nu există evaluări
- Refrigeracion Industrial IIDocument25 paginiRefrigeracion Industrial IILuis Espinoza100% (1)
- Diagrama Mollier: Ciclo RefrigeraciónDocument34 paginiDiagrama Mollier: Ciclo Refrigeraciónj-balderas100% (1)
- Ciclo de Refrigeración de Compresión de VaporDocument10 paginiCiclo de Refrigeración de Compresión de VaporThelma Nadir Savedra PadillaÎncă nu există evaluări
- DIAGRAMA DE MOLLIER AngelDocument20 paginiDIAGRAMA DE MOLLIER AngelFedeMargariaÎncă nu există evaluări
- Refrigeracion 1.5 1.4Document8 paginiRefrigeracion 1.5 1.4Jonas HernandezÎncă nu există evaluări
- Climatización de Un Local de OficinasDocument253 paginiClimatización de Un Local de Oficinasjavpor921Încă nu există evaluări
- Aplicación Diagrama de MollierDocument7 paginiAplicación Diagrama de MollierSebastian AguileraÎncă nu există evaluări
- Torres EnfriamientoDocument47 paginiTorres EnfriamientoAmin MartinezÎncă nu există evaluări
- Refrigeración y congelación en sistemas alimentariosDocument13 paginiRefrigeración y congelación en sistemas alimentariosJulio Anagua MendosaÎncă nu există evaluări
- Consulta Ciclo de CarnotDocument6 paginiConsulta Ciclo de CarnotGermán EdilbertoÎncă nu există evaluări
- Ciclo de RefrigeraciónDocument19 paginiCiclo de RefrigeraciónBertha Felix TarazonaÎncă nu există evaluări
- Diagrama de Mollier - MarcoDocument20 paginiDiagrama de Mollier - MarcoAlejandra Martinez EsparzaÎncă nu există evaluări
- PP EquipoDocument22 paginiPP EquipoJoselyn TorcuatoÎncă nu există evaluări
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe la EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSEvaluare: 4.5 din 5 stele4.5/5 (7)
- Psicometría. Principios básicos y protocolos experimentales diversosDe la EverandPsicometría. Principios básicos y protocolos experimentales diversosÎncă nu există evaluări
- Ingeniería química. Soluciones a los problemas del tomo IDe la EverandIngeniería química. Soluciones a los problemas del tomo IÎncă nu există evaluări
- El Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaDe la EverandEl Mejor Libro de Preparación Para Tu Examen De Licencia De Operador De CalderaÎncă nu există evaluări
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe la EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesÎncă nu există evaluări
- UF1026 - Caracterización de procesos e instalaciones frigoríficasDe la EverandUF1026 - Caracterización de procesos e instalaciones frigoríficasEvaluare: 4 din 5 stele4/5 (1)
- Eficiencia energética en las instalaciones de climatización en los edificios. ENAC0108De la EverandEficiencia energética en las instalaciones de climatización en los edificios. ENAC0108Încă nu există evaluări
- Proteinas Inge 1Document20 paginiProteinas Inge 1Junior QuispeÎncă nu există evaluări
- Presentación 1Document10 paginiPresentación 1Junior QuispeÎncă nu există evaluări
- Libro Balance de Materia y Energia 2020Document103 paginiLibro Balance de Materia y Energia 2020Junior Quispe100% (2)
- Determinacion de Grasa y Ceniza en Charqui de AlpacaDocument6 paginiDeterminacion de Grasa y Ceniza en Charqui de AlpacaJunior QuispeÎncă nu există evaluări
- Junior Quimica 13Document11 paginiJunior Quimica 13Junior QuispeÎncă nu există evaluări
- Proteinas Inge 1Document20 paginiProteinas Inge 1Junior QuispeÎncă nu există evaluări
- Como Defenderse de Los Ataques Verbales de Barbara BerckhanDocument4 paginiComo Defenderse de Los Ataques Verbales de Barbara BerckhanJunior QuispeÎncă nu există evaluări
- Esterilizacion de AlimentosDocument62 paginiEsterilizacion de AlimentosKarín Coello94% (33)
- Como Defenderse de Los Ataques Verbales de Barbara BerckhanDocument4 paginiComo Defenderse de Los Ataques Verbales de Barbara BerckhanJunior QuispeÎncă nu există evaluări
- JuniorDocument2 paginiJuniorJunior QuispeÎncă nu există evaluări
- Presentación 1Document10 paginiPresentación 1Junior QuispeÎncă nu există evaluări
- Envases de PlasticoDocument1 paginăEnvases de PlasticoJunior QuispeÎncă nu există evaluări
- El Diente de León PDFDocument3 paginiEl Diente de León PDFsilvina53100% (1)
- Estructura de MateriaDocument4 paginiEstructura de MateriaJunior QuispeÎncă nu există evaluări
- Cestas GabyDocument1 paginăCestas GabyJunior QuispeÎncă nu există evaluări
- Diente de LeonDocument20 paginiDiente de LeonJunior QuispeÎncă nu există evaluări
- LOCUCIÓNDocument11 paginiLOCUCIÓNJunior QuispeÎncă nu există evaluări
- Presentación1 JuniorDocument15 paginiPresentación1 JuniorJunior QuispeÎncă nu există evaluări
- Cesta MejorDocument4 paginiCesta MejorJunior QuispeÎncă nu există evaluări
- 2 PracticaDocument6 pagini2 PracticaJunior QuispeÎncă nu există evaluări
- PSICROMETRIADocument20 paginiPSICROMETRIAJunior QuispeÎncă nu există evaluări
- Articulo de LecturaDocument14 paginiArticulo de LecturaJunior QuispeÎncă nu există evaluări
- Oca (Oxalis tuberosa): Reino, clases, cultivo y variedades de la planta andinaDocument7 paginiOca (Oxalis tuberosa): Reino, clases, cultivo y variedades de la planta andinaJunior QuispeÎncă nu există evaluări
- La Maravilla Del ArteDocument22 paginiLa Maravilla Del ArteJunior QuispeÎncă nu există evaluări
- Grupos por afinidad deportiva y ambientalistaDocument9 paginiGrupos por afinidad deportiva y ambientalistaJunior QuispeÎncă nu există evaluări
- La Maravilla Del ArteDocument22 paginiLa Maravilla Del ArteJunior QuispeÎncă nu există evaluări
- Grupos por afinidad deportiva y ambientalistaDocument9 paginiGrupos por afinidad deportiva y ambientalistaJunior QuispeÎncă nu există evaluări
- El Diente de León PDFDocument3 paginiEl Diente de León PDFsilvina53100% (1)
- La Maravilla Del ArteDocument1 paginăLa Maravilla Del ArteJunior QuispeÎncă nu există evaluări
- Hidráulica y Hidrodinámica: Problemas Resueltos de Mecánica de FluidosDocument14 paginiHidráulica y Hidrodinámica: Problemas Resueltos de Mecánica de FluidosfidelÎncă nu există evaluări
- DISEÑO DE CANALES Y FLUJO UNIFORMEDocument44 paginiDISEÑO DE CANALES Y FLUJO UNIFORMEgina28210Încă nu există evaluări
- Solucionario Examenes UNSA 2011-2015Document163 paginiSolucionario Examenes UNSA 2011-2015redbarrol76% (50)
- TermosDocument2 paginiTermososcar_felipe_jimenezÎncă nu există evaluări
- Franko Serie 1000 Válvula de AlivioDocument13 paginiFranko Serie 1000 Válvula de AliviogabyÎncă nu există evaluări
- Informe Cambios de EstadoDocument13 paginiInforme Cambios de Estadofelipemejia0100% (1)
- EL SECADO para CuadernoDocument11 paginiEL SECADO para CuadernoEdevair FuentesÎncă nu există evaluări
- Capítulo 3Document4 paginiCapítulo 3alejanÎncă nu există evaluări
- 1ra ClaseDocument22 pagini1ra ClaseRodolfoGarciaÎncă nu există evaluări
- Guia de Problemas Feno B Primer Parcial-2Document19 paginiGuia de Problemas Feno B Primer Parcial-2LIZANDRO RODRIGO CONDORI MENDOZAÎncă nu există evaluări
- Separación Sólido LíquidoDocument133 paginiSeparación Sólido LíquidoSusey Madelit Apaza Mamani100% (1)
- Laboratorio PRESIÓN de VAPOR REID RefinacióndelpetróleoDocument17 paginiLaboratorio PRESIÓN de VAPOR REID RefinacióndelpetróleoJose Luis Diaz Carrizales100% (1)
- Informe de Laboratorio Numero 9 Fluidizacion y Lechos HHDocument19 paginiInforme de Laboratorio Numero 9 Fluidizacion y Lechos HHmireya saavedra100% (1)
- Aplicaciones Típicas de Las Bombas RotatoriasDocument3 paginiAplicaciones Típicas de Las Bombas RotatoriasRody Martinez100% (1)
- Memoria Técnico DescriptivaDocument24 paginiMemoria Técnico DescriptivaEnrique PaniaguaÎncă nu există evaluări
- Reglamento de Aparatos A Presión-CalderasDocument64 paginiReglamento de Aparatos A Presión-CalderasLuisPajueloÎncă nu există evaluări
- Numero de ReynoldsDocument14 paginiNumero de ReynoldsJosé Luis Varela100% (1)
- Planificación Microcurricular CCNN 10Document29 paginiPlanificación Microcurricular CCNN 10sbodomir100% (1)
- Determinación de La Razón Cp-Cv. Método de Clement y DesormesDocument9 paginiDeterminación de La Razón Cp-Cv. Método de Clement y DesormesWilly SalcedoÎncă nu există evaluări
- Calidad fluidos producidosDocument80 paginiCalidad fluidos producidosMarthiitaa PerezÎncă nu există evaluări
- Tema Procesos de Produccion de LubricantesDocument12 paginiTema Procesos de Produccion de LubricanteshectorÎncă nu există evaluări
- Determinación de la viscosidad mediante el método capilarDocument10 paginiDeterminación de la viscosidad mediante el método capilarSteffani MireilleÎncă nu există evaluări
- Es Capítulo ProtracDocument4 paginiEs Capítulo ProtracJims Poma VilcahuamanÎncă nu există evaluări
- Problemas de Aplicacion FluidosDocument5 paginiProblemas de Aplicacion FluidosJhosmel Gamboa Cordova100% (2)
- Presión HidrostáticaDocument4 paginiPresión Hidrostáticaalex rene cardonaÎncă nu există evaluări
- Tensiómetro de Método de Anillo DunouyDocument6 paginiTensiómetro de Método de Anillo DunouyJosue Hernandez MrkzÎncă nu există evaluări
- Coeficientes Anestesiologia 190308043133Document17 paginiCoeficientes Anestesiologia 190308043133Brendaa Vazquez Ruiz100% (1)
- Cuestionario de Los Requerimientos para Clase I, II y III en Una Planta de Laminado en CalienteDocument6 paginiCuestionario de Los Requerimientos para Clase I, II y III en Una Planta de Laminado en CalienteLUIS MENDEZÎncă nu există evaluări
- Válvula de ExpansiónDocument10 paginiVálvula de ExpansiónLeonardo CardinauxÎncă nu există evaluări
- Tema 2 - Operaciones Gas-LíquidoDocument9 paginiTema 2 - Operaciones Gas-LíquidoSol RodríguezÎncă nu există evaluări