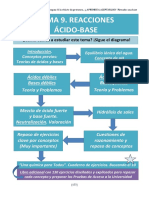
Documente Academic
Documente Profesional
Documente Cultură
Prueba de Nivel Academia Osorio Madrid Web
Încărcat de
Yei XDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Prueba de Nivel Academia Osorio Madrid Web
Încărcat de
Yei XDrepturi de autor:
Formate disponibile
Prueba de nivel. Química 2º Bachillerato y Selectividad.
Academia Osorio
* Una vez realizada la prueba de nivel puedes enviarla al correo cursos@unaquimicaparatodos.com ,
al whatsapp 644 756 637 ó bien presentarla en la academia y evaluaremos el grupo apropiado para ti.
Completa el formulario de inscripción directamente en la web para que lo asociemos a tu prueba.
* Marca con una X los temas que has visto o estás viendo en clase y responde a las preguntas
correspondientes de dichos temas justificando las respuestas y sin acudir a apuntes.
Recuerda que la finalidad de la prueba es poder evaluar tu nivel. ¡¡No hagas trampa!!:
1. FORMULACIÓN INORGÁNICA 6. TERMOQUIMICA
2. FORMULACIÓN ORGÁNICA 7. CINÉTICA
3. ÁTOMO 8. EQUILIBRIO Y SOLUBILIDAD
4. ENLACE QUÍMICO 9. REACCIONES ÁCIDO-BASE
5. ESTEQUIOMETRÍA Y 10. REACCIONES REDOX
DISOLUCIONES 11. QUÍMICA DEL CARBONO
1. Formula o nombra los siguientes compuestos
a) Ácido perclórico
b) Hidróxido de calcio
c) AlPO4
Formulación Inorgánica y Orgánica
d) H2SO3
e) CH2OHCH2CH2OH
f) CH3CH2CH2COCH3
g) Propanal
h) Ácido 3- Hidroxipentanoico
2. Para el elemento azufre (Z=16): (Átomo)
a) Escribe su configuración electrónica.
b) Justifica el número de electrones desapareados que posee. Átomo
c) Justifica el ion estable que podría formar.
d) Justifica si tendrá mayor o menor energía de ionización que el oxígeno.
3. Para la molécula NH3, establece su:
a) Estructura de Lewis.
b) Geometría según la TRPECV.
c) Polaridad de la molécula. Enlace químico
d) Hibridación del átomo central.
e) Fuerzas intermoleculares que se establecen entre sus moléculas.
ACADEMIA OSORIO. CALLE OQUENDO. Nº18. 28006. MADRID – 644756637 – www.unaquimicaparatodos.com
Preparación Experta de Química para Selectividad – Una Química Para Todos – Twitter @QuimicaPau
4) Dada una disolución de HNO3 concentrado de densidad 1,505 g/ mL y 98% de riqueza en
masa. Calcula:
Disoluciones
a) La Molaridad de la disolución.
b) Volumen de HNO3 necesario para preparar 250 ml de una disolución HNO3 1M.
5) Dada la siguiente reacción ya ajustada: CH4 (g) + 2 O2 (g) → CO2 (g) + 2H2O (l)
a) Calcula el volumen de CO2 formado en condiciones normales a partir de 20 gramos de O2.
b) Determina el reactivo limitante y la cantidad del otro en exceso en el caso de que
dispusiéramos de 20 gramos de O2 y 30 gramos de CH4.
Estequiometría y termoquímica
c) Calcula el valor de ∆H, ∆S de la reacción.
d) Calcula el valor de ΔG y determina la espontaneidad de la reacción a 100 °C.
6) Para la reacción: A + 2 B + C → Productos, la ecuación cinética de velocidad toma la
expresión:
V= K∙[A]2∙[B]2.
a) Determina los órdenes parciales y el orden total de la reacción. Cinética
b) Deduce las unidades de la constante cinética.
c) ¿Influye la temperatura en la velocidad de reacción? Justifica la respuesta.
7) En un recipiente de 1 litro de capacidad, en el que previamente se ha hecho el vacío, se
introducen 0’1 mol de NO, 0’05 moles de H2 y 0’1 mol de agua. Se calienta el matraz y se
establece el equilibrio: 2 NO (g) + 2 H2 (g) ⇄ N2 (g) + 2 H2O (g) Sabiendo que cuando se
establece el equilibrio la concentración de NO es 0’062 M, calcula:
a) La concentración de todas las especies en el equilibrio. Equilibrio
b) El valor de la constante Kc a esa temperatura.
8). Se dispone de una disolución acuosa de ácido benzoico (C6H5COOH) con un pH de 3,09 y una
concentración de 10-2 M. Calcula:
a) La constante de disociación del ácido. Ácido-Base
b) El grado de disociación el ácido benzoico.
9). Ajusta la siguiente reacción molecular por el método ion-electrón:
Redox
𝑯𝑯𝑯𝟑 + 𝑯𝑯 + 𝑯𝑯𝑯 → 𝑯𝑯𝑪𝑪𝟐 + 𝑵𝑵 + 𝑯𝟐 𝑶
Datos para los ejercicios 4 y 5: Masas atómicas: C= 12 ; O=16 ; H = 1 ; N=14
ΔH°formación (kJ/mol): CH4 (g)= -74,8 ; CO2 (g)= -393,5 ; H2O (l) = -285,5
S° (J · mol -1· K -1): CH4 (g) = 186, 3 ; CO2 (g) = 213, 7 ; H2O (l) = 69, 9 ; O2 (g) = 205, 1
ACADEMIA OSORIO. CALLE OQUENDO. Nº18. 28006. MADRID – 644756637 – www.unaquimicaparatodos.com
Preparación Experta de Química para Selectividad – Una Química Para Todos – Twitter @QuimicaPau
S-ar putea să vă placă și
- Practica Quimica Revisiom v2Document12 paginiPractica Quimica Revisiom v2Carlos Morales JuarezÎncă nu există evaluări
- FisicaDocument7 paginiFisicaLisbet FlórezÎncă nu există evaluări
- Química 8va Olimpiada 2da Etapa TodosDocument6 paginiQuímica 8va Olimpiada 2da Etapa TodosOscar Cope0% (1)
- Repaso Reacciones Quimicas 3 EsoDocument9 paginiRepaso Reacciones Quimicas 3 Esorosa herreroÎncă nu există evaluări
- Señale La Proposición IncorrectaDocument5 paginiSeñale La Proposición IncorrectaRaul Angel ValdiviaÎncă nu există evaluări
- Metodología y Novedades Respecto A La Edición AnteriorDocument6 paginiMetodología y Novedades Respecto A La Edición AnteriorYei XÎncă nu există evaluări
- Polipastos y Puentes GrúasDocument23 paginiPolipastos y Puentes GrúasMariano Bernini100% (1)
- Cinética 1 PDFDocument1 paginăCinética 1 PDFYei X0% (1)
- El Arte de Combinar El Sí Con El NoDocument123 paginiEl Arte de Combinar El Sí Con El NoDaniela RojasÎncă nu există evaluări
- OCLUSIONDocument40 paginiOCLUSIONaka_andres92% (25)
- 9 Principal Acido Base 2 PDFDocument1 pagină9 Principal Acido Base 2 PDFYei XÎncă nu există evaluări
- 9 Principal Acido Base 2 PDFDocument1 pagină9 Principal Acido Base 2 PDFYei XÎncă nu există evaluări
- Agentes Químicos Contaminantes en El Ambiente LaboralDocument35 paginiAgentes Químicos Contaminantes en El Ambiente Laboralpaul100% (1)
- Error e IncertidumbreDocument14 paginiError e IncertidumbreDaniel VergaraÎncă nu există evaluări
- Reacciones QuimicasDocument5 paginiReacciones QuimicasMalena KesslerÎncă nu există evaluări
- Examen Olimpiada Cordoba 2006Document2 paginiExamen Olimpiada Cordoba 2006Juan Jose PettitiÎncă nu există evaluări
- SelectQui2Bac PDFDocument94 paginiSelectQui2Bac PDFmaord0% (1)
- Enumadj 14Document2 paginiEnumadj 14Juan AÎncă nu există evaluări
- Pa Quimica 10 - 5P 2019Document4 paginiPa Quimica 10 - 5P 2019Cristina Vel RiosÎncă nu există evaluări
- Enumadj 16Document2 paginiEnumadj 16Juan AÎncă nu există evaluări
- U 7 Qca en EjerciciosDocument5 paginiU 7 Qca en EjerciciosCreaciones CCÎncă nu există evaluări
- Ejercicios - Segundo ParcialDocument2 paginiEjercicios - Segundo Parcialjersyleon100% (1)
- GGCQ Repaso Cuarta Práctica Calificada Cepre Uni 2010 IIDocument2 paginiGGCQ Repaso Cuarta Práctica Calificada Cepre Uni 2010 IIfico20Încă nu există evaluări
- Boletín SelectividadDocument41 paginiBoletín Selectividadlunares77775Încă nu există evaluări
- Ejemplos de Evaluación para CCNN - QuímicaDocument11 paginiEjemplos de Evaluación para CCNN - QuímicamarceloÎncă nu există evaluări
- Ejercicios de Repaso Farmacia Organica 1Document4 paginiEjercicios de Repaso Farmacia Organica 1Gabriel Sánchez MarínÎncă nu există evaluări
- Guia Quimica IVDocument14 paginiGuia Quimica IVMaclovio Hernández Jesús EliasÎncă nu există evaluări
- Guia Quimica IVDocument14 paginiGuia Quimica IVNorman ZarateÎncă nu există evaluări
- Enuvalj 01Document69 paginiEnuvalj 01Jorgito LeccionesÎncă nu există evaluări
- Pau Sept17 QuimicaDocument2 paginiPau Sept17 QuimicalincecitaÎncă nu există evaluări
- Cálculos QuímicossDocument7 paginiCálculos QuímicossMaycol N TCÎncă nu există evaluări
- Quimicall TV PDFDocument14 paginiQuimicall TV PDFSergioÎncă nu există evaluări
- Ejercicios Termodinámica Química y Equilibrio Químico - Luis Arley MuñozDocument11 paginiEjercicios Termodinámica Química y Equilibrio Químico - Luis Arley MuñozmariaÎncă nu există evaluări
- Exámenes Parciales:: Udb - Química Química GeneralDocument9 paginiExámenes Parciales:: Udb - Química Química GeneralMati GoldmanÎncă nu există evaluări
- Modelos de ParcialesDocument8 paginiModelos de ParcialesLucas SandovarÎncă nu există evaluări
- 08 Reacciones QuímicasDocument42 pagini08 Reacciones Químicaspaulopaulo3Încă nu există evaluări
- Universidad de Castilla La ManchaDocument8 paginiUniversidad de Castilla La ManchaGustavo PolancoÎncă nu există evaluări
- 8 Nivelación 2 PeriodoDocument3 pagini8 Nivelación 2 PeriodoLaura Valentina Camargo VelandiaÎncă nu există evaluări
- Repaso 2º TrimestreDocument4 paginiRepaso 2º Trimestrejulita1726Încă nu există evaluări
- 08 Reacciones QuímicasDocument42 pagini08 Reacciones QuímicasYeni Tatiana Aguilar HuertasÎncă nu există evaluări
- Examen Química A Zonal 2016Document5 paginiExamen Química A Zonal 2016juanpabloreyes769Încă nu există evaluări
- 1.-Reacciones Quimicas 25Document42 pagini1.-Reacciones Quimicas 25urrestigoÎncă nu există evaluări
- Química 13Document5 paginiQuímica 13kalaÎncă nu există evaluări
- Practica Calificada 2da ParcialDocument2 paginiPractica Calificada 2da ParcialjohanxdxdÎncă nu există evaluări
- ¡¡¡Guia Importante¡¡¡Document5 pagini¡¡¡Guia Importante¡¡¡lilianafrareÎncă nu există evaluări
- 891-QT - Control N°2-2023 (5%)Document11 pagini891-QT - Control N°2-2023 (5%)catalinaÎncă nu există evaluări
- Pre 2º de Bachillerato: Química: Nombre Del Alumno: Subida de NotaDocument4 paginiPre 2º de Bachillerato: Química: Nombre Del Alumno: Subida de NotaYaizaÎncă nu există evaluări
- Exámenes de QuímicaDocument5 paginiExámenes de QuímicaLara López PérezÎncă nu există evaluări
- 4º Eso - Unidad 5. RefuerzoDocument9 pagini4º Eso - Unidad 5. RefuerzoDavid GarciaÎncă nu există evaluări
- Recuperacion Segundo ExamenDocument3 paginiRecuperacion Segundo Examenalex sumireÎncă nu există evaluări
- Quim 2011 Reserva 1Document2 paginiQuim 2011 Reserva 1Paola BejaranoÎncă nu există evaluări
- Examen Química de Extremadura (Extraordinaria de 2022) (WWW - Examenesdepau.com)Document2 paginiExamen Química de Extremadura (Extraordinaria de 2022) (WWW - Examenesdepau.com)Silvia Tobar LerancaÎncă nu există evaluări
- Examen Modulo III-2023Document4 paginiExamen Modulo III-2023Steven ChurrangoÎncă nu există evaluări
- UntitledDocument3 paginiUntitledoscarÎncă nu există evaluări
- E. Enero 2014Document10 paginiE. Enero 2014Isabel GutiérrezÎncă nu există evaluări
- Quimica Examen Prueba Acceso Grado Superior Extremadura 2019Document2 paginiQuimica Examen Prueba Acceso Grado Superior Extremadura 2019vitoÎncă nu există evaluări
- Taller ReaccionesDocument6 paginiTaller Reaccionesadriana gonzalesÎncă nu există evaluări
- Problemas2 QA2017IDocument4 paginiProblemas2 QA2017IAlexandra BarrigaÎncă nu există evaluări
- Seminario 2-Química GeneralDocument5 paginiSeminario 2-Química GeneralXiomara Elizabeth Pozo GuerreroÎncă nu există evaluări
- Ejercicios Química II PDFDocument49 paginiEjercicios Química II PDFPepe Jara Ginsberg100% (1)
- Banco de Preguntas Examen Quimestral Quimica 2Document14 paginiBanco de Preguntas Examen Quimestral Quimica 2Misael Ramon LopezÎncă nu există evaluări
- Ejercicios Preparatorios Unidad 2Document4 paginiEjercicios Preparatorios Unidad 2Mariam CaicedoÎncă nu există evaluări
- Final QG - 26-05-2022Document1 paginăFinal QG - 26-05-2022Sofía FabbroÎncă nu există evaluări
- Ejercicios Tema 6 - 22-23Document6 paginiEjercicios Tema 6 - 22-23agustin cabreraÎncă nu există evaluări
- Taller # 3 Final 2021-2 QuimicaDocument2 paginiTaller # 3 Final 2021-2 QuimicaSergio Alejandro RUIZ FOREROÎncă nu există evaluări
- Recopilación de Todos Los Ejercicios de Reacciones Ácido-Base (PAU Canarias)Document5 paginiRecopilación de Todos Los Ejercicios de Reacciones Ácido-Base (PAU Canarias)Clases particulares en la LagunaÎncă nu există evaluări
- SOLEMNE RECUPERATIVO DQUI 1033 - PautaDocument7 paginiSOLEMNE RECUPERATIVO DQUI 1033 - PautapedrerojuaquinÎncă nu există evaluări
- LABORATORIO FINAL DE FENOMENOS QUIMICOS MiércolesDocument15 paginiLABORATORIO FINAL DE FENOMENOS QUIMICOS Miércoleshomero solis fernandez100% (1)
- Quimica Indice Temario y MetodologiaDocument2 paginiQuimica Indice Temario y MetodologiaYei X100% (1)
- NovedadesDocument2 paginiNovedadesYei XÎncă nu există evaluări
- Proyecto I-Análisis de Rendimiento de Un MotorDocument11 paginiProyecto I-Análisis de Rendimiento de Un MotorDanny Colcha AguasÎncă nu există evaluări
- Ficha Tecnica Electr RuralDocument6 paginiFicha Tecnica Electr RuralTahnee BaltaÎncă nu există evaluări
- Tensor NotaciónDocument12 paginiTensor NotaciónIvan Huaman Segura100% (1)
- Informe SuspensionesDocument11 paginiInforme SuspensionesFranklyn Joel Rivas LacruzÎncă nu există evaluări
- Paradigmas Que Compiten en La Investigación CualitativaDocument18 paginiParadigmas Que Compiten en La Investigación CualitativaAnonymous MkjTXxa1fÎncă nu există evaluări
- Cadena Productiva Del AzucarDocument3 paginiCadena Productiva Del Azucarvenus moncadaÎncă nu există evaluări
- Sesion 3 Construcciones GeometricasDocument10 paginiSesion 3 Construcciones GeometricasWilder MolinaÎncă nu există evaluări
- Termometría y DilataciónDocument2 paginiTermometría y DilataciónDaniela Milagros Alvarado NeciosupÎncă nu există evaluări
- ReynoldsDocument7 paginiReynoldsGerman Lima CruzÎncă nu există evaluări
- Ele 2Document6 paginiEle 2Vinueza AndrésÎncă nu există evaluări
- Mecánicas Matricial y OndulatoriaDocument39 paginiMecánicas Matricial y OndulatoriaKarelBRGÎncă nu există evaluări
- Tarjetas Comprension LectoraDocument8 paginiTarjetas Comprension LectoraCecilia SalazarÎncă nu există evaluări
- Formato Ficha de Laboratorio 3Document4 paginiFormato Ficha de Laboratorio 3Anahi NacevillaÎncă nu există evaluări
- Actividad 1 Edafologia y FertilidadDocument6 paginiActividad 1 Edafologia y FertilidadAlejandra HernandezÎncă nu există evaluări
- Apunte Curva HorizontalDocument5 paginiApunte Curva HorizontalEsteban BarriosÎncă nu există evaluări
- Rendimiento y Regulacion de Auto TransformadorDocument5 paginiRendimiento y Regulacion de Auto TransformadorHenrry ValderramaÎncă nu există evaluări
- Propiedades Fisicas, Mecanicas y OpticasDocument5 paginiPropiedades Fisicas, Mecanicas y OpticasEvelia Lizeth MoralesÎncă nu există evaluări
- Taller Ley de Coulomb y Campo Eléctrico PDFDocument2 paginiTaller Ley de Coulomb y Campo Eléctrico PDFluiferinconÎncă nu există evaluări
- Detección de Valores Atipicos (Outliers) en Conjuntos de Datos Univariantes - Outliers Values Detection in Univariable DatasetsDocument10 paginiDetección de Valores Atipicos (Outliers) en Conjuntos de Datos Univariantes - Outliers Values Detection in Univariable DatasetsJuan Felipe Muñoz Fernandez0% (1)
- Ljungberg Fox - Establecimiento de Hábitos de Estudios EficientesDocument12 paginiLjungberg Fox - Establecimiento de Hábitos de Estudios EficientesAlberto Ruiz HidalgoÎncă nu există evaluări
- Contenidos Curriculares Mecanica AutomotrizDocument3 paginiContenidos Curriculares Mecanica Automotrizmarcos100% (1)
- METODO HARDY CROSS para Redes Cerradas y AbiertasDocument16 paginiMETODO HARDY CROSS para Redes Cerradas y AbiertasJohan Flores LizanaÎncă nu există evaluări
- Informe de Frenado DinamicoDocument6 paginiInforme de Frenado DinamicoLuis SanchezÎncă nu există evaluări