Documente Academic
Documente Profesional
Documente Cultură
Uni 4 PDF
Încărcat de
loretoTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Uni 4 PDF
Încărcat de
loretoDrepturi de autor:
Formate disponibile
Colegio Julio Montt Salamanca
Evaluación Unidad IV - 3 Medio Química - Anual
Química - 3° ENSEÑANZA MEDIA
NOMBRE: ____________________________________________ CURSO: __________ FECHA: __________ PUNTAJE: _________
1) La constante del siguiente equilibrio A(g) + B(s) C(ac) + 2D(g) es:
A) [C] [D] / [A] [B].
B) [C] [D]2 / [A] [B].
C) [C] [D]2 / [A].
D) [A] [B] / [C] [D].
E) [A] / [C] [D]2.
2) Para el equilibrio A(g) + B(s) C(g) + 2D(g), la Keq es de 0.015 y las concentraciones son
A= 2.55M, B= 0.35M, C= 1.15M. ¿Cuál es la concentración de D?
A) 0,033 M.
B) 0,32 M.
C) 0,35 M.
D) 0,18 M.
E) 0 M.
3) En la siguiente ecuación química, y teniendo en cuenta el principio de Le-Chatelier, la
reacción se desplazará hacia los productos al:
A) Disminuir la presión.
B) Aumentar la concentración de NH3.
C) Disminuir la temperatura.
D) Disminuir la concentración de algún reactante.
E) Aumentar la concentración de algún producto.
4) De las siguientes reacciones en equilibrio químico, ¿cuál de ellas no altera su estado de
equilibrio al producirse un aumento de presión?
A)
B)
C)
D)
E)
5) Considerando que la reacción de formación del ozono es endotérmica, el calentamiento
global de de la tierra debido al efecto invernadero debería hacer que la concentración de O
3 troposférico:
O2 + O O3
A) Disminuya.
B) No Varíe.
C) Aumente.
D) Se mantenga.
E) Aumente y disminuya simultaneamente.
Colegio Julio Montt Salamanca
Página 1
6) La siguiente reacción A(g) B(g) + calor, se puede afirmar que es un proceso:
A) Endotérmico.
B) Endergónico.
C) Exotérmico.
D) Exógeno.
E) Que absorbe calor.
7) Los factores que influyen en la alteración del equilibrio químico son:
A) Concentración, temperatura, presión.
B) Densidad, temperatura, masa.
C) Masa, temperatura, concentración.
D) Inhibidores, catalizadores y volumen.
E) Forma de los reactivos.
8) Para una reacción en estado de equilibrio, la constante Keq se modifica por un cambio en:
I. La temperatura.
II. Las concentraciones.
III. La presión.
A) Sólo I.
B) Sólo II.
C) Sólo III.
D) Sólo I y II.
E) Sólo II y III.
9) La Keq para la siguiente reacción es 63 a una determinada temperatura. ¿Cuál es la
concentración de H2 en el estado de equilibrio si la concentración de HI es 0,20 M y la de I2
es 0,10M?
A) 0,03 M.
B) 0,1 M.
C) 0,2 M.
D) 0,0032 M.
E) 0,0063 M.
10) En el proceso de producción de amoniaco a partir de nitrógeno e hidrógeno se da de
según la reacción:
N2 + 3H2 2NH3
Al respecto, ¿es posible predecir si esta reacción es espontánea a 500ºC?
Considere los siguientes valor de H0= -92.22 kJ/mol2 y S0=-0.1987 kJ/(mol K)
A) No es posible, pues no existe relación entre la Keq y ls energía libre.
B) No es posible, ya que el valor que se obtiene indica que su Keq es mayor que uno.
C) Es posible, pues el valor que se obtiene para la Keq es mayor que uno.
D) Es posible, ya que el valor que se obtiene de la energìa libre es negativa .
E) No es posible, pues el valor de la energía libre es positivo.
11) Para la reacción química: 2A(g) + 3 B(g) C(g) la expresión de la constante de equilibrio
químico (Kc) es:
A) Kc =[A]2[B]3/[C].
B) Kc = [A] [B]/[C].
C) Kc = [C]/[A]2[B].
D) Kc= [C]/[A][B].
E) Kc = [C]/[A]2[B]3.
Colegio Julio Montt Salamanca
Página 2
12) Para la siguiente reacción química: H2 (g) + 1/2O2 (g) H2O(g) ¿Cuál es la expresión de
la constante de equilibrio químico (Kc)?
A) Kc = [H2][O2]/[H2O].
B) Kc = [H2]/[H2O].
C) Kc = [H2O]/[H2].
D) Kc = [H2O]/[H2][O2]1/2.
E) Kc = [H2O]/[H2]1/2/[O2].
13) La Keq de un sistema es: Kc= [A][B]4/[C]3 ¿Cuál es la reacción que mejor se ajusta a esta
situación?
A) A(g) + 4 B(s) 3C(g)
B) A(g) + 4 B(g) 3C(g)
C) 3C(g) A(g) + 4 B(s)
D) C(g) A(g) + B(g)
E) 3C(g) A(g) + 4 B(g)
14) Según el principio de Le Chatelier, si en un sistema en equilibrio se modifica algún factor,
el sistema evoluciona:
A) En el sentido que multiplique dicha modificación.
B) En el mismo sentido de la modificación.
C) En el sentido que contrareste dicha modificación.
D) Hacia la formación de productos.
E) Hacia la recuperación de los reactantes.
15) Si en una reacción exotérmica aumentamos la temperatura luego de haberse alcanzado el
equilibrio químico, en dicha reacción tendrá lugar:
A) Un desplazamiento del equilibrio hacia la izquierda.
B) Un cese de la reacción.
C) La obtención de reactivos.
D) Un desplazamiento del equilibrio hacia la derecha.
E) La desaparición de los reactivos.
16) Conociendo que un sistema en equilibrio puede también expresarse con la siguiente
ecuación:
Evaluemos los siguientes términos:
Al respecto, se puede predecir que:
A) La Keq en el primer caso es mayor que uno.
B) La Keq del sistema en el segundo es mayor que uno.
C) La Keq en el tercer caso es mayor que uno.
D) La reaccón en el tercer caso es espontánea.
E) La reacción del segundo sistema nunca es esponánea.
Colegio Julio Montt Salamanca
Página 3
17) Para que una reacción química ocurra, los átomos y moléculas deben cumplir con las
siguientes condiciones, EXCEPTO:
A) Romper enlaces.
B) Chocar con una orientación adecuada.
C) Elevar la energía de activación.
D) Formar enlaces.
E) Chocar con suficiente energía.
18) Para una reacción que ha llegado al equilibrio, se puede afirmar que:
A) La concentración de reactantes y productos es la misma.
B) La concentración de reactantes es mayor que la de producto.
C) La concentración de productos es mayor que la de los reactivos.
D) La velocidad de formación de productos y reactivos es la misma.
E) La velocidad de formación de productos y reactivos varía.
19) Para expresar la Keq de una reacción química se debe tener en cuenta:
I.- Que la reacción esté igualada.
II.- El estado físico de los participantes de la reacción.
III.- La presión a la cual se realizó la reacción química.
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y II.
E) I, II y III.
20) En una reacción química que se encuentra en equilibrio a temperatura constante, se
constata que la cantidad de productos es muy superior a la de reactantes. Esta
observación nos permite asegurar que:
A) La constante de equilibrio es mayor que uno.
B) La velocidad de la reacción inversa es mucho mayor que la velocidad de la reacción
directa.
C) La constante de equilibrio es menor que uno.
D) La constante de equilibrio toma un valor igual a cero al llegar al equilibrio.
E) Sin datos numéricos no se puede interpretar.
21) La expresión de la constante de equilibrio para la reacción para la siguiente reacción es:
A)
B)
C)
D)
E) No se puede deducir.
Colegio Julio Montt Salamanca
Página 4
22) ¿Cuál de los siguientes valores de Keq se desplaza más hacia los productos?
A) 1x10-3.
B) 1x105.
C) 1x10-4.
D) 1x108.
E) 1x102.
23) La reacción química que tiene la siguiente expresión de Keq es:
A) CH4 (g) + O2 (g) H2O (g) + CO2 (g).
B) CH4 (g) + 2O2 (g) 2H2O (g)+ CO2 (g).
C) 2H2O (g) + CO2 (g) CH4 (g)+ 2O2 (g).
D) H2O (g) + CO2 (g) CH4 (g) + O2 (g).
E) H2O (g) + CH4 (g) CO2 (g) + O2 (g).
24) En la siguiente reacción química en equilibrio:
Cu(s) + 4HNO3(ac) Cu(NO3)2(ac) + 2NO2(g) + 2 H2O(l)
¿Cuál(es) de las siguientes sustâncias NO se debe expresar en una constante de
equilíbrio:
I.- Cu(s)
II.- HNO3 (ac)
III.- H2O (l)
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y III.
E) I, II y III.
25) El valor de la constante de equilíbrio para la reacción C (s) + O2 (g) CO2(g) cuando las
concentraciones en equilibrio de O2 es 0,1 M y CO2 es 0,2 M es:
A) 0,1.
B) 0,2.
C) 1.
D) 2.
E) 4.
26) El valor de la Keq determinada en la pregunta anterior, indica que la reacción:
A) Se desplaza hacia los reactivos.
B) Se desplaza hacia los productos.
C) Se encuentra en equilibrio completo.
D) Es endotérmica.
E) Es exotérmica.
27) Si analizamos el equilibrio de la siguiente reacción:
2C (s) + O2 (g) 2CO(g)
Se puede predecir que:
A) Su Keq mayor a uno.
B) Su Keq es menor que uno.
C) Siempre es no espontánea.
D) Tiene una energía libre positiva.
E) Su G es positivo, por lo que la Keq es menor a uno.
Colegio Julio Montt Salamanca
Página 5
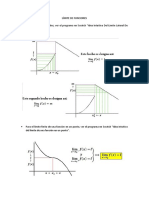
28) ¿Qué gráfica representa una reacción en equilíbrio completo?
A)
B)
C)
D)
E)
29) De la siguiente gráfica:
Se puede afirmar que:
A) X pertenece a los reactivos.
B) Y pertenece a los productos.
C) Que la reacción está en equilibrio completo.
D) Que la reacción se desplaza hacia los reactivos.
E) Que la reacción desplaza a los productos.
Colegio Julio Montt Salamanca
Página 6
30) En una gráfica como la siguiente:
Se puede interpretar que:
A) El equilibrio de la materia no se crea ni se destruye solo se transforma.
B) Ésta reacción no tiende al equilibrio.
C) Ésta reacción tiende a la formaciòn de reactivo, por lo que no es espontànea.
D) El equilibrio de esta reacciòn no puede ser alterado.
E) Corresponde a un equilibrio estático.
31) Dada la siguiente reacción redox:
Pb(s) + H+(ac) Pb+2(ac) + H2(g)
¿Cuál de las siguientes alternativas NO interviene en el equilibrio de la reacción?
I- Agregar un reactivo que reaccione con H+.
II.- Agregar más el Pb(s).
III.- Aumentar la presión del sistema.
A) Solo I.
B) Solo II.
C) Solo I y II.
D) Solo I y III.
E) I, II y III.
32) Para la siguiente reacción en equilibrio:
N2(g) + O2(g) 2 NO(g)
¿Cuál de las siguientes alternativas influye y logra desplazar el equilibrio de esta reacción?
I.- Aumentar la presión.
II.- Presencia de un catalizador.
III.- Diminuir la concentración de O2 (g).
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo II y III.
E) I, II y III.
33) Para la reacción exotérmica en equilibrio:
2SO2 (g) + O2 (g) 2SO3 (g)
La constante Keq se modifica por un cambio en:
I.- La temperatura.
II.- Las concentraciones.
III.- La presión.
A) Solo I.
B) Solo II.
C) Solo III.
D) Solo I y II.
E) I, II y III.
Colegio Julio Montt Salamanca
Página 7
34) Dada la siguiente reacción:
Las concentraciones de las sustancias son SO2= 0,5 M; NO2= 0,6 M; SO3= 0,7 M y NO=
0,8 M respectivamente.
a) Calcular Keq:
b) Predecir hacia donde se desplaza el equilibrio si:
1.- Se aumenta la temperatura: _____________________________________
2.- Se aumenta la presión: _________________________________________
3.- Se añade SO2: ________________________________________________
4.- Se agrega NO: ________________________________________________
35) En la reacción: 2 H2S (g) + 3 O2 (g) 2 H2O (g) + 2 SO2 (g) + calor
Justifique cómo afectarán los siguientes cambios al desplazamiento del equilibrio (si se
desplaza hacia los reactivos o hacia los productos):
a) Disminuir la presión del recipiente donde ocurre la reacción:
___________________________________________________________________________
___________________________________________________________________________
b) Extraer SO2:
___________________________________________________________________________
___________________________________________________________________________
c) Aumentar la temperatura:
___________________________________________________________________________
___________________________________________________________________________
Colegio Julio Montt Salamanca
Página 8
S-ar putea să vă placă și
- Ciencias Naturales 6 BasicoDocument3 paginiCiencias Naturales 6 BasicoloretoÎncă nu există evaluări
- Resumen Propiedades Coligativas de Las SolucionesDocument9 paginiResumen Propiedades Coligativas de Las Solucionesarchivo_lcÎncă nu există evaluări
- Evaluación de Química 3° MedioDocument8 paginiEvaluación de Química 3° MedioloretoÎncă nu există evaluări
- Propiedades ColigativasDocument6 paginiPropiedades ColigativasloretoÎncă nu există evaluări
- El Agua PotableDocument7 paginiEl Agua PotableloretoÎncă nu există evaluări
- SolucionesDocument8 paginiSolucionesloretoÎncă nu există evaluări
- Evaluación de Química 2° Medio - Unidad IVDocument9 paginiEvaluación de Química 2° Medio - Unidad IVloretoÎncă nu există evaluări
- Evaluación de cambios puberales y ciclo menstrualDocument6 paginiEvaluación de cambios puberales y ciclo menstrualloreto100% (1)
- Alcanos: estructura y nomenclaturaDocument24 paginiAlcanos: estructura y nomenclaturaloreto100% (2)
- Hi GieneDocument3 paginiHi GieneloretoÎncă nu există evaluări
- Repaso MicroorganismosDocument3 paginiRepaso MicroorganismosloretoÎncă nu există evaluări
- Ley de La Gravitación UniversalDocument20 paginiLey de La Gravitación UniversalAlcides peñaÎncă nu există evaluări
- Filosofía antropológica: concepciones clásicas del ser humanoDocument3 paginiFilosofía antropológica: concepciones clásicas del ser humanoMichel Andrea Quintero GonzalezÎncă nu există evaluări
- UNIDAD I.1 MAGNITUDES FISICAS Y CINEMATICA CNDocument61 paginiUNIDAD I.1 MAGNITUDES FISICAS Y CINEMATICA CNDaniel LastreÎncă nu există evaluări
- Límite de Funciones (Alumnos)Document7 paginiLímite de Funciones (Alumnos)beatriz galindoÎncă nu există evaluări
- AsombroDocument2 paginiAsombroJocaro Filosofo100% (1)
- Reporte de Lectura. La Ciencia y Su MétodoDocument3 paginiReporte de Lectura. La Ciencia y Su Métodomrnobody182Încă nu există evaluări
- Diferencia entre moral y ética en HuauraDocument3 paginiDiferencia entre moral y ética en HuauraMiguel Carrillo FalcónÎncă nu există evaluări
- Quiz Lenguaje y PensamientoDocument12 paginiQuiz Lenguaje y PensamientosandraÎncă nu există evaluări
- Investigación cuantitativa, cualitativa y mixta: métodos y herramientasDocument65 paginiInvestigación cuantitativa, cualitativa y mixta: métodos y herramientasMarco SotoÎncă nu există evaluări
- Presentacion Unidad 3 MetrologiaDocument55 paginiPresentacion Unidad 3 MetrologiatorrefedericoÎncă nu există evaluări
- Prueba T de Diferencia de Medias y Prueba de Levene, Rubén J. RodríguezDocument12 paginiPrueba T de Diferencia de Medias y Prueba de Levene, Rubén J. RodríguezRubénÎncă nu există evaluări
- Objetivos InvestigaciónDocument20 paginiObjetivos InvestigaciónLeidy TorresÎncă nu există evaluări
- Dcart PDFDocument8 paginiDcart PDFReyChabalÎncă nu există evaluări
- Estado Del ArteDocument24 paginiEstado Del ArteFabian Enrique Beltran EspinosaÎncă nu există evaluări
- 3 Teorías Vocacionales Y Su Aportación A La Orientación PDFDocument32 pagini3 Teorías Vocacionales Y Su Aportación A La Orientación PDFJuan Miguel Rosales NinahuamanÎncă nu există evaluări
- Metodos de TendenciaDocument27 paginiMetodos de TendenciaJean Carlos Garcia GutierrezÎncă nu există evaluări
- CochranDocument16 paginiCochranaldairÎncă nu există evaluări
- Teoría de La Técnica-Horner PDFDocument42 paginiTeoría de La Técnica-Horner PDFCristian SepulvedaÎncă nu există evaluări
- Deontologia ForenseDocument39 paginiDeontologia Forensecesar alejandro camino castro100% (1)
- Tarea Estadistica U4Document4 paginiTarea Estadistica U4DanielaÎncă nu există evaluări
- Habitos Simples para Tiempos Complejos Berger Es 39244 PDFDocument7 paginiHabitos Simples para Tiempos Complejos Berger Es 39244 PDFProfe GoyesÎncă nu există evaluări
- Trabajo de FisicaDocument6 paginiTrabajo de FisicaLaura VanessaÎncă nu există evaluări
- El entrenamiento deportivo como ejemplo de aplicación de la mecánicaDocument4 paginiEl entrenamiento deportivo como ejemplo de aplicación de la mecánicaLey VillalobosÎncă nu există evaluări
- Identificación y Representación de Un ProblemaDocument3 paginiIdentificación y Representación de Un Problemareinaldo adrian Berdun100% (1)
- Estudios básicos y complementarios de topografía y batimetría en Camilaca, TacnaDocument14 paginiEstudios básicos y complementarios de topografía y batimetría en Camilaca, TacnaJORGE SARDON PAREDESÎncă nu există evaluări
- Tarea Semana 3Document6 paginiTarea Semana 3derly catalinaÎncă nu există evaluări
- Ensayo Varios Postulados de InvestigaciónDocument16 paginiEnsayo Varios Postulados de InvestigaciónJavy Reyes0% (1)
- Pre Laboratorio de Mediciones Eléctricas #2 PDFDocument3 paginiPre Laboratorio de Mediciones Eléctricas #2 PDFCarlos MillanÎncă nu există evaluări
- TESIS - Las Competencias Laborales y Su Relación Con La Calidad de Servicio en La Municipalidad Distrital de Pacasmayo - 2018Document84 paginiTESIS - Las Competencias Laborales y Su Relación Con La Calidad de Servicio en La Municipalidad Distrital de Pacasmayo - 2018INTELIGENCIA EDUCATIVAÎncă nu există evaluări
- Seps U3 Adl Version#1reaaDocument7 paginiSeps U3 Adl Version#1reaaDuulcee Bltrn Llms100% (1)