Documente Academic
Documente Profesional
Documente Cultură
Características de La Pepsina
Încărcat de
Gabriel Garcia0 evaluări0% au considerat acest document util (0 voturi)
468 vizualizări3 paginiLa pepsina es una enzima producida en el estómago que digiere proteínas. Funciona mejor en ambientes ácidos entre 37-42°C. Rompe proteínas en péptidos más pequeños. Puede inhibirse de forma competitiva o no competitiva. Los inhibidores competitivos compiten con el sustrato por el sitio activo, mientras que los no competitivos se unen a otros sitios e impiden la función enzimática.
Descriere originală:
Titlu original
Características-de-la-Pepsina
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentLa pepsina es una enzima producida en el estómago que digiere proteínas. Funciona mejor en ambientes ácidos entre 37-42°C. Rompe proteínas en péptidos más pequeños. Puede inhibirse de forma competitiva o no competitiva. Los inhibidores competitivos compiten con el sustrato por el sitio activo, mientras que los no competitivos se unen a otros sitios e impiden la función enzimática.
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
468 vizualizări3 paginiCaracterísticas de La Pepsina
Încărcat de
Gabriel GarciaLa pepsina es una enzima producida en el estómago que digiere proteínas. Funciona mejor en ambientes ácidos entre 37-42°C. Rompe proteínas en péptidos más pequeños. Puede inhibirse de forma competitiva o no competitiva. Los inhibidores competitivos compiten con el sustrato por el sitio activo, mientras que los no competitivos se unen a otros sitios e impiden la función enzimática.
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 3
Trabajo de Bioquímica
Nombre: Daniela Guanga
Características de la Pepsina
Esta enzima no es exclusiva del ser humano. También es producida en el estómago de
varios animales y actúa desde etapas tempranas de la vida, colaborando en la digestión
de las proteínas provenientes de los lácteos, carnes, huevos y granos, principalmente.
La actividad de la pepsina es mayor en ambientes muy ácidos (pH 1,5 – 2) y con
temperaturas que oscilan entre 37 y 42 ºC.
Su principal sitio de acción es el estómago. Este hecho puede explicarse fácilmente
entendiendo que la acidez estomacal es la condición ideal para su desempeño (pH 1,5-
2,5). De hecho, cuando el bolo alimenticio pasa del estómago al duodeno, la pepsina se
inactiva al encontrar un medio intestinal con pH básico.
(Smith, Margaret y Morton, Dion, 2010).
Como actúa en el organismo
La pepsina es una poderosa enzima presente en el jugo gástrico que ayuda en la digestión
de las proteínas.
Se trata en realidad de una endopeptidasa cuya tarea principal es desintegrar las proteínas
alimenticias en pequeñas partes conocidas como péptidos, las cuales son absorbidas luego
por el intestino o degradadas por enzimas pancreáticas.
La pepsina también actúa en la sangre. Aunque este efecto es controversial, ciertos
investigadores afirman que la pepsina pasa a la sangre, donde continúa digiriendo ciertos
péptidos de cadena larga o aquellos que no han sido degradados por completo.
Cuando la pepsina abandona el estómago y se encuentra en un ambiente con pH neutro o
básico, cesa su función. Sin embargo, al no hidrolizarse puede activarse nuevamente si el
medio se reacidifica.
(Smith, Margaret y Morton, Dion, 2010).
Sustrato de la Pepsina
La Proteasa es el sustrato de la pepsina, son enzimas que rompen los enlaces peptídicos de
las proteínas. Usan una molécula de agua para hacerlo y por lo tanto se clasifican como
hidrolasas. (Smith, Margaret y Morton, Dion, 2010).
Inhibidores
Competitivos
Un inhibidor puede unirse a una enzima y bloquear la unión del sustrato, por ejemplo, al pegarse
al sitio activo. Esto se conoce como inhibición competitiva porque el inhibidor "compite" con el
sustrato por la enzima. Es decir, solo el inhibidor o bien el sustrato puede estar unido a la enzima
en un momento dado. (Khanacademy, 2018)
Si un inhibidor es competitivo, disminuirá la velocidad de reacción cuando no hay mucho sustrato,
pero si hay mucho sustrato, este "ganará". Es decir, la enzima de cualquier forma puede alcanzar
la velocidad máxima de reacción siempre que haya suficiente sustrato. En ese caso, casi todos los
sitios activos de casi todas las moléculas de enzima estarán ocupadas por el sustrato en lugar del
inhibidor. (Khanacademy, 2018)
No Competitivos
En la inhibición no competitiva, el inhibidor no bloquea la unión del sustrato con el sitio activo,
sino que se pega a otro sitio y evita que la enzima haga su función. Se dice que esta inhibición es
"no competitiva" porque el inhibidor y el sustrato pueden estar unidos a la enzima al mismo
tiempo. (Khanacademy, 2018)
Si un inhibidor es no competitivo, la reacción catalizada por la enzima jamás llegará a su
velocidad de reacción máxima normal, incluso en presencia de mucho sustrato. Esto se debe a
que las moléculas de enzima que están unidas al inhibidor no competitivo están "envenenadas" y
no pueden hacer su función, independientemente de la cantidad disponible de sustrato.
(Khanacademy, 2018)
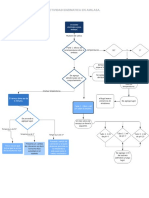
Fig.1. Explicación de Inhibidores. (Khanacademy, 2018)
Irreversibles
Algunos inhibidores se combinan de modo permanente con el enzima uniéndose covalentemente
a algún grupo funcional esencial para la catálisis con lo que el enzima queda inactivado
irreversiblemente. El estudio de este tipo de inhibidores ha resultado de gran utilidad para
identificar los grupos funcionales esenciales para la catálisis en aquellos enzimas a los que
inactivan. Este tipo de inhibición se conoce también como "envenenamiento" del enzima.
(Bionava, 2012).
Factores que afectan a la enzima
Bibliografía
Khanacademy, (2018). Regulación Enzimática. Obtenido de:
https://es.khanacademy.org/science/biology/energy-and-enzymes/enzyme-
regulation/a/enzyme-regulation
Smith, Margaret y Morton, Dion (2010). The Stomach: Basic Functions. The Digestive
System, segunda edición, capítulo 3, 39-50.
Bionava, (2012). Enzimas. Obtenido de:
http://www.bionova.org.es/biocast/documentos/tema14.pdf
S-ar putea să vă placă și
- Práctica #5.Document16 paginiPráctica #5.Luis David GonzalezÎncă nu există evaluări
- Lab 1 DETERMINACIÓN DEL PUNTO ISOLECTRICO Y LA CAPACIDAD BUFFER DE UN AMINO ACIDODocument2 paginiLab 1 DETERMINACIÓN DEL PUNTO ISOLECTRICO Y LA CAPACIDAD BUFFER DE UN AMINO ACIDOWilquinson EG50% (2)
- Informe 13 - ProteinasDocument5 paginiInforme 13 - ProteinasSilvia PastusoÎncă nu există evaluări
- Proteasas para La CoagulacionDocument18 paginiProteasas para La CoagulacionAlexander UFÎncă nu există evaluări
- Tecnologias Reporte 1Document4 paginiTecnologias Reporte 1Nell GonzálezÎncă nu există evaluări
- Bioquímica de Los Ácidos GrasosDocument8 paginiBioquímica de Los Ácidos GrasosEYMMI CELESTE MACHACA COAQUIRA100% (1)
- Saponificacion PDFDocument5 paginiSaponificacion PDFLauroDelAguilaDavilaÎncă nu există evaluări
- Informe No 7 - Identificacion de Los LipidosDocument9 paginiInforme No 7 - Identificacion de Los LipidosJose Daniel Lopez100% (1)
- Protein AsDocument11 paginiProtein Asrosa salazarÎncă nu există evaluări
- Bioquimica 56 Metabolismo Valentina SalazarDocument5 paginiBioquimica 56 Metabolismo Valentina Salazarjuan diego villadiego arroyoÎncă nu există evaluări
- Valtek GlucosaDocument1 paginăValtek GlucosaAlexandra Carbonel JulianÎncă nu există evaluări
- Bioquimica - 49 - Tarea 2Document57 paginiBioquimica - 49 - Tarea 2Marcela AudorÎncă nu există evaluări
- Procedimento para La Determinacion de Calcio en SueroDocument2 paginiProcedimento para La Determinacion de Calcio en SueroLaura Saavedra OlmosÎncă nu există evaluări
- Seminario de XenobioticosDocument42 paginiSeminario de XenobioticosDaya Ticona TiñaÎncă nu există evaluări
- Flujograma de Actividad EnzimaticaDocument1 paginăFlujograma de Actividad EnzimaticaIrene VidalÎncă nu există evaluări
- Informe EnzimasDocument10 paginiInforme EnzimasMildred OrtegateÎncă nu există evaluări
- Practica 05. Inhibidores de La Actividad EnzimaticaDocument3 paginiPractica 05. Inhibidores de La Actividad EnzimaticaChristian0% (1)
- Extracción de La Caseina y Determinación Del Punto IsoelectricoDocument8 paginiExtracción de La Caseina y Determinación Del Punto IsoelectricoRufino Valladares100% (1)
- Renocimiento de ProteinaDocument7 paginiRenocimiento de ProteinaSamir Enrique Pernett OquendoÎncă nu există evaluări
- La Cromatografía de Intercambio IónicoDocument8 paginiLa Cromatografía de Intercambio IónicoAngelo GonzalezÎncă nu există evaluări
- Bioquímica 2 Práctica 3 - AmilasaDocument5 paginiBioquímica 2 Práctica 3 - AmilasaAna Sopisha100% (2)
- Bioquímica - 14 - Tarea 3Document23 paginiBioquímica - 14 - Tarea 3Cristian Andres Medina0% (1)
- Practica 5 Transaminasas LbqiiDocument7 paginiPractica 5 Transaminasas LbqiiDiego AramburoÎncă nu există evaluări
- Macromoléculas de La Levadura 2Document7 paginiMacromoléculas de La Levadura 2marcela velasquezÎncă nu există evaluări
- Importancia Del Ciclo de KrebsDocument6 paginiImportancia Del Ciclo de KrebsCamila Orta100% (2)
- Glucosa Sérica PDFDocument42 paginiGlucosa Sérica PDFMarys Aucanshala LazoÎncă nu există evaluări
- Ketoconazol AnalisisDocument2 paginiKetoconazol Analisischiw.Încă nu există evaluări
- 13 Transporte y Almacenamiento de Los LípidosDocument20 pagini13 Transporte y Almacenamiento de Los LípidosRaysa OrtizÎncă nu există evaluări
- Mapa ConceptualDocument1 paginăMapa ConceptualGloria Maza OsccoÎncă nu există evaluări
- Practica N 7 PDFDocument22 paginiPractica N 7 PDFRuth Izquierdo100% (1)
- Tema 48 BIOSÍNTESIS DE FOSFOACILGLICÉRIDOSDocument4 paginiTema 48 BIOSÍNTESIS DE FOSFOACILGLICÉRIDOSAkimita100% (1)
- Informe de Electroforesis de ProteinasDocument15 paginiInforme de Electroforesis de ProteinasNicolas Sanchez GomezÎncă nu există evaluări
- Laboratorio BioquímicaDocument30 paginiLaboratorio BioquímicaGladys Alba Baquero VizcainoÎncă nu există evaluări
- Practica N°14Document35 paginiPractica N°14DEISY ROJAS0% (1)
- Factores Que Modifican La Actividad EnzimáticaDocument2 paginiFactores Que Modifican La Actividad EnzimáticaRuby Medina Zavaleta100% (3)
- Practica NR 4Document11 paginiPractica NR 4Maria Joa Luyo AntonioÎncă nu există evaluări
- Informe Laboratorio EnzimasDocument11 paginiInforme Laboratorio Enzimasdanna varonÎncă nu există evaluări
- Cromatografia de AfinidadDocument1 paginăCromatografia de AfinidadJosabet Narvaez0% (1)
- Farmacologia 2Document12 paginiFarmacologia 2Hans Ayllon ChambergoÎncă nu există evaluări
- Aspirina InformeDocument20 paginiAspirina InformeEduardo Poma100% (1)
- Peroxidación LipídicaDocument5 paginiPeroxidación LipídicaKatherine Salazar AgüeroÎncă nu există evaluări
- LuteinaDocument7 paginiLuteinaArnaldo OrtizÎncă nu există evaluări
- Glucosa Hexoquinasa PDFDocument2 paginiGlucosa Hexoquinasa PDFFujiko Saavedra Leiva100% (2)
- Practica 12Document3 paginiPractica 12José A. CóndorÎncă nu există evaluări
- Bioquimica - Grupo43-Tarea 2 - Enzimología y Bioenergética-FinalDocument43 paginiBioquimica - Grupo43-Tarea 2 - Enzimología y Bioenergética-FinalRuthÎncă nu există evaluări
- PR. 10 Detección de Fitatos Por El Método de Haug y LantzschDocument4 paginiPR. 10 Detección de Fitatos Por El Método de Haug y LantzschLesly Nayeli JPÎncă nu există evaluări
- Dipirona Calculo de Principio ActivoDocument5 paginiDipirona Calculo de Principio ActivoGaby LimachiÎncă nu există evaluări
- Profarmacos 1Document38 paginiProfarmacos 1Joubert Diaz MarinÎncă nu există evaluări
- SuspensionesDocument10 paginiSuspensionesPilar Santa Cruz0% (1)
- 2) Neuroepilepticos AntimaniacosDocument10 pagini2) Neuroepilepticos AntimaniacosLucero Montes HuanquiÎncă nu există evaluări
- METABOLISMO Aminoacidos.Document30 paginiMETABOLISMO Aminoacidos.ANDREA MILENA PRADA YARAÎncă nu există evaluări
- Induccion e Inhibicion de Procesos Enzimaticos-2017Document9 paginiInduccion e Inhibicion de Procesos Enzimaticos-2017Antonio Sebastián Guzmán GutiérrezÎncă nu există evaluări
- Fármacos Que Afectan La Síntesis de ProteínasDocument6 paginiFármacos Que Afectan La Síntesis de ProteínasLILIAN LIDUVINA QUISPE MAMANIÎncă nu există evaluări
- Actividad #02 - Taller de Seguimiento FarmacoterapéuticoDocument6 paginiActividad #02 - Taller de Seguimiento FarmacoterapéuticodeysiÎncă nu există evaluări
- Protocolo de Prácticas de Laboratorio Virtual de BioquímicaDocument47 paginiProtocolo de Prácticas de Laboratorio Virtual de BioquímicaKELLY DELGADOÎncă nu există evaluări
- Informe Succinato DeshidrogenasaDocument7 paginiInforme Succinato DeshidrogenasaStiven SevillaÎncă nu există evaluări
- Tarea 2 - Enzimologia y Catalisis.Document31 paginiTarea 2 - Enzimologia y Catalisis.JAWERÎncă nu există evaluări
- Laboratorio de Bioquímica 4Document14 paginiLaboratorio de Bioquímica 4Ivonne Moreno AguilarÎncă nu există evaluări
- Unidad 2 Tarea 2 Enzimologia y CatalisisDocument31 paginiUnidad 2 Tarea 2 Enzimologia y CatalisisJAWERÎncă nu există evaluări
- Bioquimica Informe 3 UpsjbDocument24 paginiBioquimica Informe 3 UpsjbJesus Flores Campos100% (2)
- Fundación NuvesDocument5 paginiFundación NuvesGabriel GarciaÎncă nu există evaluări
- Deber 4Document7 paginiDeber 4Gabriel GarciaÎncă nu există evaluări
- Unidad Educativa Fiscomisional Santo Tomas Apóstol Riobamb1Document22 paginiUnidad Educativa Fiscomisional Santo Tomas Apóstol Riobamb1Gabriel GarciaÎncă nu există evaluări
- Análisis Instrumental PotenciométriaDocument11 paginiAnálisis Instrumental PotenciométriaGabriel GarciaÎncă nu există evaluări
- Clase SolucionDocument45 paginiClase SolucionGabriel GarciaÎncă nu există evaluări
- Resumen Benceno y Sus DerivadosDocument12 paginiResumen Benceno y Sus DerivadosGabriel Garcia100% (1)
- Biologia Herencia y EvolucionDocument15 paginiBiologia Herencia y EvolucionGabriel GarciaÎncă nu există evaluări
- Laboratorio 1Document8 paginiLaboratorio 1Gabriel GarciaÎncă nu există evaluări
- Biologia FVDocument7 paginiBiologia FVGabriel GarciaÎncă nu există evaluări
- EVOLUCIÓNDocument21 paginiEVOLUCIÓNGabriel GarciaÎncă nu există evaluări
- Vitaminas InformeDocument10 paginiVitaminas InformeGabriel GarciaÎncă nu există evaluări
- Marco TeóricoDocument7 paginiMarco TeóricoGabriel Garcia0% (1)
- Clase 4.derivados de Hidrocarburos Alif TicosDocument104 paginiClase 4.derivados de Hidrocarburos Alif TicosGabriel GarciaÎncă nu există evaluări
- Lab 7. OBTENCION DE ACETILENO POR HIDRATACION DE CARBURO DE CALCIO. Enero 2017Document7 paginiLab 7. OBTENCION DE ACETILENO POR HIDRATACION DE CARBURO DE CALCIO. Enero 2017Génesis NarváezÎncă nu există evaluări
- Acidos Grasos Más Comunes en AlimentosDocument5 paginiAcidos Grasos Más Comunes en AlimentosRosa Garcia GamarraÎncă nu există evaluări
- Nomenclatura ORGANIACADocument11 paginiNomenclatura ORGANIACAKim MiniÎncă nu există evaluări
- Preguntas Lab Acidos CarboxilicosDocument4 paginiPreguntas Lab Acidos CarboxilicosJFGC100% (2)
- EnzimasDocument61 paginiEnzimasGeraldine Huarcaya Olivera100% (1)
- Balance de Masa para Bioprocesos Con Crecimiento Celular TeoríaDocument34 paginiBalance de Masa para Bioprocesos Con Crecimiento Celular TeoríaRAMOS OLLACHICA MARYORI JENNIFERÎncă nu există evaluări
- Cetonas AromáticasDocument12 paginiCetonas AromáticasNadia Rangel50% (2)
- Farmacos AntiparkinsonianosDocument3 paginiFarmacos AntiparkinsonianostarcilatinocoÎncă nu există evaluări
- Tema 4. TranscripciónDocument45 paginiTema 4. TranscripciónDaniel MorenoÎncă nu există evaluări
- Imprimir en Opalina PDFDocument10 paginiImprimir en Opalina PDFJazysaraiÎncă nu există evaluări
- Guia de Clase Biología 9.2Document6 paginiGuia de Clase Biología 9.2Isabel BastoÎncă nu există evaluări
- Continuación de Generacion de Vinaza en Destil. FraccionariaDocument2 paginiContinuación de Generacion de Vinaza en Destil. Fraccionariaprueba321Încă nu există evaluări
- Labo Fukuda 6Document7 paginiLabo Fukuda 6Andres Espinoza ContrerasÎncă nu există evaluări
- ALGODÓNDocument4 paginiALGODÓNDavid Arom Elorreaga AlferezÎncă nu există evaluări
- Micela de Caseína PDFDocument98 paginiMicela de Caseína PDFrogerÎncă nu există evaluări
- Análisis SaraDocument52 paginiAnálisis SaraJader Navarro Infante100% (14)
- Via de La Pentosa-FosfatoDocument18 paginiVia de La Pentosa-FosfatoMarieta MOreira PincayÎncă nu există evaluări
- Glicerina USP - Boletín TécnicoDocument1 paginăGlicerina USP - Boletín Técnico(Doc - Bto) Renato Alejandro Andara EscalonaÎncă nu există evaluări
- General I Dad EsDocument5 paginiGeneral I Dad EsNoe ValdeiglesiasÎncă nu există evaluări
- Instrucción Pintura Alto TraficoDocument47 paginiInstrucción Pintura Alto TraficorodrigoÎncă nu există evaluări
- 98045-LO LA SpeedexDocument4 pagini98045-LO LA SpeedexIvan GomezÎncă nu există evaluări
- Sintesis de Contenidos BioDocument24 paginiSintesis de Contenidos Biomiasis8877Încă nu există evaluări
- Extruido de QuinuaDocument93 paginiExtruido de QuinuaRonaldAlexisRaymondiRamosÎncă nu există evaluări
- Generalidades de Los Plaguicidas Renovada 2Document25 paginiGeneralidades de Los Plaguicidas Renovada 2Jose Miguel Quintero33% (3)
- CAMBIOS EN LA COMPOSICIÓN QUIMICA DEL FORRAJE DE MARALFALFA (Pennisetum SP.) CON LA EDAD DE LA PLDocument73 paginiCAMBIOS EN LA COMPOSICIÓN QUIMICA DEL FORRAJE DE MARALFALFA (Pennisetum SP.) CON LA EDAD DE LA PLIram BonfilÎncă nu există evaluări
- CbunormaDocument3 paginiCbunormaChrisLevaMHÎncă nu există evaluări
- Practica 9 Grupal-Proteinas, AminoacidosDocument29 paginiPractica 9 Grupal-Proteinas, AminoacidosCynthia GonzalesÎncă nu există evaluări
- Punto IsolectricoDocument9 paginiPunto IsolectricoBelychy ChristopherÎncă nu există evaluări
- 5 Refrigerantes1Document51 pagini5 Refrigerantes1HumnerÎncă nu există evaluări
- Seminario Practica 5 - FarmoDocument30 paginiSeminario Practica 5 - FarmoNancy SánchezÎncă nu există evaluări