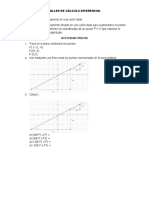
Documente Academic
Documente Profesional
Documente Cultură
Esteq - 01 MIO PDF
Încărcat de
Antonio Ruiz MartinezDescriere originală:
Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Esteq - 01 MIO PDF
Încărcat de
Antonio Ruiz MartinezDrepturi de autor:
Formate disponibile
“Sapere Aude”
C/ Ronda de los molinos s/n · 41400 Écija
email: fisicayquimica@iesnicolascopernico.org www.iesnicolascopernico.org/fisica.htm
BOLETÍN IV de QUÍMICA ∙ CUARTO de ESO
1. Calcular la masa de tricloruro de fósforo, PCl3, que se necesita para obtener 100 g de PF 3 según la
reacción
PCl3 + HF → PF3 + HCl
2. Sea la reacción TiCl4 + H2S → TiS2 + HCl
a) Calcula los moles de HCl producidos a partir de 3 moles de H 2S; b) Moles de H2S que reaccionan
con 2 moles de TiCl4; c) Gramos de TiCl4 necesarios para que reaccionen 4 moles de H 2S; d) Masa de
TiS2 producidos a partir de 37,9 g de TiCl4
3. Se tratan 3,18 de Cu con HNO3 diluido según la reacción:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
a) ¿Cuántos gramos de NO se obtienen?; b) Sabiendo que el NO es un gas, ¿qué volumen ocuparía el
NO obtenido en e CN?; c) El HNO 3 que ha hecho falta para la reacción, se extrajo de una disolución
0,14 Molar. ¿Qué volumen hizo falta?
4. Determinar la composición centesimal del agua oxigenada, H2O2.
5. En un recipiente de 50 L introducimos 2 g de CO y 2 g de O 2 de tal modo que provocamos la reacción
gaseosa
CO + O2 → CO2
a) ¿Qué sustancias y en qué cantidad se obtienen al final de la reacción?; b) ¿Qué volumen ocuparían
los gases finales de la reacción en CN?
6. El propano puede reaccionar con oxígeno según la reacción C3H8 + O2 → CO2 + H2O. a) Calcula el
volumen de oxígeno necesario (en CN) para que reaccionen 5 L de propano que están a 20 ºC y 1,2
atm; b) ¿Cuántas moléculas de CO2 se obtienen al final de la reacción anterior?
7. Cierta sustancia química de masa molecular 98 u, posee la siguiente composición centesimal: S
(32,65 %); O (65,31 %); H (2,04 %). Determinar su fórmula empírica y su fórmula molecular.
8. El Na(OH) y el H2SO4 reaccionan para formar Na2SO4 y agua. a) Escribe y ajusta la reacción; b)
Hacemos reaccionar 80 mL de una disolución 0,42 M de Na(OH) con 12 mL de una disolución de
H2SO4 que tiene una riqueza en ácido del 28 % y una densidad de 1,15 g/mL. Determinar qué masa
de Na2SO4 se obtiene y qué masa de reactivo sobra.
9. ¿Qué masa de Fe se puede obtener a partir de 1 tonelada de FeS 2?
10. Hallar la fórmula empírica de la rodomita, si su composición centesimal es 41,93 % de Mn, 21,43 %
de Si y el 36,63 % de O.
11. En la electrolisis del agua, se obtiene oxígeno e hidrógeno. ¿Qué cantidad de esos gases se
producirían a partir de 34,82 g de agua?
12. ¿Cuántos gramos de Cl2O7 se obtendrán a partir de 100 g de cloro gaseoso, Cl2?
13. La descomposición de 10,152 g de un compuesto proporcionó 0,102 g de H, 3,253 g de S, 4,869 g de
O y 1,927 g de F. Determinar la fórmula empírica del compuesto.
14. Determinar la composición centesimal del sulfato de hierro (III), Fe2(SO4)3
∙ LINUX + OpenOffice ∙
S-ar putea să vă placă și
- Práctica Física y Química Oposiciones Secundaria PDFDocument20 paginiPráctica Física y Química Oposiciones Secundaria PDFMarie_79100% (1)
- 11 +inmunogentéticaDocument11 pagini11 +inmunogentéticaAntonio Ruiz MartinezÎncă nu există evaluări
- Economia Ejemplo PDFDocument4 paginiEconomia Ejemplo PDFAntonio Ruiz MartinezÎncă nu există evaluări
- Economia EstructuraDocument1 paginăEconomia EstructuraAntonio Ruiz MartinezÎncă nu există evaluări
- Repaso de Quimica 1º BachilleratoDocument17 paginiRepaso de Quimica 1º BachilleratoAntonio Ruiz MartinezÎncă nu există evaluări
- PDFDocument8 paginiPDFAntonio Ruiz MartinezÎncă nu există evaluări
- 1ESODocument43 pagini1ESOEduar Isidori100% (1)
- Tabla Con ValenciaDocument1 paginăTabla Con ValenciaAntonio Ruiz MartinezÎncă nu există evaluări
- Qu Ica (Examen, Titular)Document1 paginăQu Ica (Examen, Titular)Antonio Ruiz MartinezÎncă nu există evaluări
- Ejercicios Resueltos Ecuacion de BernoulliDocument3 paginiEjercicios Resueltos Ecuacion de BernoulliYovany GutierrezÎncă nu există evaluări
- 03glucidos PDFDocument12 pagini03glucidos PDFAntonio Ruiz MartinezÎncă nu există evaluări
- PROTEINASDocument14 paginiPROTEINASLars_max_10Încă nu există evaluări
- PAUFisica Moderna EsDocument38 paginiPAUFisica Moderna EsAntonio Ruiz MartinezÎncă nu există evaluări
- Introducción PDFDocument6 paginiIntroducción PDFDiego M Camargo AÎncă nu există evaluări
- Ejercicios Resueltos Ecuacion de BernoulliDocument3 paginiEjercicios Resueltos Ecuacion de BernoulliYovany GutierrezÎncă nu există evaluări
- Endo Morfi S MosDocument9 paginiEndo Morfi S MosAntonio Ruiz MartinezÎncă nu există evaluări
- Ejercicios Resueltos Ecuacion de BernoulDocument4 paginiEjercicios Resueltos Ecuacion de BernoulAntonio Ruiz MartinezÎncă nu există evaluări
- Matemáticas CcssDocument3 paginiMatemáticas CcssAntonio Ruiz MartinezÎncă nu există evaluări
- ECONOMÍADocument4 paginiECONOMÍAAntonio Ruiz MartinezÎncă nu există evaluări
- CICLACIÓNDocument2 paginiCICLACIÓNAntonio Ruiz MartinezÎncă nu există evaluări
- PROBLEMAS DE OPTIMIZACIoN RESUELTOSDocument4 paginiPROBLEMAS DE OPTIMIZACIoN RESUELTOSGianpierre Novoa AdrianzenÎncă nu există evaluări
- Limites Usando La DefinicionDocument1 paginăLimites Usando La DefinicionAntonio Ruiz MartinezÎncă nu există evaluări
- Tema 4 Mates 4 EsoDocument2 paginiTema 4 Mates 4 EsoPantera RosaÎncă nu există evaluări
- Guia Resuelta ProbabilidadesDocument2 paginiGuia Resuelta ProbabilidadesAntonio Ruiz MartinezÎncă nu există evaluări
- 3-3 1 HP120514 - FisMod - SolDocument5 pagini3-3 1 HP120514 - FisMod - Soldavid7cobosÎncă nu există evaluări
- Numeros Reales Boletin 3º EsoDocument12 paginiNumeros Reales Boletin 3º EsoAntonio Ruiz MartinezÎncă nu există evaluări
- Examenfisicacuantica I PDFDocument13 paginiExamenfisicacuantica I PDFAntonio Ruiz MartinezÎncă nu există evaluări
- Estructuras de Lewis GuiaDocument6 paginiEstructuras de Lewis Guiaprofe_astrid_alvarezÎncă nu există evaluări
- Movimientos en El PlanoDocument4 paginiMovimientos en El PlanoAntonio Ruiz MartinezÎncă nu există evaluări
- InfografiaDocument2 paginiInfografiaJuan David Perez PavaÎncă nu există evaluări
- Introduccion A La Reología PDFDocument60 paginiIntroduccion A La Reología PDFtincho9Încă nu există evaluări
- Cotizacion Materiales LaboratorioDocument3 paginiCotizacion Materiales LaboratorioOlger FJÎncă nu există evaluări
- Tareacolaborativaderepartoproporcional PDFDocument3 paginiTareacolaborativaderepartoproporcional PDFpaola pinillos58% (12)
- Entrenamiento para Examen de Acueducto2021 - 1Document14 paginiEntrenamiento para Examen de Acueducto2021 - 1jazzy SanÎncă nu există evaluări
- Ficha 01 Resolvemos Situaciones Cotidianas Que Involucran Operaciones de Adición y Sustracción de Números EnterosDocument3 paginiFicha 01 Resolvemos Situaciones Cotidianas Que Involucran Operaciones de Adición y Sustracción de Números EnterosNaveguit OÎncă nu există evaluări
- Captura 2022-09-13 A Las 11.20.59Document17 paginiCaptura 2022-09-13 A Las 11.20.59promocion426.156Încă nu există evaluări
- Clase 05 Curso 3MDocument5 paginiClase 05 Curso 3Mdaniel diazÎncă nu există evaluări
- Libro Mecanica ComputacionalDocument394 paginiLibro Mecanica ComputacionalRichard Guerrero soberonÎncă nu există evaluări
- Cargas Térmicas Que Se Deben Calcular para Una Cava Cuarto o Cuarto Refrigerado (Herles Alvarez)Document9 paginiCargas Térmicas Que Se Deben Calcular para Una Cava Cuarto o Cuarto Refrigerado (Herles Alvarez)herlesÎncă nu există evaluări
- Triángulos, Congruencia, SemejanzaDocument6 paginiTriángulos, Congruencia, SemejanzaKeylev CastellanosÎncă nu există evaluări
- Lab4 Robotica Gutiérrezoppe KcanasaicoDocument15 paginiLab4 Robotica Gutiérrezoppe KcanasaicoEDISSON ALFREDO GUTIERREZ OPPEÎncă nu există evaluări
- Ingeniería de Las ReaccionesDocument13 paginiIngeniería de Las ReaccionesGenesis FalconesÎncă nu există evaluări
- 7 EnzimasDocument38 pagini7 EnzimasmarjoriÎncă nu există evaluări
- Divison de Un Segmento en Una Razon Dada 23032021 Taller de CálculoDocument3 paginiDivison de Un Segmento en Una Razon Dada 23032021 Taller de CálculogiloÎncă nu există evaluări
- Proyecto MarukDocument37 paginiProyecto MarukCatalina PedrazaÎncă nu există evaluări
- Proceso Calculo Vida Útil SKFDocument3 paginiProceso Calculo Vida Útil SKFAnder Arretxe GarcíaÎncă nu există evaluări
- Taller 2 ProbabilidadDocument20 paginiTaller 2 ProbabilidadSantiago Muñoz GuarnizoÎncă nu există evaluări
- Tema 8 Ejercicios - JavascripDocument4 paginiTema 8 Ejercicios - JavascripCarlos BeltranÎncă nu există evaluări
- Resumen de La Obra de TeatroDocument2 paginiResumen de La Obra de TeatroReyes BerthÎncă nu există evaluări
- TSQ1Document110 paginiTSQ1Cuauhtemoc Puebla100% (1)
- TUBO DE VENTURI y BoquillasDocument21 paginiTUBO DE VENTURI y BoquillasEleaZar Kyofet InediToÎncă nu există evaluări
- Trabajo Grupal - Eval Riesgos AmbientalesDocument12 paginiTrabajo Grupal - Eval Riesgos AmbientalesRossy Yasmin Flores ZarateÎncă nu există evaluări
- MICROSOFT EXCEL Gab de JesDocument4 paginiMICROSOFT EXCEL Gab de JesYoari MejíaÎncă nu există evaluări
- Comportamiento de Afluencia de Formaciones ProductorasDocument11 paginiComportamiento de Afluencia de Formaciones ProductorasJens Araujo Carrillo50% (2)
- Mecánica Newtoniana: 2020 A Hoja de Trabajo 5Document5 paginiMecánica Newtoniana: 2020 A Hoja de Trabajo 5Leonardo SerranoÎncă nu există evaluări
- 5-Materia Grasa en Oleaginosas - Instituto Argentino de Sanidad y Calidad VegetalDocument5 pagini5-Materia Grasa en Oleaginosas - Instituto Argentino de Sanidad y Calidad VegetalRomina AguileraÎncă nu există evaluări
- Seminario de Micro PredictivaDocument27 paginiSeminario de Micro PredictivamelyÎncă nu există evaluări
- Matemáticas para Los Negocios - Semana 2 - P ( - )Document7 paginiMatemáticas para Los Negocios - Semana 2 - P ( - )Amy La ChiraÎncă nu există evaluări
- Tarea 3Document2 paginiTarea 3Santiago Angarita100% (1)