Documente Academic
Documente Profesional
Documente Cultură
Boletin 5
Încărcat de
Ruben FernandezDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Boletin 5
Încărcat de
Ruben FernandezDrepturi de autor:
Formate disponibile
TÉCNICAS ANALÍTICAS (2013-2014). BOLETÍN 5.
CALIBRACIÓN
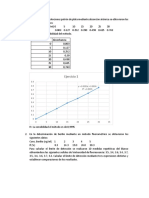
1.- Para determinar sodio en una muestra de suero sanguíneo, se realizaron varias medidas por emisión
atómica. A continuación se presentan en la tabla las intensidades de emisión obtenidas para estándares de
2, 4, 6, 8 y 10 ng/mL de suero. Las intensidades de emisión obtenidos se corrigieron para cualquier
emisión del blanco. El valor medio para la intensidad del blanco fue, para una concentración de sodio de
0 ng/mL, fue de 0.000 con una desviación estándar de 0.00071 unidades de absorbancia.
Na ng/mL Intensidad emisión
2.0 0.19
4.0 0.41
6.0 0.61
8.0 0.79
10.0 1.01
(a) calcule la mejor recta de regresión posible mediante mínimos cuadrados
(b) calcule la sensibilidad del método
(c) Calcule la concentración de sodio en una muestra de suero, cuyo valor de intensidad de emisión
medido fue de 0.58.
(d) calcule el límite de detección para k=3.
Sol.: y = 0,1007x-0.0019 ; sensibilidad: 0,1007 ng/mL ; muestra : x= 5,78 ng/mL
Límite detección: 0.040 ng/mL
2.- Los datos que se presentan a continuación corresponden a la determinación colorimétrica de glucosa
en suero sanguíneo.
Conc glucosa mM Absorbancia
2.0 0.150
4.0 0.294
6.0 0.440
8.0 0.610
10.0 0.750
(a) Suponiendo una relación lineal entre concentración y respuesta, calcule mediante mínimos cuadrados
la mejor ecuación de la recta
(b) una muestra de suero dio una absorbancia de 0.350 de unidades de absorbancia. Calcular la
concentración en glucosa de esa muestra.
(c) Tras realizar seis medidas de un blanco de calibrado, los valores obtenidos fueron: 0.001 0.002
0.001 0.002 0.002 0.001 unidades de absorbancia. Calcular el límite de detección.
Sol.: y = 0.0758x -0.006 ; sensibilidad: 0,0758 mM ; muestra : x = 4.70 mM
Límite detección 0.121 mM
3.- La concentración del ión sulfato en el agua natural se puede determinar midiendo la turbidez que
resulta al agregar un exceso de BaCl2 a una cantidad conocida de la muestra. Para medir la turbidez se
utilizó un turbidímetro. Para ello, se prepararon varias disoluciones patrón con cantidades variables de
sulfato y se midió su turbidez. Los resultados obtenidos se presentan a continuación:
mg sulfato /L lectura
5.0 1.48
10.0 2.82
15.0 4.31
20.0 5.96
a) Representar gráficamente los resultados y calcular, mediante mínimos cuadrados, la pendiente y
la ordenada en el origen.
b) Obtenga la concentración de sulfato en una muestra que dio una lectura en el turbidímetro de
2.48.
c) Tras realizar seis medidas de un blanco de calibrado, los valores obtenidos fueron: 0.01 0.03
0.04 0.02 0.01 0.03 0.02. Calcular el límite de detección. (mg sulfato /L)
d) De otra muestra de agua que se supone que tiene sulfato, se tomaron 25 ml y se diluyeron a 500
mL en un matraz aforado (disolución A). De esta disolución A se tomaron 100 ml y se trataron
igual que los patrones, con BaCl2, dando una lectura en el turbidimetro de 1,75 frente a la
disolución del blanco. Calcular la concentración de sulfato en la muestra inicial de agua.
Sol.: y = 0.2986x – 0.09 ; sensibilidad: 0.2986 mg/L ; muestra : x = 8.61 mg/L
Límite detección: 0.49 mg / L. Concentración: 123.2 mg/L
4.- Los datos de la siguiente tabla se obtuvieron durante una determinación colorimétrica de colesterol en
suero sanguíneo.
[Colesterol] 0 2.0 4.0 6.0 8.0 10.0
mM
Absorbancia 0.002 0.150 0.294 0.434 0.570 0.704
a) Construir la curva de calibrado
b) Suponiendo que las medidas realizadas para una muestra problema dieron como resultados valores de
0.352, 0.354, 0.353, 0.355 y suponiendo que la señal del blanco de muestra es de 0.009, calcular la
concentración de colesterol en la muestra.
Sol: a) Y=0.0701 X + 8.3x10-3 b) 4.92 ± 0.018 mM
5.- Una muestra de complejo vitamínico se analiza para hierro empleando la espectrofotometría de
absorción molecular. Para ello se forma un complejo coloreado entre el Fe+2 y el reactivo cromogénico
orto-fenantrolina, originándose un compuesto que presenta un máximo a la longitud de onda de 540 nm.
El procedimiento consistió en una digestión ácida de 0.220 g de una muestra de complejo vitamínico y su
dilución a 250 ml con agua destilada. Se construyó una recta de adición empleando alícuotas de 3 ml de la
disolución de complejo vitamínico y los volúmenes necesarios de la disolución de patrón de hierro para
tener las concentraciones mostradas en la tabla siguiente. Dichos patrones se prepararon en matraces de
25 ml.
[Fe] mg L-1 Señal analítica
0 0.026
10 0.057
20 0.090
30 0.121
40 0.153
blanco 0.007
Del mismo modo, se analizó un blanco de reactivo, siendo la absorbancia de 0.007 unidades.
a) Calcule la ecuación de regresión por mínimos cuadrados.
b) Se ajustan los datos a un modelo lineal.
c) ¿Cuál es la concentración de Fe en la muestra de complejo vitamínico, expresada en mg/g.
Sol: a) Y=3.18x10-3 + 0.0188 b) Si c) 55.6 mg/g
6.- La concentración de Cd en muestras de algas puede determinarse por espectrometría de absorción
atómica con cámara de grafito (GFAAS) midiendo la absorbancia del Cd a la longitud de onda de 228.8
nm. El instrumento utilizado para este análisis se calibró con una serie de disoluciones estándar (patrones)
de Cd(II) de concentración variable. En el calibrado se obtuvieron los siguientes resultados:
[Cd] µg l-1 Absorbancia
0.00 0.000
0.25 0.033
0.50 0.071
1.00 0.146
2.00 0.304
Se analizó una muestra de alga, la cual fue previamente sometida a una digestión ácida con microondas.
El procedimiento total fue el que se esquematiza a continuación: la muestra de alga, una vez
homogeneizada, se digirió por triplicado, siendo las masas de cada submuestra (M1, M2, M3) las dadas
en la tabla siguiente:
Alga (g) Absorbancia
M1: 0.3054 0.135
M2: 0.2977 0.128
M3: 0.2950 0.128
0.001
Blanco
Tras la digestión, el digerido se diluyó a 25.0 ml en matraces aforados de calidad contrastada. Previa a su
determinación, los tres digeridos de alga se diluyeron 10 veces (1.00 ml de digerido ácido diluido a 10
ml). Los valores de absorbancia obtenidos se muestran en la tabla anterior, al igual que la absorbancia
para el blanco (diluido de la misma forma que la muestra).
a) Calcule la ecuación de regresión por mínimos cuadrados entre las variables de [Cd] y la absorbancia.
b) ¿ Se ajustan los datos a un modelo lineal?
c) ¿Cuál es la concentración de Cd en la muestra de alga expresada en µg g-1?
Sol: a) Y=0.1529X-3.87 x 10-3 b) Si c) 0.727 ± 9.16 10-3 µg/g
7.- Con objeto de determinar el contenido en metil paraben (bactericida) en un producto de cuidado
personal se han tomando 0.5 mL del mismo y se han diluido con agua a 25 mL a continuación una
fracción de 5 mL se ha sometido a extracción líquido-líquido con 5 mL de acetato de etilo conteniendo
200 ng mL-1 de metil paraben marcado con 13C como patrón interno. Los extractos se han analizado por
GC-MS. La calibración se llevó a cabo con patrones de metil paraben de concentraciones crecientes (10-
1000 ng mL-1) preparados en acetato de etilo y conteniendo un nivel constante (200 ng mL-1) de patrón
interno. En base a los datos de la siguiente tabla calcule la concentración de metil paraben en la muestra
problema
Metil paraben (ng Patrón interno (ng mL- Señal Analito Señal patrón
mL-1) 1) interno
Patrones 0 200 102 1,01E+06
10 200 49000 1,02E+06
20 200 100000 1,01E+06
50 200 240000 1,00E+06
100 200 480000 1,01E+06
500 200 2,02E+06 8,67E+05
750 200 2,50E+06 6,90E+05
1000 200 3,97E+06 8,43E+05
Muestra …. 200 650000 1,01E+06
Sol. Y=0.00476x+0.0012; 683.4ng/mL
8.- Una muestra de agua de río se sometió a un proceso de extracción/preconcentración para determinar el
pesticida lindano. Para ello, se sometieron tres alícuotas distintas de la muestra de agua de río, de 250 ml
cada una, al procedimiento oficial de extracción de lindano, el cual implica un factor de preconcentración
de 150. Paralelamente se analizaron dos blancos (250 ml de agua destilada cada uno). La determinación
se llevó a cabo por cromatografía líquida de alta resolución (HPLC) siendo los datos de las áreas
(respuesta analítica) los listados en la tabla siguiente:
[lindano] µg L-1 Señal analítica
0 9
5 1145
10 2302
20 4577
40 9150
Alícuota 1 1247
Alícuota 2 1256
Alícuota 3 1255
Blanco 1 22
Blanco 2 18
Calcule la recta de ajuste por mínimos cuadrados y establezca la concentración media y la desviación
estándar de la concentración de lindano en la muestra de agua de río analizada.
Sol: Y=228.52X +8.5 r=0.9999 ; [lindano]=3.57 x 10-2 µg/L
S-ar putea să vă placă și
- 2-Espectroscopia Uv-VDocument13 pagini2-Espectroscopia Uv-VHector Martinez GregorioÎncă nu există evaluări
- ExamenDocument5 paginiExamenPAUL JHERSON CARCAHUSTO TUMBILLOÎncă nu există evaluări
- Sevilla Cruz Alfredo Salomón 3BM2 MC P9Document4 paginiSevilla Cruz Alfredo Salomón 3BM2 MC P9Alfredo SevillaÎncă nu există evaluări
- Trabajo 01Document1 paginăTrabajo 01Manuel VanegasÎncă nu există evaluări
- Ejercicios Ácidos Polipróticos y ComplejosDocument22 paginiEjercicios Ácidos Polipróticos y ComplejosSantiago100% (2)
- Problemas 2 Espectroscopia Casi FinalDocument9 paginiProblemas 2 Espectroscopia Casi FinalKelo CastestÎncă nu există evaluări
- Ben Emerita Universidad Autonoma de PueblaDocument7 paginiBen Emerita Universidad Autonoma de Pueblaandrea_te_amoÎncă nu există evaluări
- 3BM2 MC Ejp P12Document6 pagini3BM2 MC Ejp P12Diego CarreonÎncă nu există evaluări
- TALLER No. 1 EJERCICIOS Soluciones, Titulaciones Directas y Por Retroceso PDFDocument4 paginiTALLER No. 1 EJERCICIOS Soluciones, Titulaciones Directas y Por Retroceso PDFYulieth PedrazaÎncă nu există evaluări
- Curvas de calibración en bioquímicaDocument21 paginiCurvas de calibración en bioquímicaMayra RetamozoÎncă nu există evaluări
- Ejercicios Balance de EnergiaDocument7 paginiEjercicios Balance de EnergiaHernán ArrietaÎncă nu există evaluări
- 3BV1 2021-01 MC E8 Problemario3Document4 pagini3BV1 2021-01 MC E8 Problemario3Aislin IxchelÎncă nu există evaluări
- Linda T2 P2 Acido-Base AnaliticaDocument13 paginiLinda T2 P2 Acido-Base AnaliticaAna Paola SámanoÎncă nu există evaluări
- Comparación de Métodos de Volumetría de Precipitación para Análisis de Cloruro en Muestra Comercial de SueroDocument6 paginiComparación de Métodos de Volumetría de Precipitación para Análisis de Cloruro en Muestra Comercial de SueroNatalia León PatiñoÎncă nu există evaluări
- Resultados y DiscusiónDocument25 paginiResultados y DiscusiónDiana100% (1)
- Informe ComplejometriaDocument3 paginiInforme ComplejometriaAna Maria Suarez RojasÎncă nu există evaluări
- Taller Primer CorteDocument2 paginiTaller Primer Cortesantiago cardonaÎncă nu există evaluări
- Analisis - Probelmas de Curva de CalibraciónDocument4 paginiAnalisis - Probelmas de Curva de CalibraciónKevinRafaelJoséCuevasRamírezÎncă nu există evaluări
- Análisis química taller U. NacionalDocument4 paginiAnálisis química taller U. NacionalANGIE MEDINAÎncă nu există evaluări
- Determinacion Concentración Hierro en CementoDocument5 paginiDeterminacion Concentración Hierro en CementoSanti Hernandez RoncancioÎncă nu există evaluări
- Cuestionario 1 FQIIDocument4 paginiCuestionario 1 FQIIBryan BautistaÎncă nu există evaluări
- Taller BioestadísticaDocument7 paginiTaller BioestadísticamjmediÎncă nu există evaluări
- Análisis de plata y berilio mediante absorción atómica y fluorometríaDocument2 paginiAnálisis de plata y berilio mediante absorción atómica y fluorometríaNatasha VargasÎncă nu există evaluări
- Guia 1 - Metodos EspectroscopDocument5 paginiGuia 1 - Metodos EspectroscopJULITUS10000Încă nu există evaluări
- Análisis gravimétrico por precipitaciónDocument29 paginiAnálisis gravimétrico por precipitaciónRosmeri Delinda QUISPE FLORESÎncă nu există evaluări
- Espectro Infrarrojo 1 PROPANOLDocument5 paginiEspectro Infrarrojo 1 PROPANOLLaurel CarpenterÎncă nu există evaluări
- Determinacion de La Longitud de Onda OptimaDocument15 paginiDeterminacion de La Longitud de Onda OptimaKaren Perez0% (1)
- CURVAS DE CALIBRACIÓN DEL ANARANJADO DE METILO Y VERDE DE BROMOCRESOL Práctica 13Document2 paginiCURVAS DE CALIBRACIÓN DEL ANARANJADO DE METILO Y VERDE DE BROMOCRESOL Práctica 13Pamela Ponce MoralesÎncă nu există evaluări
- Lab Bioquimica 4 InformeDocument11 paginiLab Bioquimica 4 InformeCarlos Zamudio100% (1)
- Análisis simultáneo de dos componentesDocument13 paginiAnálisis simultáneo de dos componentesAnonymous chYtaltebÎncă nu există evaluări
- Todos Los EjerciciosDocument24 paginiTodos Los EjerciciosDani LoayzaÎncă nu există evaluări
- Ecuación balance CM flujo laminarDocument48 paginiEcuación balance CM flujo laminaralvaroCTÎncă nu există evaluări
- TareaDocument15 paginiTareaLuis Alberto Apaza ArceÎncă nu există evaluări
- Post Test UNIDAD 4Document2 paginiPost Test UNIDAD 4Jesus HernandezÎncă nu există evaluări
- PRÁCTICA 14 ColorimetríaDocument6 paginiPRÁCTICA 14 ColorimetríaPablo SensoÎncă nu există evaluări
- Practica #2 QMC 1400Document5 paginiPractica #2 QMC 1400Mariana Yugar VelasquezÎncă nu există evaluări
- AnalisisDocument13 paginiAnalisisCarlos ZambranoÎncă nu există evaluări
- Destilacion Fraccionada FinalDocument5 paginiDestilacion Fraccionada FinalLuisis321Încă nu există evaluări
- Ejercicios Resueltos de Quim 225 - Prueba 2Document3 paginiEjercicios Resueltos de Quim 225 - Prueba 2Rocío CanalesÎncă nu există evaluări
- Ingenieria 6Document44 paginiIngenieria 6pedroÎncă nu există evaluări
- Quiz #4-Virtual-SRDocument2 paginiQuiz #4-Virtual-SRSantiago ValenciaÎncă nu există evaluări
- Ley Beer Cromo 410nmDocument6 paginiLey Beer Cromo 410nmPau Toro100% (1)
- Cuestrionario InformeDocument2 paginiCuestrionario InformeMónica LópezÎncă nu există evaluări
- Practica 8 Acido Visual y PotenciometriaDocument33 paginiPractica 8 Acido Visual y PotenciometriaWENDY GUAMAN MENDOZAÎncă nu există evaluări
- Repaso ParcialDocument41 paginiRepaso ParcialGeena Lopez PeredaÎncă nu există evaluări
- Uv Vis InformeDocument6 paginiUv Vis InformeJavier QuirogaÎncă nu există evaluări
- Métodos clásicos de cuantificación: dureza de agua y humedad de sueloDocument11 paginiMétodos clásicos de cuantificación: dureza de agua y humedad de sueloPaula Rincon TorresÎncă nu există evaluări
- 2 Titulacion ConductimetricaDocument5 pagini2 Titulacion ConductimetricaOz HdzÎncă nu există evaluări
- Determinación de cobre en roca por espectrofotometríaDocument5 paginiDeterminación de cobre en roca por espectrofotometríaDavid Vp KydÎncă nu există evaluări
- 4-5 Segundo DeberDocument2 pagini4-5 Segundo DeberAlexÎncă nu există evaluări
- Determinación de Cloruros Por El Método de FajansDocument5 paginiDeterminación de Cloruros Por El Método de FajansMontserrat CansinoÎncă nu există evaluări
- TALLER DE TITULACIONES ÁCIDO-BASE CON CÁLCULO DE CONCENTRACIONESDocument3 paginiTALLER DE TITULACIONES ÁCIDO-BASE CON CÁLCULO DE CONCENTRACIONESJaider FlórezÎncă nu există evaluări
- Informe Ebulloscopia y Crioscopia Grupo1Document12 paginiInforme Ebulloscopia y Crioscopia Grupo1Cristian Stalin100% (1)
- Examen Unidad UV-Vis - RANNDocument4 paginiExamen Unidad UV-Vis - RANNLuis Alberto Alfonzo GómezÎncă nu există evaluări
- Reporte de Curvas de Calibracion Cobre y NiquelDocument9 paginiReporte de Curvas de Calibracion Cobre y NiquelOliver JinZo MonzalvoÎncă nu există evaluări
- Practica 6 QidDocument7 paginiPractica 6 QidAntonio DAÎncă nu există evaluări
- CalibradosDocument4 paginiCalibradospepeÎncă nu există evaluări
- Ejercicios (Maylee Ramos)Document17 paginiEjercicios (Maylee Ramos)Arthur GalianoÎncă nu există evaluări
- Análisis químico estadísticoDocument7 paginiAnálisis químico estadísticoHoriana TrujilloÎncă nu există evaluări
- Determinación de iones metálicos por espectroscopía de absorción atómicaDocument3 paginiDeterminación de iones metálicos por espectroscopía de absorción atómicaJhordan NietoÎncă nu există evaluări
- Boletin 4Document3 paginiBoletin 4Ruben FernandezÎncă nu există evaluări
- Boletin 3Document2 paginiBoletin 3Ruben FernandezÎncă nu există evaluări
- Boletin 2Document2 paginiBoletin 2Ruben FernandezÎncă nu există evaluări
- Tema 4Document19 paginiTema 4Ruben FernandezÎncă nu există evaluări
- IntroducciónDocument3 paginiIntroducciónRuben FernandezÎncă nu există evaluări
- Tema 2 PDFDocument16 paginiTema 2 PDFRuben FernandezÎncă nu există evaluări
- Tema 1 PDFDocument23 paginiTema 1 PDFRuben FernandezÎncă nu există evaluări
- Tema 3 PDFDocument28 paginiTema 3 PDFRuben FernandezÎncă nu există evaluări
- Seminario Metabolismo FacultadDocument4 paginiSeminario Metabolismo FacultadRuben FernandezÎncă nu există evaluări
- 1 Introduccion 2013Document22 pagini1 Introduccion 2013Ruben FernandezÎncă nu există evaluări
- Tablas Diagnostico DiferencialDocument28 paginiTablas Diagnostico DiferencialRuben FernandezÎncă nu există evaluări
- Candelaria encuentro MaestroDocument29 paginiCandelaria encuentro MaestroTomas Israel RodriguezÎncă nu există evaluări
- Reología del concreto frescoDocument23 paginiReología del concreto frescoJeffrey Sanchez RojasÎncă nu există evaluări
- Mapa Mental Direccion y Control PDFDocument1 paginăMapa Mental Direccion y Control PDFJair Enrique GONGORA RAMIREZÎncă nu există evaluări
- Modelos de Probabilidad-P2Document14 paginiModelos de Probabilidad-P2VALERIA ANABEL ALARCON GUERREROÎncă nu există evaluări
- Tractores Agricola-Manual Tecnico de ManejoDocument94 paginiTractores Agricola-Manual Tecnico de ManejoRussel Santos ArcayoÎncă nu există evaluări
- Analisis Lectura Capital SocialDocument3 paginiAnalisis Lectura Capital SocialEsteban UsecheÎncă nu există evaluări
- Revista IAPEM No 76 La Gestion Publica UDocument46 paginiRevista IAPEM No 76 La Gestion Publica UAnibal LoguzzoÎncă nu există evaluări
- Informe afectaciones vías Nimaima temporada lluvias 2022Document35 paginiInforme afectaciones vías Nimaima temporada lluvias 2022Pablo VelandiaÎncă nu există evaluări
- Cotizacion Yesera 2023Document2 paginiCotizacion Yesera 2023Briano GuadalupeÎncă nu există evaluări
- Iii Situación SignificativaDocument3 paginiIii Situación SignificativaEli GomezÎncă nu există evaluări
- ERKS: MUNDO INTERNODocument63 paginiERKS: MUNDO INTERNOFlorencia SprovieriÎncă nu există evaluări
- Informe de Conocimiento y CienciaDocument10 paginiInforme de Conocimiento y Ciencialuis angel llanos acuñaÎncă nu există evaluări
- Diagnostico y Tratamient SOAHS - En.esDocument14 paginiDiagnostico y Tratamient SOAHS - En.esBryan PerezÎncă nu există evaluări
- 1.1. Taller NTC 4114 - GTC 45Document6 pagini1.1. Taller NTC 4114 - GTC 45Pitter Alexis CamayoÎncă nu există evaluări
- Apuntes RRDocument67 paginiApuntes RRLÓPEZ NICOLÁS JOSÉ ÁNGELÎncă nu există evaluări
- 27.inst de Eval Generar Habitos.Document2 pagini27.inst de Eval Generar Habitos.Fernanda CarvajalÎncă nu există evaluări
- Noveno Semestre Contabilidad Ficha 3Document6 paginiNoveno Semestre Contabilidad Ficha 3Anthony DuranÎncă nu există evaluări
- Plan Anual - Sala de 5 AñosDocument1 paginăPlan Anual - Sala de 5 AñosAnalía Verónica Luna100% (1)
- Investigación AFLORADocument65 paginiInvestigación AFLORAAngela Jimenez100% (1)
- Túnel ProvideRS - Portafolio de Materiales Obra Civil y MineríaDocument48 paginiTúnel ProvideRS - Portafolio de Materiales Obra Civil y MineríaLiliana PrietoÎncă nu există evaluări
- Plan de Gobierno de Ciriaco Isidro Diaz AresteguiDocument31 paginiPlan de Gobierno de Ciriaco Isidro Diaz AresteguiArturo Jhony LlanosÎncă nu există evaluări
- Diapositivas Costes Del Proyecto PDFDocument7 paginiDiapositivas Costes Del Proyecto PDFmartha coral0% (1)
- Origenes de La Gestion EducativaDocument1 paginăOrigenes de La Gestion EducativaquiacainapoloniaelizabethÎncă nu există evaluări
- Instrumentos de DiagnosticoDocument13 paginiInstrumentos de DiagnosticoGonzalo NavaÎncă nu există evaluări
- VUCADocument5 paginiVUCARosita AlvaradoÎncă nu există evaluări
- 1º Bach OrganizaciónDocument11 pagini1º Bach OrganizaciónJosé García AlfaroÎncă nu există evaluări
- CARTA DE VISITA #013-2022-SF-FIA - Raúl Mallcco Solis - GCDocument1 paginăCARTA DE VISITA #013-2022-SF-FIA - Raúl Mallcco Solis - GCHayduk HaydukÎncă nu există evaluări
- Revista Digital Biologia Leyes de MendelDocument28 paginiRevista Digital Biologia Leyes de Mendelsol depablosÎncă nu există evaluări
- Taller de MatemáticaDocument2 paginiTaller de MatemáticaNicole ZumbaÎncă nu există evaluări
- Guía de Crianza Desde El Amor y El Buen TratoDocument54 paginiGuía de Crianza Desde El Amor y El Buen TratoClaudia HernandezÎncă nu există evaluări