Documente Academic
Documente Profesional
Documente Cultură
Previo 1 Final
Încărcat de
Lucas Piero Escudero RamírezTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Previo 1 Final
Încărcat de
Lucas Piero Escudero RamírezDrepturi de autor:
Formate disponibile
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
FACULTAD DE QUÍMICA
1308 EQUILIBRIO Y CINÉTICA (LABORATORIO)
DEPARTAMENTO DE FISICOQUÍMICA
TAREA PREVIA 1
Nombre del alumno: Escudero Ramírez Lucas Piero
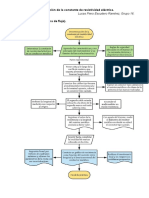
1.- ¿Qué es una reacción de óxido-reducción?
Las reacciones de óxido-reducción, o reacciones redox, son aquellas donde existe una
transferencia de electrones o cambios en los números de oxidación de las especies presentes. El
término reacción de oxidación se refiere a la semirreacción que implica la pérdida de electrones.
Una reacción de reducción es una semirreacción que implica una ganancia de electrones.
Como ejemplo, en la formación del óxido de magnesio, el magnesio se oxida. Se dice que actúa
como agente reductor porque dona electrones al oxígeno y hace que se reduzca. El oxígeno se
reduce y actúa como un agente oxidante porque acepta electrones del magnesio y hace que este
se oxide (Chang, 2016, p.134).
Existen cuatro tipos de estas reacciones: descomposición, combinación, desplazamiento,
combustión y dismutación. En la reacción de desplazamiento, un ion (o átomo) de un
compuesto se sustituye por un ion (o átomo) de otro elemento. Un ejemplo de una reacción de
desplazamiento de un metal es: Zn ( s ) +CuS O 4 ( ac ) →Cu ( s )+ ZnS O 4 (ac), donde los
electrones se transfieren directamente del agente reductor (Zn) al agente oxidante (Cu 2+). Si
estos se separan físicamente, la transferencia puede llevarse a cabo por medio de un conductor
externo.
2.- ¿Qué es una pila? ¿Cuál es el principio de su funcionamiento y cuáles son las
principales aplicaciones de la pila de óxido de plata-zinc?
Una pila, o celda electroquímica, es un dispositivo que transforma la energía química de una
reacción redox, en energía eléctrica. Está constituida por un ánodo (electrodo positivo), un
cátodo (electrodo negativo) y electrolito, una sustancia que puede conducir la electricidad. Las
pilas pueden clasificarse por el tipo de electrolito (húmedas y secas) y por su duración y tipo de
manejo requerido (primarias y secundarias).
El funcionamiento de una pila consiste en la oxidación de una especie química en el ánodo y la
reducción de otra en el cátodo, mediante la transferencia de electrones a través de un alambre
conductor. En otras palabras, se basa en un flujo de electrones que van del ánodo al cátodo a
través del electrolito.
La celda electroquímica de óxido plata-zinc produce casi 1.6 V durante periodos de tiempo
largos, además de su tamaño reducido de fabricación. Demuestran una gran confiabilidad, es
por eso que, se utilizan como fuentes de energía en calculadoras, relojes, instrumentos de
precisión, cámaras y en implantes médicos (marcapasos y aparatos auditivos).
3.- ¿Cuál es la reacción de óxido-reducción que se lleva a cabo en una pila de óxido de
plata-zinc?
La reacción redox que se lleva a cabo al interior de la pila es:
A g2 O ( s ) + Zn ( s ) → 2 Ag ( s )+ ZnO (s)
4.- ¿Qué es el potencial eléctrico?
El potencial eléctrico es la energía potencial por unidad de carga. El potencial eléctrico V se
define, en cualquier punto del campo eléctrico, como la energía potencial E p por unidad de carga
asociada con una carga de prueba q0 en ese punto.
Ep ∆Ep
V= , o bien, V B −V A =∆ V =
q0 q
La unidad de potencial eléctrico en el SI se llama volt (1 V), en honor del científico italiano y
experimentador en el campo de la electricidad Alejandro Volta (1745-1827), y es igual a 1 joule
por coulomb (Young & Freedman, 2013, p. 761).
5.- ¿Qué es el trabajo eléctrico?
El trabajo eléctrico es el trabajo que desarrolla una fuerza eléctrica sobre una carga que se
desplaza desde un punto A hasta un punto B, provocando una disminución de su energía
potencial.
d E p=−δ W elec , o bien, W elec =−qE
En una reacción redox, el trabajo electroquímico es la energía que desarrollan los electrones que
se transfieren cuando son intercambiados entre dos especies químicas. La cantidad de carga por
mol de reacción está dada por:
q=nF , entonces, W elec =−nFE
La cantidad de trabajo eléctrico que realiza una celda electroquímica es el producto del
potencial eléctrico por la carga. El signo negativo se refiere que el trabajo lo desarrolla la celda
sobre los alrededores.
6.- Escribir la ecuación que relaciona al trabajo eléctrico con el potencial eléctrico para
una reacción de óxido-reducción.
7.- Explicar la interpretación física de ∆G° cuando un proceso se lleva a cabo a presión y
temperatura constante.
8.- Investigar la interpretación física de ∆H° y ∆S° cuando un proceso se lleva a cabo a
presión constante.
9.- ¿Cuál es la ecuación que relaciona ∆G° con ∆H° y ∆S° a temperatura constante?
10.- Explicar el criterio de espontaneidad y equilibrio asociado con ∆G° a presión y
temperatura constante.
11.- Mencionar cuáles son los factores que afectan el signo de ∆G° en la ecuación que
relaciona a ∆G° con ∆H° y ∆S° a presión y temperatura constante.
3 hrs. No será completa.
Discutir teoría. (1 o ½ teoría)
“Hacer la práctica”.
Resultados. (él nos los compartirá)
Tareas previas en pdf.
2 exámenes parciales.
S-ar putea să vă placă și
- Actividad 1 2021-1 07-10Document2 paginiActividad 1 2021-1 07-10Lucas Piero Escudero RamírezÎncă nu există evaluări
- User Manual - Lab-Line - For Serial Numbers Starting With 1464, 1465, 1466 - LT1465X3 - 302 - 310M - Imperial III Incubator.eDocument28 paginiUser Manual - Lab-Line - For Serial Numbers Starting With 1464, 1465, 1466 - LT1465X3 - 302 - 310M - Imperial III Incubator.eErickson Fabian Castillo100% (2)
- Boletín UNAM-DGCS-157Document3 paginiBoletín UNAM-DGCS-157Lucas Piero Escudero RamírezÎncă nu există evaluări
- Termo Abel DefinicionesDocument7 paginiTermo Abel DefinicionesLucas Escudero RamírezÎncă nu există evaluări
- Boletín UNAM-DGCS-528Document7 paginiBoletín UNAM-DGCS-528Lucas Piero Escudero RamírezÎncă nu există evaluări
- Forma de EvaluaciónDocument1 paginăForma de EvaluaciónLucas Piero Escudero RamírezÎncă nu există evaluări
- Trabajo (Tarea)Document1 paginăTrabajo (Tarea)Lucas Piero Escudero RamírezÎncă nu există evaluări
- Serie 1 EstequiometríaDocument5 paginiSerie 1 EstequiometríaLucas Piero Escudero RamírezÎncă nu există evaluări
- DiscriminaciónDocument19 paginiDiscriminaciónLucas Piero Escudero RamírezÎncă nu există evaluări
- BienvenidaDocument1 paginăBienvenidaLucas Piero Escudero RamírezÎncă nu există evaluări
- Tarea 2 NvoDocument5 paginiTarea 2 NvoLucas Piero Escudero RamírezÎncă nu există evaluări
- Biftalato de Potasio HSDocument1 paginăBiftalato de Potasio HSLucas Escudero RamírezÎncă nu există evaluări
- Tema 5Document6 paginiTema 5flower powerÎncă nu există evaluări
- Química General II Serie 2 EstequiometríaDocument2 paginiQuímica General II Serie 2 EstequiometríaDanahy PraviaÎncă nu există evaluări
- EM - 2020-2 - Segundo EXAMEN PARCIAL.Document3 paginiEM - 2020-2 - Segundo EXAMEN PARCIAL.Lucas Piero Escudero RamírezÎncă nu există evaluări
- Tarea 2 NvoDocument5 paginiTarea 2 NvoLucas Piero Escudero RamírezÎncă nu există evaluări
- Diagrama Carreto2Document1 paginăDiagrama Carreto2Lucas Piero Escudero RamírezÎncă nu există evaluări
- Diagrama Carreto3Document1 paginăDiagrama Carreto3Lucas Piero Escudero RamírezÎncă nu există evaluări
- Resistividad CarretoDocument3 paginiResistividad CarretoLucas Piero Escudero RamírezÎncă nu există evaluări
- AnalisisDocument3 paginiAnalisisLucas Piero Escudero RamírezÎncă nu există evaluări
- T7Document1 paginăT7Lucas Piero Escudero RamírezÎncă nu există evaluări
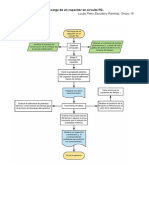
- P8 Carga y Descarga de Un CapacitorDocument4 paginiP8 Carga y Descarga de Un CapacitorLucas Piero Escudero RamírezÎncă nu există evaluări
- Diagrama Carreto4Document1 paginăDiagrama Carreto4Lucas Piero Escudero RamírezÎncă nu există evaluări
- Diagrama Carreto7Document1 paginăDiagrama Carreto7Lucas Piero Escudero RamírezÎncă nu există evaluări
- Actividad 1 2021-1Document2 paginiActividad 1 2021-1Lucas Piero Escudero RamírezÎncă nu există evaluări
- AnalisisDocument3 paginiAnalisisLucas Piero Escudero RamírezÎncă nu există evaluări
- Diagrama Carreto8Document1 paginăDiagrama Carreto8Lucas Piero Escudero RamírezÎncă nu există evaluări
- Proyecto Sulfurico - 2021 - 2Document6 paginiProyecto Sulfurico - 2021 - 2Lucas Piero Escudero RamírezÎncă nu există evaluări
- Proyecto Sulfurico - 2021 - 2Document6 paginiProyecto Sulfurico - 2021 - 2Lucas Piero Escudero RamírezÎncă nu există evaluări
- AAAAXDDocument5 paginiAAAAXDLucas Piero Escudero RamírezÎncă nu există evaluări
- QI1 PreguntasPreExamenDocument2 paginiQI1 PreguntasPreExamenLucas Piero Escudero RamírezÎncă nu există evaluări
- Informe de La Práctica Nº2Document5 paginiInforme de La Práctica Nº2Elias Choque MamaniÎncă nu există evaluări
- Soluciones OXOSALESDocument2 paginiSoluciones OXOSALESJavier IglesiasÎncă nu există evaluări
- Eteres PDFDocument50 paginiEteres PDFRaysa Mitma QuezadaÎncă nu există evaluări
- SolerDocument24 paginiSolerGiles GilesÎncă nu există evaluări
- Clasificacion de Los Pozos Petrolero. Tipos de Perforaciones.Document9 paginiClasificacion de Los Pozos Petrolero. Tipos de Perforaciones.Wilmer MárquezÎncă nu există evaluări
- Esquema Del ProcedimientoDocument12 paginiEsquema Del ProcedimientowfwsfgwfÎncă nu există evaluări
- Informe AcademicoDocument5 paginiInforme AcademicoANGIE DESSIRÉ MAYANGA PINEDOÎncă nu există evaluări
- GIMTT U1 FisicoquimicaDocument43 paginiGIMTT U1 FisicoquimicaManuel IbarraÎncă nu există evaluări
- Alquenos y AlquinosDocument20 paginiAlquenos y Alquinos0Încă nu există evaluări
- I EP. POLIMEROS ExamenDocument2 paginiI EP. POLIMEROS ExamenKatherine Elizabeth Alvarez MendozaÎncă nu există evaluări
- ASU038412023Document2 paginiASU038412023WiilmerRonaldoPinzonÎncă nu există evaluări
- Membrana PlasmaticaDocument57 paginiMembrana PlasmaticaDaniela Deemi Delacruz DelahozÎncă nu există evaluări
- Nanotubos de Carbono en La Terapia Fototermica ConDocument6 paginiNanotubos de Carbono en La Terapia Fototermica ConLuz Marina Rojas GonzalezÎncă nu există evaluări
- SO3.s2 Nomenclatura III OxácidosDocument27 paginiSO3.s2 Nomenclatura III OxácidosDKRYSTELÎncă nu există evaluări
- Presentación de Lanzamiento TRITEKDocument53 paginiPresentación de Lanzamiento TRITEKjchumpitazf100% (1)
- PENNCLORITO Tipo-A Cajica 2022-06 SPDocument1 paginăPENNCLORITO Tipo-A Cajica 2022-06 SPJesus Eduardo Canencia BayueloÎncă nu există evaluări
- JeopardyDocument5 paginiJeopardyNora NegreteÎncă nu există evaluări
- Exposicion Fundamentos de InvestigacionDocument10 paginiExposicion Fundamentos de InvestigacionThanks HowÎncă nu există evaluări
- Clase 3 - Práctica Calificada 1 - Tejeda HelenDocument4 paginiClase 3 - Práctica Calificada 1 - Tejeda HelenHelen TejedaÎncă nu există evaluări
- Catalizador EpoxicoDocument1 paginăCatalizador Epoxicomario Pilco SosaÎncă nu există evaluări
- A-Que Es Metodo Cientifico-Trabajo-Para-CuadernoDocument15 paginiA-Que Es Metodo Cientifico-Trabajo-Para-CuadernoRomeo GarciaÎncă nu există evaluări
- Informe PolimerosDocument24 paginiInforme PolimerosBrayan TonatoÎncă nu există evaluări
- Química - Semana 12-P1Document20 paginiQuímica - Semana 12-P1Angélica Quito CarriónÎncă nu există evaluări
- Manual AnaliticaDocument68 paginiManual AnaliticaRuiz Villalobos EmmanuelÎncă nu există evaluări
- GravimetríaDocument18 paginiGravimetríaPaula AbelloÎncă nu există evaluări
- TerceroDocument5 paginiTerceroYasmin Alcantara0% (1)
- Preguntas 1er ParcialDocument35 paginiPreguntas 1er ParcialSebastian SaavedraÎncă nu există evaluări
- 3 A. La Carne y Sus DerivadosDocument26 pagini3 A. La Carne y Sus DerivadosLisannys GarridoÎncă nu există evaluări
- QG123 - Configuración ElectrónicaDocument37 paginiQG123 - Configuración ElectrónicaJULIÁN HERNÁNDEZ COLORADOÎncă nu există evaluări