Documente Academic
Documente Profesional
Documente Cultură
Combustao tERMO II 2011
Încărcat de
Endric LopesDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Combustao tERMO II 2011
Încărcat de
Endric LopesDrepturi de autor:
Formate disponibile
Cap 14 - Reaes Qumicas
- Fundamentos da Combusto -
Prof Dr. Ednildo Andrade Torres
Universidade Federal da Bahia
Escola Politcnica
DEQ/LEN
Eng. 324 Termodinmica Aplicada II
1. Combusto
2 - CONCEITOS BSICOS
2. 1 Conceitos Termodinmicos
2.1.1 Calor e Temperatura
2.1.2 Calor Especfico
2.1.3 Calor Sensvel
i2.1.4 Calor Latente
2.1.5 Poder Calorfico 6
2.2 Mecanismos de Transferncia de calor
2.1.1 Conduo
2.1.2 Conveco
2.1.3 Radiao
2.3 Propriedades dos Combustveis
3 Classificao dos Combustveis
3. 1 - Classificao
3.2 Caractersticas dos Combustveis
Combusto
A Combusto consiste em uma reao qumica
entre um combustvel e o oxignio, geralmente
proveniente do ar atmosfrico, e que resulta na
produo dos gases de exausto e libera grande
quantidade de energia trmica. Para que ocorra a
combusto so necessrios trs componentes.
Combustvel
Comburente
Energia de ativao (Ignio)
Esses componentes podem ser representado pelo
tringulo da combusto
COMBURENTE
IGNIO
COMBUSTVEL
Combustveis
Os Combustveis industriais so orgnicos ou minerais em
que cuja composio tm elementos que ao se
combinarem como o oxignio produzem energia trmica.
Esses elementos qumicos que entram na composio
qumica dos combustveis so geralmente: carbono,
hidrognio, enxofre, nitrognio, oxignio, metais como
sdio, potssio, clcio, alumnio, ferro, vandio e umidade.
Porm, os principais elementos combustveis so o
carbono e o hidrognio, isto os hidrocarbonetos.
Classificao dos Combustveis
Define-se como combustvel a substncia, natural ou
artificial, susceptvel de, ao se combinar quimicamente
com outra, gerar uma reao exotrmica rpida,
desprendendo calor e luz. Inmeros elementos e
compostos qumicos possuem esta propriedade,
principalmente quando a reao feita entre eles e o
oxignio. Neste captulo sero estudados os diversos
tipos de combustveis, sua classificao e
caractersticas, ressaltando aqueles de principal uso na
indstria.
Classificao
Tipo
Exemplo
Slidos
Naturais
Madeira Lenha
Serragem
Cavacos
Turfa
Linhito
Antracito
Hulha
Artificiais
Carvo Vegetal
Coque de Carvo
Coque de Petrleo
Briquetes
Lquidos
Naturais
Petrleos
leos de Xisto
Artificiais
Derivados do Petrleo
Alcatro
lcool
Gasosos
Naturais
Gs Natural
Metano
Artificiais
Hidrognio
Butano e Propano
GLP
Gs de Iluminao
Gs de Coqueria
Gs de Nafta
Gs de Gasognio
Gs de Alto Forno
Coloidais (mistura de combustveis slidos e lquidos)
Resduos de Fabricao e de Extrao
Combustveis Slidos Naturais
Madeira
A lenha um dos combustveis mais antigos ainda
em uso e at hoje largamente utilizado em alguns
pases, inclusive no Brasil. composto
principalmente de celulose, resinas, gua e sais
minerais.
Sua principal utilizao ocorre na sua transformao
em carvo vegetal e na gerao de energia eltrica
principalmente nas indstrias de cermica , alimentos
e bebidas e papel e celulose.
A serragem e os cavacos so resduos das serrarias ou da extrao
de madeiras. Sua queima requer grelhas especiais (cascata). Um
outro combustvel proveniente da madeira o n de pinho,
possuindo um poder calorfico superior ao da lenha normal devido
ao seu alto teor de resinas. Carvo mineral
O carvo, segundo sua formao, pode ser classificado de quatro
maneiras distintas:
turfa, linhito, antracito e hulha.
A turfa uma substncia carbonosa proveniente da carbonizao de
plantas e pequenas espcies vegetais em zonas pantanosas.
Geralmente amorfa, tem baixo poder calorfico e grande
porcentagem de umidade.
O linhito um carvo mineral em formao e o seu aspecto ainda
o da madeira no processo de carbonizao, da o seu nome. Tem
melhor poder calorfico do que a turfa e o seu uso restrito.
Carvo Mineral
Turfa
O antracito um carvo seco, muito frivel e se
apresenta sob forma de moinha, porm tem bom
poder calorfico e seu uso industrial bem
disseminado. Antes do incremento do uso do leo
combustvel, o Brasil importou muito antracito para
uso principalmente em fornos de cermica e
grelhas automticas de caldeiras. usado
tambm em forma de briquetes.
A hulha o carvo mineral propriamente dito.
resultante da carbonizao e fossilizao de
imensas florestas que existiram h milnios,
durante a consolidao da crosta terrestre.
ainda muito usado em alguns pases corno
principal combustvel industrial, sendo utilizado na
fabricao do coque para fins siderrgicos
Coque de Carvo
O coque um combustvel slido obtido da destilao
seca do carvo mineral em retortas ou coquerias. Tem
largo emprego na indstria siderrgica, e de fundio.
No Brasil, a produo de coque limita-se s indstrias
siderrgicas, que o emprega em consumo prprio,
representando, em 1995, 96% do seu consumo total.
Coque de Petrleo
O coque de petrleo um produto resultante da
quebra de molculas de derivados de petrleo, sendo
mais utilizados os leos combustveis residuais. O seu
aspecto lembra o coque de carvo.
Carvo vegetal
O carvo vegetal ou carvo de
madeira obtido artificialmente pela
carbonizao de madeira em fornos
especiais. Seu maior uso industrial
ocorre nas siderrgicas, que
consomem cerca de 82% do
consumo total, e gasognios. Tem
ainda largo emprego no uso
domstico.
Combust
vel
C
H
O
N
S
Cinzas
Volteis
Umidade
Lenha
Seca
Turfa
Linhito
Antracito
Hulha
(imp.)
Hulha
(nac.)
Coque de
carvo
Carvo
vegetal
50,2
12,9
19,2
94,0
79,8
47,9
87,0
81,0
6,3
3,0
5,1
43,0
4,2
0,1
3,0
1,9
0,8
1,6
1,2
3,9
0,4
26,1
20,6
7,8
25,5
10,4
4,0
25,4
25,8
23,9
1,5
15,0
34,8
32,8
3,0
1,8
1,1
Composio percentual mdia de alguns combustveis
slidos
Combustveis Lquidos Naturais
Os combustveis lquidos naturais so constitudos pelo
petrleo e leos de xisto.
Petrleo
O petrleo, sobre cuja a origem h vrias teorias,
extrado de poos mais ou menos profundos. Do
petrleo derivam vrios combustveis e produtos
qumicos, no sendo usado em seu estado natural, As
principais jazidas de petrleo no Brasil, j
exploradas,localizam-se nos Estados da Bahia, Sergipe,
Alagoas, Rio Grande do Norte, Esprito Santo e Rio de
Janeiro
leo de Xisto
Combustveis Lquidos Artificiais
Gasolina
Naftas, Querosene, leo Diesel, lcool , leo
Combustvel
Viscosidade
SSF a 50C
Tipo A
Alto Teor de Enxofre
TipoB
Baixo Teor de
Enxofre
600
900
2.400
10.000
30.000
80.000
300.000
1.000.000
Acima de
1.000.000
1A
2A
3A
4A
5A
6A
7A
8A
9A
1B
2B
3B
4B
5B
6B
7B
8B
9B
Tipos de leo combustveis no Brasil
Caracterstica
1A
2A
7A
1B
2B
3B
Densidade(20C)
1,017
1,018
1,031
0,957
0,964
0,983
Ponto de Fulgor(C)
103
121
160
84
86
80
Enxofre (% em peso)
3,8
3,9
4,6
0,8
0,9
1,0
Cinzas (% em peso)
0,04
0,04
---
0,04
0,04
0,03
Poder Calorfico
Superior (kcal/kg)
10.328
10.130
10.02
5
10.530
10.500
10.443
Viscosidade
(SSF) a:
65C
178
278
37.60
0
180
263
82,2
C
73
102
6.110
81
140
100C
135C
30
15
40
---
10.41
0
168
37
---
---
20
105
29
Teor de
Metal (ppm)
Van
dio
172
142
167
34
37
44
Sdio
19
13
9,2
40
41
51
Nque
l
47
46
50
38
30
32
Caractersticas tpicas de alguns leos combustveis
Gs Liquefeito de Petrleo
O GLP formando por hidrocarbonetos que, dependendo de
sua origem e dos processos de tratamento a que foi submetido,
pode apresentar composio varivel. Estes hidrocarbonetos
so obtidos no inicio da destilao do petrleo, consistindo
basicamente de propano e butano. inodoro e mais pesado que
o ar. Seu armazenamento feito em tanques de alta presso
ou refrigerados. Seu uso est difundido como combustvel
domstico e nas indstrias como combustvel auxiliar. Para fins
de segurana os gases liquefeitos, para uso domstico, so
odorizados para identificar vazamentos.
Gs de Gasognio
O gs de gasognio produzido em aparemos especiais
(gasognios) pela combusto incompleta do coque ou carvo de
madeira, que gera o monxido de carbono. Tambm chamado
gs pobre, possui baixo poder calorfico
Gs de Coqueria
Este gs produzido nas baterias de retortas onde feita a destilao seca do
carvo mineral para a produo do coque siderrgico. A estas baterias d-se o
nome de coquerias. O gs de coqueria utilizado nas prprias usinas siderrgicas
para aquecimento das retortas ou outros fomos da usina
e) Gs de alto forno
O gs de alto forno produzido no interior dos altos-fomos siderrgicos por meio de
reaes entre o oxignio e a umidade do ar soprado, o coque, o minrio de ferro e
suas impurezas, o calcrio etc. Ele coletado no topo dos altos fomos, ciclonado,
lavado e armazenado em gasmetro, quando no diretamente utilizado. Devido ao
alto teor de dixido de carbono e nitrognio, o seu poder calorfico baixo. Pode ser
usado em motores dos aquecedores de ar dos prprios altos-fomos. O valor do gs
de alto-fomo avaliado pela sua relao CO/CO2.
3.2.7 Combustveis Coloidais
So misturas de combustveis lquidos com combustveis slidos. O mais
empregado a mistura de leo combustvel residual com finos de carvo de pedra,
coque ou carvo vegetal. A maior dificuldade do uso de combustveis deste tipo o
seu manuseio, devendo estar sempre em agitao, os encanamentos devem ter
quatro vezes o dimetro do que seria usado para o combustvel lquido e o seu
bombeamento requer bombas especiais de diafragma. Seu uso est mais
condicionado ao aproveitamento de finos de carvo ou coque.
Energticos Massa
Poder Calorfico
Poder Calorfico
Superior (BEN) kcal/kg
Petrleo
867
10900
Carvo vapor
-
4460
Carvo Metalrgico)
-
7700
Lenha
390
3300
390
3300
Cana-de-acar
-
1030
leo Diesel
851
10750
leo Combustvel
999
10900
Gasolina
738
11230
GLP
552
11750
Nafta
704
11320
Querosene
787
11090
Gs Canalizado
-
4700(3)
Gs Coqueria
4500 (3)
Coque Carvo Mineral
-
7300
Lixvia
2100
3030
Carvo Vegetal
250
6800
lcool Anidro
791
7090
lcool Hidratado
809
6650
Bagao de Cana (2)
-
2257
Gs de Refinaria
780
8800
Gs Natural
-
9400 (3)
-Poder calorfico
- massa
especfica
de alguns
combustveis
Viscosidade
kg/m
3
Combustveis
Os Combustveis industriais so orgnicos ou minerais em
que cuja composio tm elementos que ao se
combinarem como o oxignio produzem energia trmica.
Esses elementos qumicos que entram na composio
qumica dos combustveis so geralmente: carbono,
hidrognio, enxofre, nitrognio, oxignio, metais como
sdio, potssio, clcio, alumnio, ferro, vandio e umidade.
Porm, os principais elementos combustveis so o
carbono e o hidrognio, isto os hidrocarbonetos.
O enxofre tambm um combustvel, que gera significativa
quantidade de calor mas, ao reagir com o oxignio produz SO
2
, e
que pode reagir com gua presente nos gases e formar cido
sulfrico, H
2
SO
4
.
Desses elementos os mais importantes so carbono e hidrognio,
o enxofre embora libere calor durante a queima, considerado
um elemento indesejvel no combustvel, devido formao de
xido de enxofre, cidos sulforoso e sulfrico, que alm de
provocarem corroso nos equipamentos so fortes poluentes.
Os outros elementos, alm de no liberarem calor, provocam
problemas de poluio (nitrognio e metais), reduo do poder
calorfico (nitrognio, cinzas e umidade) e problemas de corroso
para os equipamentos (cinzas); podem diminuir a eficincia da
queima (a umidade, nitrognio e cinzas).
Os combustveis podem ser classificados de diversas maneiras,
porm, so apresentados de acordo com base em sua natureza
fsica.
1.1. Comburente
Universalmente o comburente utilizado o oxignio presente no
ar atmosfrico sendo a fonte natural desse gs. O ar atmosfrico
constitudo por muitos gases mas podemos simplificar,
principalmente, em dois gases o oxignio e o nitrognio. A
composio simplifica do ar pode expressa em base volumtrica
e em base mssica.
Elementos
% Vol.
% Massa
Relao N
2
/O
2
em Volume
Relao
N
2
/O
2
em
Massa
Nitrognio
79
77
3,76
3,35
Oxignio
21
23
-
-
Energia de Ignio
Para que existam as reaes qumicas de combusto
(exotrmicas) elas necessitam de uma energia de
ativao. Essa energia fornecida pela fonte de ignio.
Devem ser satisfeitas determinadas condies para que
ocorra a ignio:
A temperatura deve ser tal que ocorra vaporizao
A proporo de mistura ar/gs no deve estar dentro
da faixa de inflamabilidade;
Combusto
1 Oxidao C + O
2
CO
2
+Ah
2- Hidrogaseificao C + 2H
2
CH
4
+Ah
3 - Gaseificao C + H
2
O CO + H
2
+Ah
4 Metanizao 2H
2
+ CO CH
4
+ H
2
O + Ah
5 - 2H
2
+ O
2
H
2
O + Ah
6 - 2CO + O
2
CO
2
+ Ah
7 S + O
2
SO
2
+ Ah
8 CH
4
+ 2O
2
CO
2
+ 2H
2
O + Ah
Combusto Elementar com Oxignio
CH
4
+ 2O
2
CO
2
+ 2H
2
O
Utilizando o Ar 21% e 79% portanto 3,76 em Base volumtrica
Massa Molecular do Ar 0,21x32+0,79x28=28,97kg/kmol
Para cada 1mol de O
2
3,76 moles deN
2
Na base mssica 23% O
2
77% N
2
3,34
Equaes Bsicas
) / ( 393522 ( ) 44 ( ) 32 ( ) 12 (
2 2
kmol kJ g CO g O g C + +
) / )( 241826 ( ) 18 (
2
1
) 16 (
2
1
) 2 (
2 2
kmol kJ g O H g O g H + +
) / )( 285830 ( ) 18 (
2
1
) 16 (
2
1
) 2 (
2 2
kmol kJ L g O H g O g H + +
) / ( 296842 ( ) 64 ( ) 32 ( ) 32 (
2 2
kmol kJ g SO g O g S + +
) / ( 110522 ( ) 28 ( ) 16 (
2
1
) 12 (
2
kmol kJ g CO g O g C + +
2 2
2 2 2
2
2 2
2 2
2 2
2 2
2 2
SO O S
O H O H
CO O C
CO O CO
CO CO
+
+
+
+
2 2 2 2 2 4
52 , 7 2 ) 76 , 3 0 ( 2 N O H CO N CH + + + +
2 2 2 2 2
)
2 4
( 76 , 3 )
2
( ) 76 , 3 ( N
z y
x O H
y
xCO N O A O H C
z y x
+ + + + +
1 kg de Combustvel Gera
3,667 kgCO
2
ou so necessrios 2,667kg de O
2
ou 1,866Nm
3
O
2
12kgC + 32kgO
2
= 44kgCO
2
+ calor
C+2,667.O
2
= 3,667CO
2
+ 8140 kcal/kg
Equaes Bsicas
CONCEITOS BSICOS
Conceitos Termodinmicos
Calor e Temperatura
Calor Especfico
Calor Sensvel
Calor Latente
Poder Calorfico
O poder calorfico representa a quantidade de calor
liberada na combusto de um quilo de um
determinado combustvel, sendo expresso em kJ/kg
ou kcal/kg ou kJ/Nm
3
ou kcal/Nm
3
. Pode ser
classificado em superior ou inferior.
T
T
Q
B C
CS
CL
No clculo do poder calorfico superior inclui-se o calor
latente de vaporizao da gua, tanto a presente no
combustvel como a formada no processo de combusto,
ou seja, considera-se que a gua presente nos produtos
da combusto esteja no estado lquido. uma medida do
calor mximo que se pode obter na combusto de um
determinado combustvel.
O poder calorfico inferior calculado desconsiderando-se
o calor utilizado na vaporizao da gua, ou seja,
considera-se que a gua deixe o processo na forma de
vapor. Como a temperatura de sada dos gases gerados
no processo da combusto geralmente superior
temperatura de vaporizao da gua, esta medida
representa de maneira mais realista o calor disponvel
aps a combusto.
) sec . / (
) / (
) / ( sup
) / ( inf
) 9 ( 2440
2
o kgcomb O kgH l Combustve do umidade de teor u
kg kg l Combustve do hidrgnio de teor H
kg kJ erior Calorfico Poder PCs
kg kJ erior Calorfico Poder PCi
u H PCs PCi
=
=
=
=
+ =
O poder calorfico pode ser determinado em laboratrio
atravs de um calormetro com temperatura controlada. Neste
aparelho, uma determinada quantidade de combustvel
queimada em um recipiente envolto por uma quantidade
conhecida de gua. Medindo-se a variao da temperatura da
gua determina-se o calor absorvida por ela, ou seja,
determina-se o calor liberado pelo combustvel. A razo entre
calor liberado e massa indica o poder calorfico do
combustvel.
Mecanismos de Transferncia de calor
Sero descritas a seguir as principais formas
pelas quais o calor pode ser transferido:
conduo, conveco e radiao.
Na figura so mostradas as principais reas de
interesse na combusto foi construda utilizando
a velocidade e a espessura caracterstica do
volume de controle. Em cada uma das reas a
equaes da conservao massa, da energia, do
momentum, de estado e de gerao de entropia,
so aplicadas, embora, porr causa da escala, as
equaes tenham aparncias diferentes
O tempo caracterstico (L/V) mostrado como linhas
tracejadas pode ser comparado com o tempo de uma
reao qumica. Seja o tempo desta reao, por exemplo,
da ordem de 1/1000 segundo, como no caso de um
incndio. A equao de conservao da massa no ter o
termo de velocidade de reao.
Mas certamente na anlise de um combustor turbo-jato tais
termos tm que aparecer. No caso de uma exploso, o
tempo to curto que a reao nem precisa serr
considerada na anlise.
H limites assim para a equao da energia tambm. O
calor conduzido ao longo do eixo do escoamento.
Conduo
A conduo ocorre pela transferncia de energia
causada por colises entre molculas vizinhas de um
corpo. Quando uma barra de ferro aquecida em uma
ponta, as molculas neste local recebem uma
quantidade de calor que aumenta sua energia cintica,
aumentando sua temperatura. Estas molculas, ao
colidirem com as molculas a seu lado, transferem
parte de sua energia cintica, ou seja, transferem calor.
Deste modo, o calor propaga-se atravs da barra at
que as temperaturas nas duas extremidades sejam
iguais
espessura L
as temperatur T
rea A
material do trmica ade condutivid k
L
T T
A k Q
condd
=
=
=
=
=
)
.( .
1 2
Conveco
A conveco o processo de transferncia de calor que ocorre em
fluidos de maneira geral. O princpio da conveco pode ser
observado no exemplo a seguir. Quando um recipiente contendo
gua no estado lquido aquecido por baixo por uma fonte de
calor, a gua que est na parte inferior recebe calor pela conduo
atravs da parede deste recipiente. Como os lquidos, de maneira
geral, so maus condutores de calor, apenas uma pequena parcela
de gua aquecida. Como o lquido da parte inferior recebe a
grande parte do calor, ele expande-se, tornando-se menos denso.
Desta maneira, esta parcela do lquido desloca-se para a
superfcie, causando o movimento da gua ainda fria para o fundo.
Este ciclo repete-se e, se a fonte de calor mantiver-se
as temperatur T
rea A
global trmica ade condutivid e coeficient ug
T T A ug Q
convec
=
=
=
= ) .( .
1 2
Radiao
Radiao o processo pelo qual o calor transferido
atravs de ondas eletromagnticas. O exemplo mais
comum a transferncia de calor entre o sol e a terra.
Como no espao no existe um meio material para
transportar a energia do sol terra, esta chega atravs
de ondas, movendo-se velocidade da luz. Uma
caracterstica interessante deste modo de transmisso
que os gases que envolvem a terra no so
aquecidos.
espessura L
as temperatur T
rea A
te cons
T T A Q
radiac
=
=
=
=
=
tan
) .( .
4
1
4
2
o
o
Propriedades dos Combustveis
As propriedades dos combustveis so de extrema importncia para
determinar sua correta utilizao.
Viscosidade
A viscosidade de um lquido a medida da resistncia que este lquido
oferece ao escoamento, sendo varivel em funo da temperatura em
que obtida. A medida que a temperatura cresce, a viscosidade
diminui, tornando-se mais fcil o escoamento do lquido.
Uma das medidas mais utilizadas para a caracterizao da viscosidade
a Saybolt Universal. Esta unidade indica o tempo, em segundos, que
60 ml de um lquido levam para escoar atravs de um orifcio padro a
uma determinada temperatura, mantida constante durante o ensaio. Se
o orifcio for do tipo universal a viscosidade chamada Segundos
Saybolt Universal, e se o orifcio for do tipo Furol, a viscosidade
chamada Segundos Saybolt Furol. O orifcio Furol dez vezes maior
que o Universal. As temperaturas mais utilizadas nestes ensaios so
37,8 C, 50 C a 98,9 C.
Ponto de fulgor
O ponto de fulgor indica a temperatura na qual o
combustvel, quando aquecido, emite vapores
suficientes para se iniciar o processo de combusto
quando na presena de uma chama. Desta maneira,
o ponto de fulgor indica a temperatura mxima em
que o combustvel pode ser manuseado sem haver o
perigo de iniciar-se a combusto.
Ponto de fluidez
O ponto de fluidez uma indicao da menor
temperatura que um leo pode suportar sem perder
a capacidade de escoar atravs dos diversos
equipamentos, como vlvulas e tubulaes.
Calormetro
Ponto de nvoa
Em um leo, o ponto de nvoa indica qual a temperatura,
expressa em nmeros inteiros, na qual se inicia a cristalizao
ou separao de suas parafinas. Este fato pode ser observado
pelo aparecimento de uma nvoa ou turvao no fundo de um
tubo de ensaio, quando a amostra resfriada sob
determinadas condies.
A cristalizao das parafinas podem bloquear filtros,
tubulaes e outros equipamentos, restringindo o escoamento
do combustvel. A temperatura na qual ocorre esta
precipitao depende da origem, tipo, e faixa de destilao do
leo. Quanto mais parafinico o leo, mais alto o ponto de
nvoa e menos adequado o combustvel para operar em
baixas temperaturas.
Granulometria
A granulometria refere-se s dimenses mdias de cada
partcula que compem um combustvel slido. Por exemplo,
o carvo ao sair da mina apresenta-se em diversos tamanhos,
com dimenses que alcanam em torno de 200x300x900 mm.
Para ser comercializado, suas dimenses so reduzidas para
tamanhos que variam entre 60 e 80 mm ou 80 e 1 10 mm.
Umidade
Indica qual a porcentagem de gua contida nos combustveis.
uma das principais caractersticas de um carvo. Cada
mina apresenta uma umidade quase constante, sendo seu
valor varivel em funo da procedncia.
Friabilidade
Caracterstica que um carvo possui de se partir com
facilidade em pedaos menores.
FIM
desta Etapa
4 - COMBUSTO
A combusto atualmente o processo mais
empregado na indstria para fornecimento de
calor, diante desta importncia sero
apresentados, neste captulo, os principais
conceitos relacionados combusto, assim como
alguns dados sobre os principais conceitos
utilizados neste processo.
Reao de Combusto
A combusto um processo qumico exotrmico composto de dois
elementos distintos, o combustvel e o comburente. Vrias reaes
so caracterizadas como combusto, como por exemplo: a
combinao de carbono e outros elementos com oxignio, a
combinao do cloro com hidrognio, a do fsforo com iodo.
Entretanto, a reao mais largamente utilizada na indstria a que
utiliza o oxignio como elemento comburente. Os combustveis so
compostos basicamente de carbono e hidrognio, contendo ainda
pequenas porcentagens de enxofre e outros elementos. O
comburente mais utilizado o ar atmosfrico, pelo fato de ser a
fonte mais abundante e barata de oxignio, sendo ainda utilizados
o ar atmosfrico enriquecido ou mesmo o oxignio puro. Na
maioria das vezes o ar utilizado sem nenhum tratamento
especfico, sendo composto principalmente de nitrognio e
oxignio, contendo parcelas de dixido de carbono, vapor d'gua e
gases raros. Em certas regies pode ainda conter parcelas de
xidos de enxofre e nitrognio, oznio e mesmo partculas slidas.
A composio mdia do ar seco dada abaixo.
Aspectos Qumicos
A combusto pode ser classificada de duas maneiras:
completa ou incompleta, dependendo de como se d a
reao entre o carbono do combustvel e o oxignio. Na
combusto completa ocorre a reao total do carbono do
com o oxignio, gerando como produtos deste processo
dixido de carbono, vapor d'gua, xidos de enxofre e de
nitrognio. Na incompleta, parte do carbono, no reage
ou reage parcialmente com o oxignio, produzindo, alm
dos compostos anteriores, monxido de carbono e,
algumas vezes, fuligem, se houver falta considervel de
ar. Em alguns casos podem ainda ser encontrados traos
do combustvel nos gases de sada do processo. As
principais reaes entre os constituintes bsicos dos
combustveis e o oxignio so:
Combusto Elementar com Ar Estequiomtrica ou Terica
CH
4
+ 2(O
2
+3,76N
2
) CO
2
+ 2H
2
O + 2.3,76N
2
De forma geral
CH
4
+ 2o(O
2
+3,76N
2
) CO
2
+ 2H
2
O + 2. o 3,76N
2
+ (o-1) O
2
o>1 com excesso de ar Completa
o=1 Estequiomtrica
o<1 Falta de ar incompleta
Excesso e= o -1
Metano queimado com ar e a anlise dos produtos de combusto, em
base seca identificou. CO
2
=10% O
2
=2,37% CO =0,53 N
2
=87,1%
aCH
4
+ b(O
2
+3,76N
2
) 10CO
2
+ 2,37 O
2
+ 0,53 CO +dH
2
O +87,1N
2
b=87,1/3,76 = 23,16
Carbono a = 10+0,53 = 10,53
Hidrognio 2d= 4a d 4.10,53 = 21,06
Oxignio b = 10 + 0,53/2 + 2,37 + 21,06/2 = 23,16 ok
Ento
10,53CH
4
+ 23,16(O
2
+3,76N
2
) 10CO
2
+ 2,37 O
2
+ 0,53 CO +21,16H
2
O
+87,1N
2
CH
4
+ 2,2(O
2
+3,76N
2
) 0,95CO
2
+ 0,225O
2
+ 0,05 CO +2H
2
O +8,271N
2
Relao Ar/Comb (A/C)
A/C = (2,2.4,76.28,97)/1.16 = 18,97 kgAr/kgComb
Ou se
A/C massa =m
ar
/m
comb
A/Cmolar = n
ar
/n
comb
A/C massa =m
ar
/m
comb
= n
ar
. M
ar
/n
comb
. M
comb
=A/C
molar
. M
ar
/M
comb
Calcule a relao A/C para o octano C
8
H
18
.
C
8
H
18
+ 12,5(O2+3,76N2) - 8CO
2
+ 9H
2
O + 47,0N
2
.
A/Cmolar = (12,5 + 47)/1 = 59,5 kmol de ar/kmol comb
A/Cmassa = 59,5 kmolar/kmol comb . 28,97/114,2 = 15,0
kgar/kgcomb
Determine a anlise molar dos produtos de combusto do octano,
quando este queimado com 200% do ar terico, e o ponto de orvalho,
sabendo que a presso dos gases 1,0 bar.
C
8
H
18
+ 2.12,5(O2+3,76N2) - 8CO
2
+ 9H
2
O + 12,5O
2
+ 94,0N
2
.
Nmero total de moles dos produtos = 8+9+12,5+94,0 = 123,5
CO
2
= 8/123,5 = 6,47%
H
2
O = 9/123,5 = 7,29%
O
2
= 12,5/123,5 = 10,12%
N
2
.= 94/123,5 = 76,12% / 100%
Y = Pagua/Pgases = nagua/ntotais = 7,29 portanto Pagua =
0,0729.1bar = 7,29kPa na tabela de vapor com P a Temp = 39,7C
Exemplo. Etano queimado com 20% de excesso de ar, durante o
processo de combusto. Os gases saem a 100kPa, determine: A relao
A/C e o dew point temperature temp. do ponto de orvalho.
C
2
H
6
+ 4,2 (O2+3,76N2) - 2CO
2
+ 3H
2
O + 0,7O
2
+ 15,79N
2
.
A/C = 4,2.4,76kmol.28,97kg/kmol/2kmol.12kg/kmol+6kmol.kg/kmol
A/C = 19,3 kgar/kgcomb
Pv = n
agua
/n
prod
=P
prod
= 3kmol/21,49kmol . 100kPa = 13,96 kPa
Com esta presso na tabela de vapor T = 52,3C
Calcule para o acetileno C
2
H
2
Calcule para o propano C
3
H
8
Metano queimado com ar seco e os produtos so:
CO2=5,2% CO=0,33 O2=1,24
Poder Calorfico
O poder calorfico de um combustvel, quando no
declarado pelo fornecedor ou testado por meio de um
calormetro, pode ser determinado aproximadamente
por meio de frmulas (ASTM, DIN, etc.) quando se
conhece a sua composio (ver pg. 3.14).
Conhecendo-se o poder calorfico inferior (PCI)
ou ento o poder calorfico superior (PCS) se pode
passar de um valor para o outro com a frmula:
PCI = PCS - 25 (9 %H2 + %H2O) kJ/kg
Poder calorfico superior
PCS = PCI + 6 (9 H2 + H2O) kcal/kg
Calormetro
Poder calorfico inferior
- Formula de Mendelejf (slidos)
PCI = 8100C +2210S + 28700(H
2
- O
2
/8)-600H
2
O
kcal/kg
- Combustveis gasosos -(DIN 51 850)
PCI = 30.500 CO + 2.580 H
2
+ 8.530 CH
4
+ 13.500C
2
H
6
+ 14.050C
2
H
4
kcal/Nm3
Combustveis lquidos
Pci = 8.100C + 30.000H
2
- 26.000(S + O
2
) )-600H
2
O kcal/kg
- Lenha
PCI = 4 590 - 51,9 H2O kcal/kg
leo 1A -
Composio elementar em % peso (mdia)
C 85,2
H 10,8
S 3,0
N 0,5
H
2
O 0,4
Cinzas 0,1
Poder calorfico superior 42 170kJ/kg
Poder calorfico inferior 39 876kJ/kg
Gs natural Fonte: BAHIAGS S.A.- Distribudo em operao normal das unidades de processamento
Composio: % vol
CO
2
0,74
O
2
0,01
N
2
1,30
CH
4
87,29
C
2
H
6
10,24
C
3
H
8
0,42 (Propano + Pesados)
Peso MOL 17,96
Densidade 0,621 (relativa ao ar)
Poder calorfico superior 40 161 kJ/m
3
(m
3
a 20C, 1 atm)
Poder calorfico inferior 36 265 kJ/m
3
-
Distribudo quando paradas as unidades de processamento de gs nat.
(UPGN) da PETROBRS.
Composio % vol
CO
2
0,71
O
2
0,01
N
2
1,26
CH
4
82,98
C
2
H
6
9,98
C
3
H
8
2,99
I C
4
H
10
0,57
N C
4
H
10
0,80
I C
5
H
12
0,21
N C
5
H
12
0,24
C
6
H
14
0,25 (Hexano + Pesados)
Peso MOL 19,58
Densidade 0,677 (relativa ao ar)
Poder calorfico superior 43 594 kJ/m
3
(m
3
a 20C, 1 atm)
Poder calorfico inferior 39 467 kJ/m
3
( )
2 2 2 2 2 2
) 1 ( 76 , 3
2
76 , 3 AO N A O H
Y
xCO N O A O H C
Z Y X
+ +
|
.
|
\
|
+ + +
onde o coeficiente de excesso de ar.
Utilizando-se esta equao, pode-se chegar aos valores
da composio volumtrica dos gases gerados na
combusto de um determinado combustvel. Para
exemplificar esta metodologia ser utilizada, como
exemplo, a combusto do metano com excesso de ar de
10%. Esta reao dada por:
2 2 2 2 2 2 4
2 , 0 272 , 8 2 ) 76 , 3 ( 2 , 2 O N O H CO N O CH + + + + +
Biodiesel
Nmero de
Cetano
Poder Calorfico
(kJ/kg)
Viscosidade
Cinemtica
(mm2/s 40C)
Ponto de
Nevoa
(C)
Ponto de
Fluidez
(C)
Ponto de
Fulgor
(C)
Coco 675 38158 3,08 5 -3 190
Milho 65 38480 4,52 -3,4 -3 111
Algodo 51,2 - 6,8 (21C) - -4 110
Oliva 61 37287 4,7 -2 -3 >110
Mostarda 54,9 40679 5,66 1 -15 183
Palma 56,2 39070 4,5 (37,8C) 8 6 192
Canola 47,9 - 67,4 8850 - 40663 4,53-6,02 -6-1 -12 - -9 166 - 170
Aafro 49,8 - 62,2 39872 - 40060 4,31 -6 -6 149 - 180
Soja 48,7 - 55,9 3737 - 40080 3,99 - 4,4 -12 - 3 -2 --15 120
Girassol 54 - 58 38100 - 38472 4,39 - 4,79 0 - 1,5 -3 -3 85 - 110
2 4
z y
x A + =
Peso Em
z y x
A
z y x
A
l Combustve
Ar
Volume Em A A
A
l Combustve
Ar
....
16 . 12
28 , 137
. 16 . 12
) 28 . 76 , 3 32 (
...... 76 , 4
1
) 76 , 3 1 (
+ +
=
+ +
+
=
=
+
=
A A
y
x
x
) 1 ( 76 , 3
2
100
+ + +
A A x
x
) 1 ( 76 , 3
100
+ +
% em Volume
Base Seca
Base mida
% em Volume
CO
2
O
2
A A x
A
) 1 ( 76 , 3
) 1 ( 100
+ +
A A
y
x
A
) 1 ( 76 , 3
2
) 1 ( 100
+ + +
interessante notar como as equaes da se comportam
para valores extremos de . Quando no existe excesso de
ar, ou seja, igual a 1, a percentagem de CO
2
mxima
e a de O
2
nula. Na situao em que o excesso de ar
tende para o infinito, a peercentagem mdia de oxignio no
ar. Este fato pode ser melhor visualisando na figura 4.1,
elaborada para o metano.
EM MASSA
(%)
DIESE
L
*
LEO
DE
MAMON
A
*
BIODIESE
L DE
MAMONA
*
BIODIESEL
DE
MAMONA
(DESTILAD
O)*
GLICERI
NA DE
MAMONA
*
TORTA
DE
MAMONA
**
Literatur
a
Biodiesel
RME***
Diesel
***
Carbono
66,656
0
71,5739 68,4430 64,8198 54,6478 38,3450 77,2 86,6
Hidrognio
10,948
6
12,1301 11,9289 11,.3332 10,6013 5,6678 12 13,4
Nitrognio
1,7042 0,5093 0,0449 0,3292 0,3580 9,9735
Enxofre
- - - - - 0,9733
Oxignio 10,8 0
Densidade 822 830
PCi(MJ/L) 32,8 35,5
Nmero
de Cetano
51-60 51
Relao
C/H
6,1 5,9 5,7 5,7 5,15 6,8 6,4 6,5
Relao
C/H ***
6,3
% O2
% Co2
Excesso de Ar ( ) l
Este fato pode ser melhor visualisando na figura
4.1, elaborada para o metano
A
y
CO
x A
76 , 4
2
) 1
%
100
(
2
+
=
A
CO
x A
76 , 4
1
%
100
2
|
|
.
|
\
|
+
=
) 100 % 76 , 4 (
100 )
2
( %
2
2
=
O A
A
y
x A O
) 100 % 76 , 4 (
100 ) ( %
2
2
=
O A
A x A O
Gs Analisado
Base Seca
Base mida
CO
2
O
2
Excesso de ar em funo da analise dos
gases de exausto
1 - Entalpia de Formao
Quanto tratamos com substncias puras, define-s entalpia ZERO
para um estado arbitrrio e os demais estados so determinados
com relao a base assumida. Quando operamos com reaes
qumicas, esse procedimento no se aplica, uma vez que a
composio varia durante o processo.
Para melhor compreender o procedimento utilizado para reaes
qumicas, vejamos o exemplo da reao entre o carbono e o
oxignio, em regime permanente:
CO
2
1 mol
C
1 mol
O
2
1 mol
Qvc= - 393.520 kJ/kmol de CO
2
( -94054 kcal/kmol de CO
2
)
reagentes
produtos
1 bar e 25C
A primeira lei da termodinmica para esse processo
pode ser escrita como:
sada e
entrada e
moles de nmero n
kmol kJ combusto entalpia h
h n h n Qvc
s
P
s
e
R
e
= +
] / [
. .
Assumindo que a
entalpia de substncias
puras formadas por um
s elemento seja ZERO
nas condies de
presso (Po) e
temperatura (To) igual a
1 bar e 25C,
respectivamente a qual
chamaremos de entalpia
de formao .
Para o CO
2
= 393.520
kJ/kmol.
Ou seja pela equao do primeiro
princpio temos:
kmol kJ h n h n h n Qvc
CO
CO
s
P
s
e
R
e
/ 393.520 . 0 . .
2
2
= + = + =
Esta a prpria entalpia de formao de acordo
com as condies assumidas para P e T. Porm,
se , a entalpia de uma substncia ser
determinada por:
) , , (
,
T P To Po h h h
o
f P T
A + =
) , , ( T P To Po h A
) , , ( T P To Po h A
Substncia
Estado
[kJ/kmol]
C
slido
0
H
2
gs
0
N
2
gs
0
O
2
gs
0
CO
gs
-110.530
CO
2
gs
393.520
H
2
O
gs
-241.820
H
2
O
lquido
-285.830
CH
4
gs
-74.850
C
2
H
2
gs
+226.730
C
2
H
4
gs
+52.580
C
2
H
6
gs
-84.680
C
3
H
6
gs
+20.410
C
3
H
8
gs
-103.850
C
4
H
10
gs
-126.150
C
8
H
18
gs
-208.450
C
8
H
18
lquido
-249.950
CH
3
OH
gs
-200670
CH
3
OH
lquido
-238.660
C
2
H
5
OH
gs
-235.310
C
2
H
5
OH
lquido
-277.690
o
f
h
Entalpia de
formao para
algumas
substncias
Para a determinao do valor de poderemos utilizar duas
metodologias, a saber:
a) atravs das tabelas de propriedades (mais precisa
b)Utilizando a equao dos gases perfeitos
= A
T
C
dT T Cp h
25
0
). (
Onde o calor especfico molar a baixas
presses, em funo da temperatura. Este
procedimento pode ser pelas equaes ou pelas
tabelas.
C) Uso dos diagramas generalizados de entalpia
dP
T
v
T v dT T Cp h
P
. [ ). (
2
1
2
1
0
|
|
|
.
|
\
|
c
c
+ = A
Como a entalpia uma propriedade, a variao da
entalpia entre os estados 1 e 2 pode ser feita atravs
do caminho 1 1* 2* 2, onde os estados (*) esto a
uma presso suficientemente baixa para que
possamos considerar como gs ideal. Teremos esto
um processo a P= cte e dois processos a T= cte
2*
2
1
1*
s
T
entalpia de dos generaliza diagramas dos h h e h h
tabelas ou dT T Cp h h
h h h h h h h
T T To To
T
T
To T
cte T
T T
cte T
To To
cte P
To T
P T
|
|
|
.
|
\
|
|
|
|
.
|
\
|
=
|
|
|
.
|
\
|
|
|
|
.
|
\
|
+
|
|
|
.
|
\
|
+
|
|
|
.
|
\
|
= A
=
=
=
* *
0
* *
* * * *
,
). (
Os diagramas generalizados so apresentados so
apresentados no final da apostila. Lembrando que:
e so presses crticas e temperaturas crticas.
c
r
c
r
T
T
T e
P
P
P = =
c
P
c
T
Temperatura Adiabtica de Chama
Considerando m processo de combusto onde a
cmara adiabtica e sem gerar trabalho ou variao
de energia cintica e potencial. Para este tipo de
processo, a energia liberada pela combusto toda ela
se transforma em energia intera ou entalpia dos
produtos. A temperatura dos produtos ser alta. Esta
temperatura mxima do processo chamada de
Temperatura Adiabtica de Chama.
CO
2
1 mol
C
1 mol
O
2
1 mol
Cmara de
Combusto
Qualquer efeito que ocorra, tal como transferncia de calor,
trabalho, variao de energia cintica ou potencial ou
combusto incompleta, tende a reduzir a temperatura final
dos produtos.
Alm desses efeitos, a dissociao tambm contribui para
a reduo da temperatura. A altas temperaturas, existem
reaes de dissociao molecular que so endotrmicas
consomem energia reduzindo com isto a temperatura da
chama. Os efeitos da dissociao no sero considerados
neste curso.
Para calcular a temperatura adiabtica de chama (Tad)
precisamos conhecer a entalpia dos produtos nas
condies de P e T ento bvio que o processo de
determinao da Tad interativo.
Ento a primeira lei para processo adiabtico sem a
realizao de trabalho dados por:
A + =
=
h h h onde
h n h n
o
f
s
P
s
e
R
e
. .
A energia liberada pela
combusto transferida
para os produtos de
combusto.
Exemplo:
Octana lquida reage com 100% de ar terico, num processo em
regime permanente. Os reagentes esto a 25C e 1 bar.
7kJ 5.077.809, ) .( 0 , 47 ) .( 9 ) .( 8
) ( 0 [ 0 , 47 ] ) ( 820 . 241 .[ 9 ] ) ( 520 . 393 .[ 8 ) (
0 ) ( ) 25 ( 0 h) (
kJ 250.370,64 ) 0 .( 0 , 47 ) 0 .( 5 , 12 ) ( 1 ) .(
) ( . ) .(
00 , 47 9 8 ) 76 , 3 .( 5 , 12
2 2 2
2 2 2
2
18 8
0
0
-
e
2 2 2 2 2 18 8
= A + A + A
A + + A + + A + = A +
= = A
= + + = A +
A + = A +
+ + + +
N O H CO
N O H
P
CO s f s
N
f
H C
o
f
e
o
f
R
e
s
o
f
P
s e
o
f
R
e
h h h
Ento
h h h h h n
h e C
h h h n
h h n h h n
N O H CO N O H C
Portanto, a Tad encontra-se entre 2.300 e 2400K, interpolando
encontramos Tad=2.394K = 2.121C
J 5.362.731k ) .( 0 , 47 ) .( 9 ) .( 8
676 . 75 ) ( 199 . 98 ) ( 035 . 119 ) (
300 . 2 min
566.0828kJ ) .( 0 , 47 ) .( 9 ) .( 8
320 . 79 ) ( 508 . 103 ) ( 152 . 125 ) (
400 . 2 min
2 2 2
2 2 2
2 2 2
2 2 2
= A + A + A
= A = A = A
=
= A + A + A
= A = A = A
=
N O H CO
N O H CO
N O H CO
N O H CO
h h h
h h h
K T do Assu
h h h
h h h
K T do Assu
Entalpia de Combusto, Energia Interna e Poder
Calorfico
Entalpia de Combusto
quando os reagentes e produtos esto na mesma
temperatura
R
P
RP
h h h
+ =
Energia Interna
) ( .
reagentes produtos P
RP
R
P
RP
n n T R h u
u u u
+ =
+ =
Gases ideais
Algumas Relaes Estequiomtrica A/C
Est
(kgAr/kg.Comb
Combustvel A/C
Est
(kgAr/kgComb
leo Comb(1%S) 14,3
leo Comb(3%S) 13,9
GLP 15,5
GN 17,2
Lenha seca (BS) 6,0
Bagao (BS) 5,7
Lenha seca (25% Umid) 4,5
Bagao (50% Umid) 3
Eficincia
tima
O
2
CO
2
Deficincia de Ar
Excesso de Ar
Comentrios
Ar de mais
desperdia Calor
Ar de menos
desperdia
Combustvel
Combustvel no
queimado causa
poluio
Quanto melhor for o
queimador menor ser
o excesso de ar
Queimadores sem
ajuste de O2
necessitam de ar em
excesso adicional
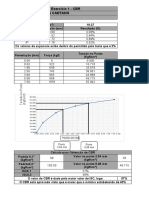
Eficincia de Combusto em Caldeiras- GN
2,0% de O2 e 9,5% de
excesso de Ar
y = -0,63x + 86,33
60
65
70
75
80
85
90
100 200 300 400 500
E
f
i
c
i
e
n
c
i
a
%
2,0% de O2 e 9,5% Ar
3,0% de 02 e 15% de Ar
5,0 de O2 e 28,1% de Ar
7,0% de O2 e 44,9% de Ar
10,0% de O2 e 81,6% de Ar
Linear (2,0% de O2 e 9,5%
Ar)
Diagrama de Oswald
FIM
S-ar putea să vă placă și
- Arquitetura BioclimáticaDocument27 paginiArquitetura BioclimáticaZuleica GomesÎncă nu există evaluări
- Manual Split ElectroluxDocument24 paginiManual Split ElectroluxDaniel50% (2)
- Catalogo 2021Document198 paginiCatalogo 2021Iohan StruckÎncă nu există evaluări
- becbcce3cb83eb760e421643428b1ca7Document4 paginibecbcce3cb83eb760e421643428b1ca7carolinaajdÎncă nu există evaluări
- Calco de SegurancaDocument2 paginiCalco de SegurancagersonplovasÎncă nu există evaluări
- Exercício 01 CBRDocument1 paginăExercício 01 CBRmatheus dubasÎncă nu există evaluări
- Procedimento de Recebimento, Secagem e Distribuição de Consumiveis de SoldagemDocument8 paginiProcedimento de Recebimento, Secagem e Distribuição de Consumiveis de SoldagemMariana dos Santos Cavatti100% (1)
- Questões Resolvidas de Vestibulares Sobre Calorimetria1Document33 paginiQuestões Resolvidas de Vestibulares Sobre Calorimetria1fernandocrottiÎncă nu există evaluări
- Pilhas EletroquímicasDocument46 paginiPilhas EletroquímicasgiokniessÎncă nu există evaluări
- Manual de Operação Trator Ursus 4-85M PDFDocument57 paginiManual de Operação Trator Ursus 4-85M PDFrichard100% (1)
- Catálogo Sem Fios e Com Fios VisonicDocument4 paginiCatálogo Sem Fios e Com Fios VisonicDuarte Mendes MendesÎncă nu există evaluări
- FQ 11 Terceiro TesteDocument6 paginiFQ 11 Terceiro TesteMaria Da Guia FonsecaÎncă nu există evaluări
- FlambagemDocument9 paginiFlambagemWillian Ricardo SantosÎncă nu există evaluări
- Desabamento Real Class - Laudo FINALDocument11 paginiDesabamento Real Class - Laudo FINALRicardo R. L. CorrêaÎncă nu există evaluări
- Apontamentos de Física PDFDocument153 paginiApontamentos de Física PDFDalsÎncă nu există evaluări
- Certificado Da Qualidade: AWS A5.1-04 ASME SFA5.1/ 2013 E6010Document1 paginăCertificado Da Qualidade: AWS A5.1-04 ASME SFA5.1/ 2013 E6010CaioEmanuelDeJesusGomesÎncă nu există evaluări
- Fiat-Scudo-2023 (Page 206)Document236 paginiFiat-Scudo-2023 (Page 206)srcattozziÎncă nu există evaluări
- Apreciação de Riscos NR 12 (Modelo)Document42 paginiApreciação de Riscos NR 12 (Modelo)Somar Engenharia75% (4)
- Contatores TeSys Giga - LC1G115KUENDocument4 paginiContatores TeSys Giga - LC1G115KUENOtávio AugustoÎncă nu există evaluări
- A.L.1.2 Um Ciclo Do CobreDocument22 paginiA.L.1.2 Um Ciclo Do CobreAna Cordeiro100% (1)
- Conserto Módulos (21) 98916-3008 Whatsapp CuiabáDocument20 paginiConserto Módulos (21) 98916-3008 Whatsapp CuiabáMarion Perdigão0% (1)
- Técnicas para Reparo em Alvenaria EstruturalDocument20 paginiTécnicas para Reparo em Alvenaria EstruturalRenato VeroneseÎncă nu există evaluări
- PT ESwitching SPTM v4030Document177 paginiPT ESwitching SPTM v4030Gervasio CaetanoÎncă nu există evaluări
- Apostila de RIGGERDocument48 paginiApostila de RIGGERLuizAlexandria100% (1)
- Aula Pratica - Adjuvantes para Herbicidas e FormulacaoDocument10 paginiAula Pratica - Adjuvantes para Herbicidas e FormulacaoHerbert NackeÎncă nu există evaluări
- SRC550H - Manual de SegurançaDocument76 paginiSRC550H - Manual de SegurançagilbertoÎncă nu există evaluări
- Manual de Utilização Transdutor 4 em 1Document19 paginiManual de Utilização Transdutor 4 em 1Alexandre macedo100% (2)
- Tarefa1 Mecanica Dos SolidosDocument5 paginiTarefa1 Mecanica Dos SolidosAnunciação DivinoÎncă nu există evaluări
- CaldeirasDocument24 paginiCaldeirasJose Marcos Martins ReisÎncă nu există evaluări
- Catalogo TZ150Document29 paginiCatalogo TZ150antonioÎncă nu există evaluări