Documente Academic
Documente Profesional
Documente Cultură
Microsoft Word - Membrana - Basal1
Încărcat de
Pérez NaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Microsoft Word - Membrana - Basal1
Încărcat de
Pérez NaDrepturi de autor:
Formate disponibile
MEMBRANA FUNCIONAL
BASAL:
EN
LA
PRCTICA
HISTOLGICA
Edward Javier Acero M. - Mara Ins Maldonado A. Docentes Morfofisiologa. Facultad de Medicina. Universidad de la Sabana. Grupo de investigaciones Procesamiento de Seales e imgenes - PROSEIM Es relevante en la formacin bsica mdica morfofisiolgica desde la perspectiva tisular, reconocer la composicin estructural de las membranas basales, dado que juegan un rol fundamental en la diferenciacin, proliferacin, migracin y mantenimiento tanto estructural como funcional particularmente de los epitelios normales. Las membranas basales en la prctica de microscopa, se ubican siempre entre los tejidos epiteliales y tejidos conectivos, dando el soporte a los epitelios unindolos fuertemente con los tejidos subyacentes. A veces no visible en la microscopa ptica con coloracin convencional de H & E, la membrana basal con fines pedaggicos, se ensea a visualizarla en lugares donde es especialmente gruesa y contrastante; en la mucosa de las vas areas como trquea y bronquios, rin, exactamente en tbulos renales y en el ojo, en estructuras especficas como la crnea. Independientemente de su ubicacin, la membrana basal se estudia considerando zonas, capas o estratos, los cuales se han evidenciado por procedimientos moleculares y de microscopia electrnica. Las zonas, estratos o capas de la membrana basal en orden desde el tejido epitelial hacia el conectivo son: Lamina Lcida, Lamina Densa y Lamina Reticular; el conjunto de las dos primeras se conoce tambin como lmina basal y no es visible con la microscopa ptica convencional en ninguna ubicacin. Lamina Lcida: Producida enteramente por las clulas epiteliales, est compuesta por complejos glicoproticos de laminina, especficamente laminina LM-332, tambin llamada Kalinina, Laminina o Epiligrina. El nombre de laminina 332 se debe a que son cadenas polipeptdicas 3, 3 y 2 codificadas por genes distintos llamados LAMA3, LAMB3 y LAMC2 respectivamente; adicionalmente a este tipo de laminina se describen glicoprotenas asociadas a ella como son las Nicenas antes llamadas protena BM600. Entre todas esas molculas asociadas, es la laminina la que se considera relevante estructural y funcionalmente porque es ella quien une a las protenas integrales de membrana que tienen y expresan las clulas
epiteliales; estas protenas llamadas integrinas son las que participan en los complejos de unin llamados hemidesmosomas. Lmina Densa: llamada as por su apariencia a la microscopa electrnica, est compuesta por colgeno tipo IV y proteoglicanos con ncleos de predominio heparn sulfato y protenas libres como entactinas (antes conocidas como protenas nidgenas) quienes establecen puentes estructurales entre el colgeno tipo IV y la laminina que se describi en la lmina lcida. Lmina Reticular: constituida por fibras colgenas tipo VII asociadas a glicoprotenas llamadas fibronectinas, las cuales tienen lugares de unin al colgeno, proteoglicanos y molculas de adhesin celular como las integrinas. Es la unin fibronectina - integrinas, que media la generacin de seales intracelulares para modificar el comportamiento de sobrevivencia o de proliferacin celular
REFERENCIAS Burgeson, R. E., Chiquet, M., Deutzmann, R., Ekblom, P., Engel, J., Kleinman, H., Martin, G. R., Meneguzzi, G., Paulsson, M., Sanes, J., Timpl, R., Tryggvason, K., Yamada, Y., and Yurchenco, P. D.(1994) Matrix Biol. 5, 209-211 Aumailley M, Bruckner-Tuderman L, Carter WG, Deutzmann R, Edgar D, Ekblom P, et al (2005) A simplified laminin nomenclature. Matrix Biol 24:326-33 Carter, WG, Ryan, MC, Gahr, PJ: Epiligrin, a new cell adhesion ligand for integrin 3 1 in epithelial basement membranes. Cell 65: 599 610, 1991 Pujuguet P, Simian M, Liaw J, et al.. Laminin and tenascin assembly and expression regulate HC11 mouse mammary cell differentiation Journal of Cell Science. 113: 849-858 (2000). Alford,D., D Baeckstrom, M Geyp, P Pitha and J Taylor-Papadimitriou Integrin-matrix interactions affect the form of the structures developing from human mammary epithelial cells in collagen or fibrin gels Journal of Cell Science, Vol 111, Issue 4 521-532, 1998
S-ar putea să vă placă și
- Tratamiento erróneo por deficiente diferenciación entre granuloma y quiste periapicalDocument48 paginiTratamiento erróneo por deficiente diferenciación entre granuloma y quiste periapicalDavid Mendoza Gamez De Oblitas82% (17)
- Erupción Dentaria - EmbriologíaDocument44 paginiErupción Dentaria - EmbriologíaWilliam BarrettÎncă nu există evaluări
- TROFOBLASTODocument23 paginiTROFOBLASTOMario PatiñoÎncă nu există evaluări
- Signos vitales y hallazgos clínicos en caso de COVID-19Document35 paginiSignos vitales y hallazgos clínicos en caso de COVID-19Edwin Sànchez ParedesÎncă nu există evaluări
- Nivel de Organización TisularDocument20 paginiNivel de Organización Tisularnik nickÎncă nu există evaluări
- Adaptación Celular, Lesión y MuerteDocument23 paginiAdaptación Celular, Lesión y MuerteUriel VilchisÎncă nu există evaluări
- 8 Medicina Interna en AvesDocument61 pagini8 Medicina Interna en AvesPablo LópezÎncă nu există evaluări
- Mapa Mental Tej ConjuntivoDocument3 paginiMapa Mental Tej ConjuntivoAlma Rosa OrtizÎncă nu există evaluări
- Preguntas 3er ParcialDocument13 paginiPreguntas 3er ParcialOmar E. García CastroÎncă nu există evaluări
- Cuadernillo-20230409 03231610qXDocument4 paginiCuadernillo-20230409 03231610qXELIO RONALD RUELAS ACEROÎncă nu există evaluări
- Caso 2 IbcDocument12 paginiCaso 2 IbcMaffher LoollÎncă nu există evaluări
- Armonización corporalDocument10 paginiArmonización corporalAndres GutierrezÎncă nu există evaluări
- Práctico de HistologíaDocument68 paginiPráctico de Histologíakathy_10_1100% (9)
- Ceprunsa 5 Histologia Oseo InteraccionDocument133 paginiCeprunsa 5 Histologia Oseo InteraccionBeth ElizÎncă nu există evaluări
- Choice de HistologíaDocument15 paginiChoice de HistologíaAna Clau CernaÎncă nu există evaluări
- Digestivo Placas HistoDocument8 paginiDigestivo Placas HistoLuis Héctor Calle mamani100% (1)
- HistologiaDocument59 paginiHistologiamax powerÎncă nu există evaluări
- Cap-05-Epitelio MejoradaDocument58 paginiCap-05-Epitelio MejoradaFannyÎncă nu există evaluări
- Histología digestiva 40Document35 paginiHistología digestiva 40Stalin Parra100% (2)
- Practica N2° de Microscopia IiDocument10 paginiPractica N2° de Microscopia IiFreyder ValeroÎncă nu există evaluări
- Características de los seres vivos y preguntas de biologíaDocument57 paginiCaracterísticas de los seres vivos y preguntas de biologíasantiagoÎncă nu există evaluări
- Histología de la cavidad oral: labio y lenguaDocument4 paginiHistología de la cavidad oral: labio y lenguaEdgar ChimbolemaÎncă nu există evaluări
- Primer SeminarioDocument7 paginiPrimer SeminarioTHEmagic 500Încă nu există evaluări
- Examen Histología 18/2Document18 paginiExamen Histología 18/2Sofi VidalÎncă nu există evaluări
- Celular y TejidosDocument4 paginiCelular y TejidosandersoleonelmatomjuanÎncă nu există evaluări
- Histologia - Aparato Reproductor Femenino y MamaDocument103 paginiHistologia - Aparato Reproductor Femenino y MamaUSMP FN ARCHIVOS100% (1)
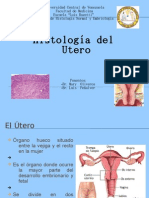
- Histologia Del UteroDocument30 paginiHistologia Del UteroLuis Peñalver Sampson97% (35)
- Garnica Ramirez Kennya Lopez Rincon Laura Prieto Valero Pilar Villareal Neira Natalia 2015Document72 paginiGarnica Ramirez Kennya Lopez Rincon Laura Prieto Valero Pilar Villareal Neira Natalia 2015Miguel NuñezÎncă nu există evaluări
- Tejido Epitelial PDFDocument23 paginiTejido Epitelial PDFDaniel Sanchez DiazÎncă nu există evaluări
- Factores de riesgo del cáncer de cuello uterinoDocument2 paginiFactores de riesgo del cáncer de cuello uterinoDiego MarcaÎncă nu există evaluări
- 200 tareas en terapia breve: 2ª ediciónDe la Everand200 tareas en terapia breve: 2ª ediciónEvaluare: 4.5 din 5 stele4.5/5 (33)
- En busca de la mente: El largo camino para comprender la vida mental (y lo que aún queda por descubrir)De la EverandEn busca de la mente: El largo camino para comprender la vida mental (y lo que aún queda por descubrir)Evaluare: 4.5 din 5 stele4.5/5 (3)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe la EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanEvaluare: 4.5 din 5 stele4.5/5 (11)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe la Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaEvaluare: 4 din 5 stele4/5 (37)
- Terapia de vidas pasadas: Un camino hacia la luz del alma. Técnica y prácticaDe la EverandTerapia de vidas pasadas: Un camino hacia la luz del alma. Técnica y prácticaEvaluare: 4.5 din 5 stele4.5/5 (11)
- Niños, adolescentes y ansiedad: ¿Un asunto de los hijos o de los padres?De la EverandNiños, adolescentes y ansiedad: ¿Un asunto de los hijos o de los padres?Evaluare: 5 din 5 stele5/5 (2)
- Principios básicos de bioquímica de los alimentosDe la EverandPrincipios básicos de bioquímica de los alimentosEvaluare: 4.5 din 5 stele4.5/5 (2)
- El autismo: Reflexiones y pautas para comprenderlo y abordarloDe la EverandEl autismo: Reflexiones y pautas para comprenderlo y abordarloEvaluare: 4 din 5 stele4/5 (7)
- Fisiología renal y metabolismo hidrosalino: Segunda ediciónDe la EverandFisiología renal y metabolismo hidrosalino: Segunda ediciónÎncă nu există evaluări
- Bioquímica: metabolismo energético, conceptos y aplicaciónDe la EverandBioquímica: metabolismo energético, conceptos y aplicaciónEvaluare: 4 din 5 stele4/5 (7)