Documente Academic
Documente Profesional
Documente Cultură
Primera Parte
Încărcat de
Bryan ATitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Primera Parte
Încărcat de
Bryan ADrepturi de autor:
Formate disponibile
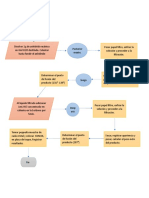
PRIMERA PARTE: Obtención de SO2
Observación: Al momento de adicionar el ácido sulfúrico al tubo de ensayo que contiene cobre y
exponerlo al calentamiento este desprende un gas, este será recogido y burbujeado en un
Erlenmeyer con agua destilada por un periodo de tiempo de 2 minutos por último se retirar el
matras taparlo y agitarlo para utilizarlo posteriormente. El gas recolectado es dióxido de azufre
(SO2).
Reacción de síntesis de SO2 a partir de cobre metálico y ácido sulfúrico concentrado
2 H 2 SO 4( ac)+Cu(s )→ 2 H 2 O(l)+ SO2(g)+CuSO 4( ac)
SEGUNDA PARTE: Propiedades de los óxidos
Tabla 1: Apariencia macroscópica de los óxidos del tercer periodo
Óxido del Estado físico Apariencia Grado de Volatilidad Color
tercer período finura
Na2O Sólido Granulado Poco fino No es volátil Gris/ Metálico
MgO Sólido Pulverulento Fino No es volátil Blanco
Al2O3 Sólido Pulverulento Fino No es volátil Blanco
P2O5 Sólido Granulado Poco fino No es volátil Blanco/grisáceo
CuO Sólido Pulverulento Fino No es volátil Negro
SiO2 Sólido Granulado Poco fino No es volátil Blanco/Grisáceo
SO2 Gaseoso Gaseoso - No es volátil Incoloro.
TERCERA PARTE: Solubilidad en agua
Tabla 2: Solubilidad en agua
Óxido del tercer período Solubilidad Observación
Si No
Na2O x Insoluble
MgO x Insoluble
Al2O3 x Insoluble
P2O5 x Muy soluble
CuO x Insoluble
SiO2 x Insoluble
SO2 x Soluble
Reacciones: Al momento de mezclar el óxido con agua, se generan en ciertas reacciones químicas.
Investigue en cuales, según lo observado,
Na 2 O(s) + H 2 O(l) →no hay reacción .
MgO( s)+ H 2O(l)→ no hay reacción
Al 2 O3(s) + H 2O(l) →no hay reacción
P 2O 5(s) +3 H 2 O (l ) → 2 H 3 PO 4 (ac)
CuO(s) + H 2 O(l) → no hay reacción
SiO 2(s )+ H 2 O(l ) → no hay reacción
SO 2( ac)+ H 2O(l )→ H 2 SO 3 (ac)
CUARTA PARTE: Disolución en ácido y/o base:
Tabla 3: Disolución en ácido/base.
Óxido del tercer Solubilidad en Solubilidad en Observación
período HCl NaOH.
Si No Si No
Cuando se agregó el ácido se observó un
Na2O x x comportamiento como con el agua, cuando a este se le
agrego la base se observó que después de un tiempo la
disolución se volvió de una tonalidad mas clara a la del
compuesto original.
Cuando se agregó el ácido se observó un
MgO x x comportamiento como con el agua, cuando a este se le
agrego la base se observó que después de un tiempo la
disolución se volvió más clara.
En este caso no se pudo notar un cambio en la estructura
Al2O3 x x del oxido de manera inmediata. Por lo tanto, se descartó
la posibilidad de que este compuesto sea soluble en
estos medios.
Cuando se agregó el ácido este reacciono con el óxido
CuO x x de cobre dando una tenue coloración verdosa. Mientras
con la base fue un resultado como el agua.
En este caso no se pudo notar un cambio en la estructura
SiO2 x x del oxido de manera inmediata. Por lo tanto, se descartó
la posibilidad de que este compuesto sea soluble en
estos medios.
Reacciones: Al momento de mezclar el óxido con HCl y con NaOH, se generan en ciertos casos en
las reacciones químicas. Investigue en cuales, según lo observado.
MgO( s)+2 HCl(ac)→ MgCl 2(ac )+ H 2 O(l)
CuO (s)+2 HCl(ac )→ CuCl 2(ac)+ H 2 O(l) Na2 O(s) +2 HCl(ac) → H 2 O(l) +2 NaCl(ac )
QUINTA PARTE: Respuesta de las soluciones de óxidos a los indicadores
Tabla 4: Respuesta de las soluciones de los óxidos a los indicadores.
Oxido del pH
tercer Indicadores Papel indicador
período Azul de metileno Fenolftaleína Rojo Congo Helenatina 1 2 3
Na2O - - - -
MgO - - - -
Al2O3 Celeste Transparente verde Naranja 7 7 7
P2O5 Naranja blanco Rosa Rojo 1 1 1
CuO - - - -
SiO2 - - - -
SO2 - - - -
S-ar putea să vă placă și
- Universidad Ricardo Palma Facultad de IngenieríaDocument10 paginiUniversidad Ricardo Palma Facultad de IngenieríaLuis Carrillo JacayÎncă nu există evaluări
- Practica # 12. Orden de Actividad de Los MetalesDocument18 paginiPractica # 12. Orden de Actividad de Los MetalesJorly Torres100% (1)
- Reporte 7 Quimica JDocument9 paginiReporte 7 Quimica JJimena BardalesÎncă nu există evaluări
- Informe 5Document5 paginiInforme 5653 Hernández Reyes Andrea AdelaideÎncă nu există evaluări
- Ley Periodica: Elementos Del Grupo 1, Periodo 3 y Elementos Del Grupo 12Document13 paginiLey Periodica: Elementos Del Grupo 1, Periodo 3 y Elementos Del Grupo 12Miguel Betancourt G100% (1)
- Copia de Sexto InformeDocument6 paginiCopia de Sexto InformeSharon Melissa Sanchez ForeroÎncă nu există evaluări
- Informe (Reaccion Oxido-Reduccion)Document8 paginiInforme (Reaccion Oxido-Reduccion)Juan Jose Vasquez Salazar100% (1)
- Análisis Elemental de Comp OrgánicosDocument8 paginiAnálisis Elemental de Comp Orgánicostahia silveraÎncă nu există evaluări
- ReaccionesDocument7 paginiReaccionesSilvia SkyloveÎncă nu există evaluări
- Compuestos Oxigenados Del AzufreDocument8 paginiCompuestos Oxigenados Del AzufreEsliDavidMolerosIngunzaÎncă nu există evaluări
- El Ciclo Del CobreDocument9 paginiEl Ciclo Del CobreLuis Daniel Barrios GarcíaÎncă nu există evaluări
- 1º Grupo de CationesDocument31 pagini1º Grupo de CationesNessa MoreiraÎncă nu există evaluări
- Propiedades físicas y químicas de los elementos del tercer periodoDocument5 paginiPropiedades físicas y químicas de los elementos del tercer periodoCharly Marquez0% (1)
- 1BT12 ReaccionesQuimicasDocument5 pagini1BT12 ReaccionesQuimicasErick LoÎncă nu există evaluări
- Lab Inorganica Grupo 12Document4 paginiLab Inorganica Grupo 12Daniel Gerardo Silgado CortazarÎncă nu există evaluări
- Síntesis de Hidróxido de CuDocument3 paginiSíntesis de Hidróxido de CuAndrés Aurelijus JuradoÎncă nu există evaluări
- Determinación de La Solubilidad Del Tercer PeriodoDocument6 paginiDeterminación de La Solubilidad Del Tercer PeriodoRuel Yanio Sierra mezaÎncă nu există evaluări
- Ciclo Del CobreDocument16 paginiCiclo Del CobreJavier OviedoÎncă nu există evaluări
- Lab Hidrogeno y OxigenoDocument7 paginiLab Hidrogeno y OxigenolorenaclaudiaÎncă nu există evaluări
- Química Inorgánica Ii. Informe 5Document8 paginiQuímica Inorgánica Ii. Informe 5Sebas MenaÎncă nu există evaluări
- Práctica No.1 - Periodicidad QuímicaDocument11 paginiPráctica No.1 - Periodicidad Químicaximena mendoza ayubÎncă nu există evaluări
- Formato Taller N°3 Reacciones QuímicasDocument7 paginiFormato Taller N°3 Reacciones QuímicasKellyChimboÎncă nu există evaluări
- Arias Holguin Torres Informe5Document10 paginiArias Holguin Torres Informe5Paula Camila Arias CaicedoÎncă nu există evaluări
- Disolucion de SalesDocument9 paginiDisolucion de SalesStefany XiomAra B SÎncă nu există evaluări
- Formación PrecipitaciónDocument16 paginiFormación PrecipitaciónAna Fernanda JáureguiÎncă nu există evaluări
- CUESTIONARIO 3 FinalDocument11 paginiCUESTIONARIO 3 FinalmariaÎncă nu există evaluări
- ALDEHIDOS Y CETONAS SEGUNDA PARTE FINAL OkDocument53 paginiALDEHIDOS Y CETONAS SEGUNDA PARTE FINAL OkGuadalupe CallisayaÎncă nu există evaluări
- Equilibrio de Solubilidad (KPS)Document16 paginiEquilibrio de Solubilidad (KPS)Gilian SkalariÎncă nu există evaluări
- Química Inorgánica - TP Nº2 Parte 1 - 11 - 06 - 2021Document24 paginiQuímica Inorgánica - TP Nº2 Parte 1 - 11 - 06 - 2021Julián MelladoÎncă nu există evaluări
- Propiedades de Los Óxidos de Los Elementos Del Tercer PeriodoDocument5 paginiPropiedades de Los Óxidos de Los Elementos Del Tercer PeriodoDayito Perez100% (1)
- Practica Laboratorio 03Document22 paginiPractica Laboratorio 03Raperito Crema Zarate PisfilÎncă nu există evaluări
- Experimento #2 - Tipos de Reacciones QuímicasDocument8 paginiExperimento #2 - Tipos de Reacciones QuímicasAnthony GarcíaÎncă nu există evaluări
- Informe N°2 - Ley Periodica Elementos Del Grupo 12Document6 paginiInforme N°2 - Ley Periodica Elementos Del Grupo 12GermanRamirezSaldanaÎncă nu există evaluări
- Práctica 6 Ácidos y Bases Duros y BlandosDocument4 paginiPráctica 6 Ácidos y Bases Duros y BlandosKazuyaUedaTatsuyaÎncă nu există evaluări
- Quimica n3 Tabla PeriodicaDocument10 paginiQuimica n3 Tabla Periodicarosa alcca huisaÎncă nu există evaluări
- Teoria y Resultados Practica3Document6 paginiTeoria y Resultados Practica3yulloubeihouppa-2682Încă nu există evaluări
- Quimica Ing - ElectrònicaDocument11 paginiQuimica Ing - ElectrònicaJean IngaÎncă nu există evaluări
- Lab 1. Compuestos de CoordinaciónDocument4 paginiLab 1. Compuestos de CoordinaciónDaniel Gerardo Silgado CortazarÎncă nu există evaluări
- Grupos metales alcalinos reaccionesDocument11 paginiGrupos metales alcalinos reaccionesEric Enrique Pariona ChuquilinÎncă nu există evaluări
- Sin TítuloDocument16 paginiSin TítuloMARIA CAROLINA SOLERA CARDENASÎncă nu există evaluări
- Practica 6 RedoxDocument23 paginiPractica 6 Redoxmelissa67% (6)
- FCQ-QI II-Informe-Propiedades de Los ÓxidosDocument9 paginiFCQ-QI II-Informe-Propiedades de Los ÓxidosSamantha CoboÎncă nu există evaluări
- Lab 02Document11 paginiLab 02Agustin GonzalesÎncă nu există evaluări
- Complejos metálicos y tinta invisibleDocument2 paginiComplejos metálicos y tinta invisibleNicolas AgueroÎncă nu există evaluări
- 4to Informe de Laboratorio de Química Inorgánica (UNMSM)Document19 pagini4to Informe de Laboratorio de Química Inorgánica (UNMSM)Fernando Sánchez100% (1)
- Reporte Practica 1Document11 paginiReporte Practica 1MarÎncă nu există evaluări
- Reporte de Experimento - 2 - Tipos de Reacciones QuímicasDocument23 paginiReporte de Experimento - 2 - Tipos de Reacciones Químicasdaniel salazarÎncă nu există evaluări
- Cuestionario Informe 7Document14 paginiCuestionario Informe 7mariaÎncă nu există evaluări
- Practica de Metales de TransicionDocument15 paginiPractica de Metales de TransicionRoxana Quincho SeguraÎncă nu există evaluări
- Informe N°11 Química InorgánicaDocument11 paginiInforme N°11 Química InorgánicaDey Rafael PortuguezÎncă nu există evaluări
- Practica 4, Laboratorio de Química General.Document13 paginiPractica 4, Laboratorio de Química General.Ana MaldonadoÎncă nu există evaluări
- Quimica General UnsaDocument17 paginiQuimica General UnsaMijaelÎncă nu există evaluări
- Informe 3-Oxígeno-Peroxidos-Oxidos-AguaDocument11 paginiInforme 3-Oxígeno-Peroxidos-Oxidos-AguaNICOL ELIZABETH MILLA CRUZÎncă nu există evaluări
- Laboratorio 4 QuimicaDocument18 paginiLaboratorio 4 QuimicaJohnnathan Javier MedinaÎncă nu există evaluări
- Resultados CorrosionDocument10 paginiResultados CorrosionGloria Nancy Cabrejo HÎncă nu există evaluări
- Formato para InformesDocument4 paginiFormato para InformesIvan Fuentes QuilcaÎncă nu există evaluări
- Informe de QuimicaDocument7 paginiInforme de QuimicaVanessa SanteroÎncă nu există evaluări
- 22 Tipos de Reacciones Químicas Inorgánicas II 2022 - 012750Document2 pagini22 Tipos de Reacciones Químicas Inorgánicas II 2022 - 012750OMAR MURILLO PALMERÎncă nu există evaluări
- SEMANA 3 (REACCIONES QUIMICAS) RecuperadoDocument69 paginiSEMANA 3 (REACCIONES QUIMICAS) RecuperadoAdrian C LermoÎncă nu există evaluări
- Guía de Prácticas de Laboratorio Química Orgánica 2Document55 paginiGuía de Prácticas de Laboratorio Química Orgánica 2Bryan AÎncă nu există evaluări
- Simetría MolecularDocument35 paginiSimetría MolecularCynthia LlangaÎncă nu există evaluări
- Compuestos de Coordinacion Campo CristalinoDocument10 paginiCompuestos de Coordinacion Campo CristalinoGreys ChuquimarcaÎncă nu există evaluări
- Tutoria N 9 Nomenclatura ComplejosDocument3 paginiTutoria N 9 Nomenclatura ComplejosBryan AÎncă nu există evaluări
- Áidos y Bases BronstedDocument25 paginiÁidos y Bases BronstedBryan AÎncă nu există evaluări
- Flujo Grama para Lab Inor2Document1 paginăFlujo Grama para Lab Inor2Bryan AÎncă nu există evaluări
- Informe Practica 3 Acido BoricoDocument7 paginiInforme Practica 3 Acido BoricoBryan AÎncă nu există evaluări
- Formato para PrelaboratoriosDocument3 paginiFormato para PrelaboratoriosBryan AÎncă nu există evaluări
- Formato para PrelaboratoriosDocument3 paginiFormato para PrelaboratoriosBryan AÎncă nu există evaluări
- Biologia Molecular: Examen Resultado Unidades Valores de ReferenciaDocument1 paginăBiologia Molecular: Examen Resultado Unidades Valores de ReferenciaBryan AÎncă nu există evaluări
- InformeLabFCQ tituloDocument2 paginiInformeLabFCQ tituloDavid FernandoÎncă nu există evaluări
- Reporte B Nerolina Tecnica Experimental y El Mecanismo de Reaccion para La Misma SintesisDocument9 paginiReporte B Nerolina Tecnica Experimental y El Mecanismo de Reaccion para La Misma SintesisBryan AÎncă nu există evaluări
- Sintesis de La Nerolina Eter AsimetricoDocument13 paginiSintesis de La Nerolina Eter AsimetricoBryan AÎncă nu există evaluări
- Bryan Pilatasig QR S4 Quimiometria Tarea 1Document8 paginiBryan Pilatasig QR S4 Quimiometria Tarea 1Bryan AÎncă nu există evaluări
- Formato Informe Síntesis Del K (CR (C2O4) 2 (H2O) ) .3H2ODocument2 paginiFormato Informe Síntesis Del K (CR (C2O4) 2 (H2O) ) .3H2OBryan AÎncă nu există evaluări
- Electroniquelado y galvanizadoDocument7 paginiElectroniquelado y galvanizadoBryan AÎncă nu există evaluări
- Formato ExpoDocument4 paginiFormato ExpoBryan AÎncă nu există evaluări
- Taller 1 Algebra Lineal Edo - Bryan - Pilatasig - p1 - s3Document2 paginiTaller 1 Algebra Lineal Edo - Bryan - Pilatasig - p1 - s3Bryan AÎncă nu există evaluări
- Preparación del Cloruro Hexamino Cobalto (IIIDocument6 paginiPreparación del Cloruro Hexamino Cobalto (IIIBryan AÎncă nu există evaluări
- Ecuaciones redox y números de oxidaciónDocument2 paginiEcuaciones redox y números de oxidaciónBryan AÎncă nu există evaluări
- Tutoria N 9 Nomenclatura ComplejosDocument3 paginiTutoria N 9 Nomenclatura ComplejosBryan AÎncă nu există evaluări
- Tarea 3 Fisica III Unidad 3Document4 paginiTarea 3 Fisica III Unidad 3Bryan AÎncă nu există evaluări
- 05 Ejercicio NCDocument2 pagini05 Ejercicio NCBryan AÎncă nu există evaluări
- Áidos y Bases BronstedDocument25 paginiÁidos y Bases BronstedBryan AÎncă nu există evaluări
- Guía Síntesis Del K (CR (C2O4) 2 (H2O) )Document3 paginiGuía Síntesis Del K (CR (C2O4) 2 (H2O) )Denisse CruzÎncă nu există evaluări
- 21 TERAN-PUEBLA-GUERRA FIsica Experimental V1 - OptDocument146 pagini21 TERAN-PUEBLA-GUERRA FIsica Experimental V1 - OptBryan AÎncă nu există evaluări
- Isomería Cis y TransDocument1 paginăIsomería Cis y TransBryan AÎncă nu există evaluări
- Evaluación Unidad II Desarrollo Del ConocimientoDocument5 paginiEvaluación Unidad II Desarrollo Del ConocimientoBryan AÎncă nu există evaluări
- Evaluación Unidad I - Corrientes EpistemológicasDocument7 paginiEvaluación Unidad I - Corrientes EpistemológicasBryan AÎncă nu există evaluări
- Acroleina A Partir de Propileno y Un Catalizador PDFDocument121 paginiAcroleina A Partir de Propileno y Un Catalizador PDFantamanÎncă nu există evaluări
- Tratado de Farmacia Práctico y TeóricoDocument407 paginiTratado de Farmacia Práctico y Teóricopedro deazturiaÎncă nu există evaluări
- Optimización de la desoxidación y calidad superficial en aceros 1008A2Document112 paginiOptimización de la desoxidación y calidad superficial en aceros 1008A2Magaly Benavente0% (1)
- Práctica #6 MetalesDocument4 paginiPráctica #6 MetalesAbrahan CruzÎncă nu există evaluări
- Espesores de TuberiaDocument6 paginiEspesores de TuberiaLuis FerchoÎncă nu există evaluări
- Escuela Ingeniería MetalúrgicaDocument64 paginiEscuela Ingeniería MetalúrgicaFernando Manuel Rodríguez ValenciaÎncă nu există evaluări
- Quimica GeneralDocument3 paginiQuimica GeneralMiguel AngelÎncă nu există evaluări
- 03 ValvulasDocument16 pagini03 ValvulasEdmar CárdenasÎncă nu există evaluări
- SQM NitratosDocument27 paginiSQM NitratosHéctor Méndez SandovalÎncă nu există evaluări
- Tabla de Clasificación de Las Sustancias Químicas PeligrosasDocument6 paginiTabla de Clasificación de Las Sustancias Químicas Peligrosasxiomygut100% (1)
- Informe de Laboratoriorecocido Acero Aisi 1040Document13 paginiInforme de Laboratoriorecocido Acero Aisi 1040SebaxtIan BarrIos100% (1)
- Soldeo fuerte y blando: procesos y característicasDocument11 paginiSoldeo fuerte y blando: procesos y característicasmelisa0% (1)
- Innershield NR-233 PDFDocument2 paginiInnershield NR-233 PDFvampiredraak2712Încă nu există evaluări
- Experto Procesos Obtencion Metalurgia ExtractivaDocument13 paginiExperto Procesos Obtencion Metalurgia ExtractivaTexx TexxÎncă nu există evaluări
- Temperatura de FundicionDocument10 paginiTemperatura de FundicionHenry AcoÎncă nu există evaluări
- AlcalinoterreosDocument20 paginiAlcalinoterreosJorgeMartinÎncă nu există evaluări
- Practica n1 AmalgamacionDocument8 paginiPractica n1 AmalgamacionEdson HurtadoÎncă nu există evaluări
- Ejercicios Repaso FQDocument6 paginiEjercicios Repaso FQAnonymous wVtGRIDgÎncă nu există evaluări
- PST OxicorteDocument9 paginiPST OxicortedaniqloÎncă nu există evaluări
- SEMANA 2 Función OxidosDocument44 paginiSEMANA 2 Función OxidosAlex ZteÎncă nu există evaluări
- ESTÁNDARES DE CALIDAD AMBIENTAL AGUA Suelo y AireDocument23 paginiESTÁNDARES DE CALIDAD AMBIENTAL AGUA Suelo y AireJuan camiloÎncă nu există evaluări
- GrapasDocument9 paginiGrapasByron Cedeño PaladinesÎncă nu există evaluări
- Informe de Moldeo y Colada FinalDocument22 paginiInforme de Moldeo y Colada FinalElizabethÎncă nu există evaluări
- Clase - 5 - Diagrama Fe-CDocument18 paginiClase - 5 - Diagrama Fe-CNicolas Ignacio Olivares MaturanaÎncă nu există evaluări
- Ficha Tecnica Metalosate MultimineralDocument1 paginăFicha Tecnica Metalosate MultimineralDavid DiazÎncă nu există evaluări
- Actividades de Nomenclatura I para Cuarto Grado de SecundariaDocument10 paginiActividades de Nomenclatura I para Cuarto Grado de SecundariavidamaÎncă nu există evaluări
- DiamanteDocument8 paginiDiamanteMarinanita De JesúsÎncă nu există evaluări
- Practica 3 Identificacion de Los ElementosDocument22 paginiPractica 3 Identificacion de Los ElementosSergio Torres0% (2)
- NTC 5167Document39 paginiNTC 5167David SanabriaÎncă nu există evaluări