Documente Academic
Documente Profesional
Documente Cultură
FQ 06 Cinetica
Încărcat de
Fernando SousaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
FQ 06 Cinetica
Încărcat de
Fernando SousaDrepturi de autor:
Formate disponibile
Fabianoraco.oi.com.
br
FSIICO--QUMIICA F S C O QU M C A
Estudo da Velocidade das Reaes Cintica Qumica
CLASSIFICAO PERIDICA DOS ELEMENTOS QUMICOS COM MASSAS BASEADAS NO CARBONO-12
Professor Fabiano Ramos Costa Qumica No se Decora, Compreende!
Extrada do site http://www.chem.qmul.ac.uk/iupac/AtWt/table.html (27/10/05)
Fabianoraco.oi.com.br
FSIICO--QUMIICA F S C O QU M C A
Estudo da Velocidade das Reaes Cintica Qumica
CINTICA QUMICA
Cintica Qumica o estudo da velocidade das reaes qumicas e dos fatores que nela interferem.
VELOCIDADE MDIA DE UMA REAO
Na fsica, quando desejamos calcular a velocidade de um determinado corpo, medimos o seu deslocamento em funo do variao do tempo para percorrer a distncia medida. Isto , v = d . t Para a medio da velocidade da reao, no entanto, no existe deslocamento, mas existe variao da concentrao de reagentes e de produtos. Portanto, para se medir a velocidade de uma determinada reao precisamos saber quanto do reagente que "desaparece" e quanto de produto se "forma", por unidade de tempo (segundos, minutos, horas, etc.). VELOCIDADE DE CONSUMO
Reao Genrica
Re agentes
" quantid . A" t " quantid .B" vB = t vA =
VELOCIDADE DE PRODUO
A+ B C + D
Pr odutos
vC = + vD
" quantid .C " t " quantid . D " = + t
O sinal - e + indicam consumo e produo, respectivamente. VELOCIDADE MDIA DE REAO PADRO
v=
[ A] [ B ] [C ] [ D] = =+ =+ at bt ct dt
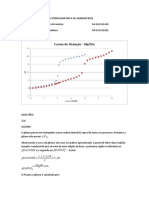
Imaginemos 8,0 mol de NH3 em um recipiente de 1,0 L. Com o passar do tempo, ocorre a decomposio da amnia em N2 e H2, segundo a reao balanceada: 2 NH3 N2 + 3 H2 Se, por mtodos adequados, observarmos a seguinte variao na concentrao da amnia: Concentrao 8,0 4,0 2,0 1,0 da amnia (mol/L) Tempo / horas 0 1 2 3 Graficamente, teremos:
[N H 3] O s m b o l o [ ] u s a d o n a f s i c o q u m ic a par a r e p r e s e n t ar c o n c e n tr a o m o l ar ( m o l/ L )
A c u r v a d e c r e s c e n te i n di c a q u e a a m n i a c o n s u m i d a co m o p a ss a r d o tem po
2 1
tem po / h
Podemos calcular a velocidade mdia do consumo da amnia: t 1 - 0 = 1h 2 - 1 = 1h 3 - 2 = 1h [NH3] |4 - 8| = 4 mol.L-1 |2 - 4| = 2 mol.L-1 |1 - 2| = 1 mol.L-1 Vm Vm = 4 mol.L-1.h-1 Vm = 2 mol.L-1.h-1 Vm = 1 mol.L-1.h-1
Observe que a velocidade da reao NO CONSTANTE
Professor Fabiano Ramos Costa Qumica No se Decora, Compreende!
Fabianoraco.oi.com.br
FSIICO--QUMIICA F S C O QU M C A
Estudo da Velocidade das Reaes Cintica Qumica
AS COLISES EFETIVAS
Como sabemos, as molculas possuem um movimento de agitao trmica que faz com que estejam continuamente sofrendo colises. 2 HI, necessrio que o impacto entre H2 e I2 provoque o rompimento de ligaes j Assim, na reao H2 + I2 existentes, permitindo a formao de novas ligaes que vo dar origem substncia HI. Esses tipos de choques recebem a denominao de colises efetivas. Uma coliso ser efetiva quando: As partculas estiverem em posio favorvel coliso. As partculas tiverem energia suficiente para formar o complexo ativado.
I2 H
2
2 HI
C o m p le x o A tiv a d o
ENERGIA DE ATIVAO
Energia (Entalpia) KJ.mol -1 45 Energia de Ativao 10 HI
Complexo Ativado
Apenas as molculas dotadas de energia suficiente conseguem sofrer colises efetivas, portanto, as molculas devem possuir um valor mnimo de energia para que a reao ocorra. Essa energia mnima denominada "ENERGIA DE ATIVAO". Podemos representar a reao HI grfico aolado.
1/2
H2 + 1/2 I2 atravs do
/2 H2 + 1/ 2 I2
Observando o grfico verificamos que existe uma barreira de energia (energia de ativao) a ser vencida para que ocorra a reao e conseqente formao dos produtos.
QUANTO MAIOR A ENERGIA DE ATIVAO, MAIS LENTA A REAO.
Andamento da Reao
Como os reagentes tm energia mais baixa que os produtos, dizemos que a reao endotrmica, uma vez o H = 10 - 0 = 10KJ.mol-1. Em outras palavras, a reao absorve calor, ao invs de liber-lo para o ambiente. Energia Alm desse tipo de reao (endotrmica) existe uma outra, a reao (Entalpia) exotrmica, isto , aquela que absorve calor do ambiente. Observe o grfico de KJ.mol -1 Complexo energia da reao NO2 + CO NO + CO2 ao lado. Ativado
555
Observando o grfico verificamos que existe uma barreira de energia (energia de ativao) a ser vencida para que ocorra a reao e conseqente formao dos produtos.
Energia de Ativao 439 NO2 + CO NO + CO2
QUANTO MAIOR A ENERGIA DE ATIVAO, MAIS LENTA A REAO.
Como os reagentes tm energia mais alta que os produtos, dizemos que a reao exotrmica, uma vez o H = 214 - 439 = -225KJ.mol-1. Em outras palavras, a reao libera calor, ao invs de absorv-lo do ambiente. Portanto,
214
Andamento da Reao
A velocidade de uma reao depende do nmero de molculas que possuam energia igual ou maior que a energia de ativao.
Professor Fabiano Ramos Costa Qumica No se Decora, Compreende!
Fabianoraco.oi.com.br
FSIICO--QUMIICA F S C O QU M C A
Estudo da Velocidade das Reaes Cintica Qumica
FATORES QUE INFLUEM NA VELOCIDADE DAS REAES
Efeito Do Catalisador Sobre A Velocidade De Uma Reao
Catalisador uma espcie qumica ou biolgica (enzima) que aumenta a velocidade de uma reao ao abaixar a energia de ativao de uma reao, sem ser consumido durante o processo. O efeito do catalisador sobre a reao pode ser mostrada no grfico de energia:
Energia (Entalpia) KJ.mol -1 555
Complexo Ativado
Sem uso do catalisador
439
NO2 + CO NO + CO2
Com uso do catalisador
214
Andamento da Reao
Para efeito de exemplificao, podemos analisar a reao de decomposio da gua oxigenada (H2O2) em gua e gs oxignio. Esse processo ocorre naturalmente, porm, num tempo muito longo. Para torn-la mais rpida, basta acrescentar gua oxigenada uma pitada de bixido de mangans (MnO2). A reao processarse- da seguinte maneira:
H 2O2 MnO2 H 2O + 1 O2 2
ou
H 2O2 + MnO2 H 2O + 1 O2 + MnO2 2
Note que o bixido de mangans no foi consumido durante o processo. A catlise pode ser homognea ou heterognea: Catlise Homognea: aquela que ocorre em uma nica fase. O catalisador tem o mesmo estado de agregao que os reagentes. Catlise heterognea: aquela que ocorre na presena de um catalisador com estado de agregao diferente dos reagentes.
Efeito Da Temperatura
O aumento da temperatura aumenta a agitao das molculas. Assim, aumenta o nmero de molculas com energia igual ou superior energia de ativao. A velocidade da reao ser maior devido ao aumento do nmero de choques.
Efeito Da Presso
Para reagentes gasosos, o aumento da presso favorecer o aumento da velocidade da reao, pois, com a diminuio do volume, aumenta-se a freqncia dos choques.
Efeito Da Superfcie De Contato
Quando algum reagente for slido, a velocidade da reao no depender da sua concentrao no sistema e sim da sua superfcie de contato.
Quanto maior a superfcie de contato entre os reagentes, maior a velocidade da reao, pois ocorre maior probabilidade de choques efetivos.
Professor Fabiano Ramos Costa Qumica No se Decora, Compreende!
Fabianoraco.oi.com.br Efeito Do Estado Fsico
FSIICO--QUMIICA F S C O QU M C A
Estudo da Velocidade das Reaes Cintica Qumica
Como uma reao pressupe a coliso entre as partculas reagentes, quanto maior a mobilidade destas, mais veloz a reao. Um slido tem mobilidade praticamente nula, um lquido j possui uma mobilidade maior, enquanto um gs possui mobilidade mxima. Portanto, a maior velocidade que podemos encontrar numa determinada reao quando os reagentes esto na forma gasosa. Contudo, nem sempre os reagentes so gasosos, ento, precisamos dissolver o material em um solvente apropriado para que surja a mobilidade dos reagentes, necessria coliso efetiva. A este efeito d-se o nome de efeito gaiola.
Efeito Da Concentrao Dos Reagentes
Quanto maior o nmero de colises, mais rpida ser a reao. Ento, Quanto maior for a concentrao dos reagentes, maior ser a velocidade de uma reao. Para uma reao A + B produtos, de forma elementar (ocorre em apenas um nica etapa), a velocidade depende da coliso simultnea de uma molcula A com uma B. Quanto maior for a concentrao de A ou de B, maior ser a probabilidade de haver as colises necessrias:
2 COLISES
A
B
REAO II
A
1 COLISO Duplicando a concentrao de A
A
REAO I
B
Duplicando a concentrao de B
A
B
REAO III
2 COLISES
Duplicando o nmero de molculas de A ou de B, podemos observar que o nmero de colises dobra. Com isso, verificamos que a velocidade da reao diretamente proporcional ao produto das concentraes molares de A e de B. Para reaes elementares, Guldberg e Waage determinaram: a velocidade depende da concentrao de A e de B, segundo a potenciao respectiva com seus coeficientes estequiomtricos. (LEI DA AO DAS MASSAS) Na reao I, A + B produtos, podemos equacionar a velocidade da reao, segundo Guldberg-Waage, como: V = k.[A].[B], onde k uma constante de velocidade que leva em conta a caracterstica da reao e a temperatura. Na reao II, 2A + B A + A + B produtos V = k.[A].[A].[B] V = k.[A]2.[B] Na reao III, A + 2B A + B + B produtos V = k.[A].[B].[B] V = k.[A].[B]2 Generalizando: Para uma reao aA + bB produtos, a lei cintica v = k.[A]a.[B]b Para reaes no-elementares, a reao se processa segundo uma seqncia de reaes elementares, denominada de mecanismo de reao. Nestas reaes, a etapa determinante da velocidade da reao aquela que for mais lenta: MECANISMO DE REAO
HBr + O2 HOOBr HBr + HOOBr HOBr + HOBr 2 HBr + 2 HOBr 2 H 2 O + 2 Br2 4 HBr + O2 2 H 2O + 2 Br2
produtos, podemos equacionar a velocidade da reao como:
produtos:
LEI DA AO DAS MASSAS
(lenta ) v = k[ HBr ][O2 ] (rpida ) v = k[ HBr ][ HOOBr ] (rpida ) v = k[ HBr ][ HOBr ]
Na reao acima: 4HBr + O2 2Br2 + 2H2O, a etapa que determina a velocidade da reao a primeira, pois a mais lenta. Portanto, a velocidade da reao determinada pela Lei da Ao das Massas de Guldberg-Waage atravs da expresso v = k.[HBr].[O2] e no pela v = k.[HBr]4.[O2].
Professor Fabiano Ramos Costa Qumica No se Decora, Compreende!
Fabianoraco.oi.com.br
FSIICO--QUMIICA F S C O QU M C A
Estudo da Velocidade das Reaes Cintica Qumica
TERMOS UTILIZADOS NA CINTICA QUMICA
Molecularidade: o nmero de molculas reagentes (ou tomos livres ou ons) que tomam parte em uma reao elementar. Ordem: a potncia com a qual a concentrao de uma substncia elevada na lei de velocidade.
EXERCCIOS RESOLVIDOS
1. A Cintica da reao: 2A(aq) + 3B(aq) 2C(aq) + D(aq) foi acompanhada e o resultado :
2 A( aq ) + 3B( aq ) 2C( aq ) + D( aq )
Experincia 1 2 3 Com estes dados, determine: a) A equao da velocidade da reao. Supondo todas as experincias com a mesma temperatura e mesmas condies gerais, as variaes obtidas nas velocidades de um experimento para outro, podem ser atribudos somente s mudanas das concentraes dos reagentes. Assim, analisando as experincias 1 e 2, temos que a concentrao de A no mudou e a concentrao de B dobrou, causando a duplicao tambm da velocidade, portanto, a ordem de B 1. Da mesma forma da experincia 2 para a 3, a duplicao da concentrao de A, com concentrao de B constante, causou a quaduplicao da velocidade, portanto, a ordem de A 2. Da experincia 3 podemos tirar o valor da constante de velocidade (velocidade unitria) de forma direta, portanto, k = 1,6.10-3. Da: [A] 05 0,5 1,0 [B] 0,5 1,0 1,0 Velocidade (mol/) 2.10-4 4.10-4 1,6.10-3
v = 1,6.10 3.[ A]2 .[ B ]
b) c) A ordem de cada reagente e a molecularidade da reao. A velocidade da reao quando as concentraes dos reagentes for 1,0mol/.
Conforme dito em a, a ordem de A = 2 e a ordem de B = 1. A molecularidade da reao 3, pois 2 molculas de A interagem com 1 de B. v = 1,6.10-3 . (0,1)2 . (0,1) = 1,6.10-6mol.-1.min-1.
Professor Fabiano Ramos Costa Qumica No se Decora, Compreende!
S-ar putea să vă placă și
- Sabão Do Professor Luiz PauloDocument63 paginiSabão Do Professor Luiz PauloLilia Fernandes Vasconcelos100% (3)
- A-5 - Bombas de CalorDocument51 paginiA-5 - Bombas de CalorYan Felipe CavalcanteÎncă nu există evaluări
- Tudo Se Transforma - Reações Químicas Os Primórdios: O Início Da QuímicaDocument16 paginiTudo Se Transforma - Reações Químicas Os Primórdios: O Início Da Químicafrancisco gomes100% (1)
- Natalia Lyrio DissertacaoDocument65 paginiNatalia Lyrio DissertacaoMarcos GarcezÎncă nu există evaluări
- Linha de Produtos Kingspan Isoeste 9Document36 paginiLinha de Produtos Kingspan Isoeste 9Eduardo OliveiraÎncă nu există evaluări
- Apostila Física IDocument21 paginiApostila Física Ilviviane986Încă nu există evaluări
- LIVRO IEC Corrosão em Instalações Metálicas Enterradas Ou SubmersasDocument211 paginiLIVRO IEC Corrosão em Instalações Metálicas Enterradas Ou Submersasvitoripolo75% (4)
- Preparo de Água CloradaDocument2 paginiPreparo de Água CloradaJoemar Mendes Rego100% (1)
- ManualDocument47 paginiManualEconomy AssistanceÎncă nu există evaluări
- Patologia em Madeira.Document23 paginiPatologia em Madeira.Piter JhonatanÎncă nu există evaluări
- Determinação de Acidez em AlimentosDocument2 paginiDeterminação de Acidez em AlimentosWanderson CândidoÎncă nu există evaluări
- Apostila Inspeção de MotoresDocument58 paginiApostila Inspeção de MotoresLucas Silva100% (1)
- Quimica Relatorio ExperiementalDocument9 paginiQuimica Relatorio ExperiementalFernando Silva MonteiroÎncă nu există evaluări
- Catalogo de OrinesDocument51 paginiCatalogo de OrinesAlexisAlejandroSandovalFlores0% (1)
- Apostila Analise de Risco CetesbDocument237 paginiApostila Analise de Risco CetesbMaurílio Donizetti100% (1)
- Estudo Dirigido 01 ToxicologiaDocument3 paginiEstudo Dirigido 01 ToxicologiaJullyara UlhÎncă nu există evaluări
- Cinetica QuimicaDocument54 paginiCinetica QuimicaVioleta ValèryÎncă nu există evaluări
- Zen Design Catalogo Alcasmacanetas WebDocument76 paginiZen Design Catalogo Alcasmacanetas WebFabiano Souza RochaÎncă nu există evaluări
- Cinética Química - IntroduçãoDocument34 paginiCinética Química - IntroduçãoEdson Miranda MarquesÎncă nu există evaluări
- NBR 5586 - Tubos de Aco-Carbono e de Acos-Liga Ferritico e Austenitico Com Ou Sem Costura - RequiDocument17 paginiNBR 5586 - Tubos de Aco-Carbono e de Acos-Liga Ferritico e Austenitico Com Ou Sem Costura - RequiDenis Yasmin AlineÎncă nu există evaluări
- Lista de Exercícios de Massa MolarDocument2 paginiLista de Exercícios de Massa MolarGiovana Baptista100% (2)
- Aula Suspensões SuzanaDocument22 paginiAula Suspensões SuzanaSuzana BenderÎncă nu există evaluări
- Bloco DataçãoDocument22 paginiBloco DataçãoJorge HonzÎncă nu există evaluări
- Gases Toxicos em Espaço ConfinadoDocument94 paginiGases Toxicos em Espaço ConfinadosarajackÎncă nu există evaluări
- Bioquimica 1Document2 paginiBioquimica 1Felipe HiroÎncă nu există evaluări
- Lista de Exercicios 5 - Lic. QuimicaDocument3 paginiLista de Exercicios 5 - Lic. QuimicaAbebeÎncă nu există evaluări
- Tabela Recomendacao CaminhaoDocument1 paginăTabela Recomendacao CaminhaoMarília MeneguzzoÎncă nu există evaluări
- Fechamento Problema 4Document10 paginiFechamento Problema 4anna luisaÎncă nu există evaluări
- Tratamento Termico SuperficiaisDocument96 paginiTratamento Termico SuperficiaisGustavoSilva100% (1)
- Pureza e RendimentoDocument1 paginăPureza e RendimentoEdilson JuniorÎncă nu există evaluări