Documente Academic
Documente Profesional
Documente Cultură
Guía Práctica de Complemento Septiembre 2011
Încărcat de
InmunoBlogTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Guía Práctica de Complemento Septiembre 2011
Încărcat de
InmunoBlogDrepturi de autor:
Formate disponibile
CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS MDICAS ESCUELA DE MEDICINA CTEDRA DE INMUNOLOGA
PRCTICA DE LABORATORIO No.11 INMUNOHEMLISIS: VALORACIN DE LA INTEGRIDAD DE VA CLSICA DEL COMPLEMENTO
.INTRODUCCIN:
El sistema del complemento, fue identificado hace muchos aos como un principio termo-lbil que complementaba a los anticuerpos en la funcin de destruir patgenos (de ah se origina su nombre). Ahora se conoce que esta no es su nica funcin y que no depende siempre de anticuerpos para actuar. El sistema del complemento juega un rol importante en la defensa del husped ante microorganismos y en los procesos inflamatorios. Est compuesto por ms de 30 pequeas protenas de superficie celular y plasmticas, principalmente sintetizadas en el hgado y que se encuentran normalmente como precursores inactivos (zimgenos o pro-protenas) que, ante la presencia de ciertos estmulos, por ejemplo agentes patgenos, se activan secuencialmente en forma de una cascada enzimtica similar a aquellas de la va de la coagulacin, fibrinlisis, entre otras. Las protenas del complemento en el plasma se hallan en cantidades mayores a 3g por litro y corresponden al 15% de la fraccin globulnica. Los componentes C3 y C4 son los ms abundantes con concentraciones mximas de C3 de 1200ug/mL y de C4 de 500ug/mL. Los niveles de las protenas del complemento pueden disminuir debido a un incrementado consumo y ms raramente a deficiencias hereditarias. Niveles disminuidos pueden observarse en infecciones recurrentes principalmente por bacterias, enfermedades autoinmunes como Lupus Eritematoso sistmico y vasculitis, malnutricin, septicemia, angioedema hereditario o adquirido. Las protenas del complemento pueden estar incrementadas juntamente con las protenas de la fase aguda durante inflamacin aguda o crnica de la inflamacin. Si las condiciones que alteraron los niveles del complemento desaparecen las protenas se normalizarn. Las alteraciones cuantitativas o funcionales del complemento pueden ser determinadas en el laboratorio por diferentes tcnicas como ELISA, nefelometra, o la valoracin de la capacidad hemoltica.
II. OBJETIVOS: Determinar la integridad funcional de la va clsica del sistema del complemento mediante la tcnica de inmunohemlisis o capacidad hemoltica 50 (CH50). Comprender las funciones, y vas de activacin del sistema del complemento. III. MARCO TERICO: El sistema del complemento es uno de los principales mecanismos efectores de la inmunidad humoral y tambin y es un importante mecanismo efector de la inmunidad innata. Las funciones efectoras del sistema del complemento en las dos inmunidades, se pueden resumir como se muestra en la Tabla 1.
Tabla 1: FUNCIONES DEL COMPLEMENTO ACTIVIDAD Defensa del husped contra infecciones. Integracin entre la inmunidad innata y adaptativa Opsonizacin Quimiotaxis y activacin de leucocitos Lisis bacteriana y celular Memoria inmunolgica FACTORES DEL COMPLEMENTO INVOLUCRADOS C3b, C4b, C3dg, iC3b, receptores CR3, CR4, CR1 Anafilotoxinas (C5a, C3a y C4a); receptores de anafilotoxinas en leucocitos Complejo de ataque de membrana (C5b-C9) C3d, receptores CR2 clulas B y clula folicular dendrtica. Unin de C3b y C4b a los complejos inmunes y a los antgenos foliculares C1q, fragmentos de C3 y C4 ligados covalentemente.
Eliminacin de desechos
Incremento en la respuesta por anticuerpos Limpieza de inmunocomplejos Remocin de clulas apoptsicas
Traducido y modificado de: MACKAY I., ROSEN, F., WALPORT, M., et al. (2001) Advances in Immunology: Complement. The New England Journal of Medicine, Vol 344, 14, 1.
Hay tres vas principales de activacin del complemento: la va clsica, que se activa por principalmente por ciertos tipos de anticuerpos unidos a su antgeno respectivo; la va alternativa, que se activa espontneamente en la fase fluida o se activa sobre las superficies de las clulas microbianas sin necesitar a los anticuerpos como mediadores; y la va de la lectina, que se activa por MBL y ficolinas plasmticas que se unen a manosa y monosacridos modificados (N-acetil glucosamina) sobre las superficies de los microorganismos, respectivamente (Abbas & Lichtman: 2008, pp.330). Una vez iniciada la activacin las tres vas convergen en una va comn. El sistema del complemento adems cuenta con mecanismos regulatorios para lograr que, por una parte, la activacin se d adecuadamente en la superficie de patgenos y, por otra, que el depsito de protenas del complemento y el consiguiente dao, sea mnimo en clulas del husped. Si este delicado balance se altera, el sistema de complemento puede causar dao tisular como se ha demostrado en varias entidades clnicas. VA CLSICA. Intervienen en esta va las protenas C1 compuesta de C1q, (C1s)2, (C1r)2, y los componentes C2, C4 y C3. La activacin del complejo C1 se da al unir 1 o ms de las 6 cabezas globulares de la molcula de C1q, a cualquiera de los siguientes ligandos: a) componentes de pared de clulas apoptticas, ciertos virus, bacterias gram negativas y positivas, b) protena C reactiva unida a ligando y c) complejos inmunes (antgeno-anticuerpo). sta ltima unin es el estmulo ms comn y de mayor importancia ya que constituye un nexo entre la inmunidad innata y la adaptativa. Una vez que C1q se ha unido al ligando se activa C1r y luego este activa a C1s que es la fraccin enzimtica activa del complejo C1 (C1s) que fragmenta primero a C4 en C4a y C4b y, luego, a C2 en C2a y C2b. Los fragmentos C4b y C2a se quedan unidos y forman la convertasa de C3, cuya parte activa es C2a, enzima que va a fragmentar muchas molculas de C3 en C3b y C3a, en el paso de amplificacin de la va clsica. VA ALTERNATIVA En esta va la hidrlisis espontnea de C3 es el iniciador. Esta protena es abundante en el plasma y resulta continuamente modificada en un proceso llamado tickover - para generar C3(H2O), sta une al factor B para que el factor D lo fragmente en Ba y Bb, este ltimo se queda unido a C3(H2O), y forma la convertasa de C3 (C3(H2O)Bb) de fase fluida (no unida a superficie celular). Aunque esta convertasa se produce en baja cantidad puede fragmentar muchas molculas de C3 en C3b y C3a. De las de C3b formadas, una parte se inactiva por hidrlisis, las dems molculas se unen covalentemente a travs de su grupo tioester activo a las superficies de clulas propias o de bacterias, dnde puede ligar al factor B y con ayuda del 2
factor D formar la convertasa de la va alternativa (C3bBb) la cual al estar unida a la superficie celular es ms estable. Esta convertasa rompe C3 en C3a y C3b. En la membrana de nuestras clulas existen varias protenas que evitan la formacin de esta convertasa, no as en la superficie de los microorganismos. VA DE LA LECTINA (MBL mannose binding lectin y Ficolina) Se inicia cuando la lectina ligadora de manosa (MBL) protena srica de origen heptico, se une a residuos de los polisacridos de pared bacteriana, o cuando ficolinas se unen a monosacridos modificados. Ambas molculas activan un complejo enzimtico compuesto por las serin-proteasas (MASP1,MASP2), que dividen a C4 y C2 de forma similar a la va clsica, formando similar convertasa de C3 que dividir C3. VA COMN C3b es clave en la accin del sistema del complemento, se une a las distintas convertasas de C3 (C4bC2a Va clsica y de lectina; y C3bBb en la va alterna) para formar la convertasa de C5. Esta fragmenta a C5 en C5a y C5b. Y aqu inicia la fase citoltica ya que C5b se une a la membrana bacteriana, liga a C6, este a su vez a C7, C8 y un complejo de 10 a 16 molculas de C9. Se forma as un polmero el complejo de ataque de membrana o MAC - que perfora la membrana celular y ocasiona el estallido o lisis celular. (La clula ya no es capaz de mantener su concentracin hiperosmolar por disrupcin en la continuidad de su membrana). Los fragmentos restantes C5a, C3a y C4a son, en orden descendente de mayor potencia, anafilotoxinas y cumplen en distinto grado funciones como: quimiotaxis y activacin de leucocitos y mastocitos.
DIAGNSTICO DE ALTERACIONES DEL SISTEMA DEL COMPLEMENTO Para evaluar el sistema del complemento se realizan pruebas cualitativas y cuantitativas. Su utilidad est en la inmunologa clnica, ya que permiten detectar deficiencias en factores del complemento (por baja sntesis o sntesis defectuosas), adems de anomalas funcionales en las vas de activacin y regulacin. El anlisis del sistema del complemento se realiza en el marco de varias entidades clnicas, entre ellas: Lupus eritematoso sistmico, artritis autoinmune, angioedema, sndromes de vasculitis, nefritis, infecciones recurrentes. Recientemente incluso se ha implicado al anlisis del complemento en desrdenes neurodegenerativos como el Alzheimer, esclerosis mltiple, Guillain-Barr. Las pruebas cuantitativas, usualmente analizan las concentraciones de componentes especficos del complemento e incluyen ensayos inmunoqumicos. Las pruebas cualitativas o ensayos funcionales miden la actividad total del complemento (lisis) en las distintas vas de activacin. Las pruebas que producen hemlisis dan una perspectiva de la funcin de la cascada enzimtica completa del complemento. Una de ellas es la capacidad hemoltica 50 (CH50) del complemento. Tambin se han desarrollado otros mtodos que utilizan los ensayos de inmunoabsorbancia asociados a enzimas (ELISA) para detectar el depsito de C1q, C1s, C4, C3, factor B, protena de unin a C4b, properdina y todos los componentes terminales del complemento en la superficie plstica de un micro pocillo despus de la activacin srica. VI. FUNDAMENTO DE LA PRCTICA INMUNOHEMOLISIS (CH50) POR LA VIA CLASICA La tcnica CH50 o capacidad hemoltica del complemento mide la habilidad del suero del paciente para lisar (destruir) 50% de una suspensin de eritrocitos cubiertos con anticuerpos, es decir valora la integridad de activacin del complemento, en este caso por la va clsica. A pesar de que se han descrito muchas variantes el protocolo del ensayo por inmunohemlisis conserva su base conceptual: realizar diluciones de la muestra a ser analizada, propiciar una reaccin antgeno-anticuerpo y medir la respuesta. Se denomina CH50 cuando se busca producir la lisis del 50% de eritrocitos y CH100 cuando se lisa el 100%, en esta prctica nos basaremos en este principio. Para evaluar la va alternativa se bloquea las reacciones enzimticas al aadir EDTA para quelar el calcio. La hemlisis inducida por la activacin del complemento sobre antgenos de un grupo sanguneo que han sido reconocidos por anticuerpos correspondientes (Ej, antgeno A con anticuerpo anti A), se presentar proporcionalmente a la concentracin de componentes del complemento. El mtodo CH50 utiliza distintas diluciones para determinar la cantidad de complemento necesaria para producir la lisis del 50% de eritrocitos. Este tipo de lisis, mediada por el complemento se denomina inmunohemlisis y refleja la integridad funcional de los 9 componentes del sistema de la va clsica. Si en estos existiera un dficit, la cadena enzimtica no se activara correctamente y habra ausencia de inmunohemlisis. El CH50 en esta prctica se realizar activando la Va Clsica del complemento. El concepto es muy parecido a lo que ocurre en una enfermedad hemoltica de tipo transfusional, en donde eritrocitos de un grupo sanguneo son puestos en contacto con suero de distinto grupo sanguneo (que contiene anticuerpos), para formar de esta manera inmunocomplejos. Se coloca luego suero humano que contiene las protenas del complemento (protegido del calor, recordar que el complemento es termolbil) y se observa la activacin de la va clsica y hemlisis subsecuente. La magnitud de la inmunohemlisis se puede determinar a simple vista o medirse por espectofotometra, expresndose como porcentaje de hemlisis. Hemlisis menores de 50% indican deficiencia del complemento, pero no permite determinar qu componente es el que est deficitario.
VII. MATERIALES: Extraccin sangunea 3 jeringuillas de 10 ml Torundas de algodn con alcohol Torniquete INMUNOHEMOLISIS 3 tubos de 10 ml sin anticoagulante Buffer fosfato salino (PBS) 1 tubo de 10ml con anticoagulante Micropipetas de 20l, 100l y 1000 l Sistema de enfriamiento (hielo) Centrfuga, Bao mara
VIII. PROCEDIMIENTO 1. Extraer 10 ml de sangre tipo 0 de dos individuos, sin tomar en cuenta el factor Rh, y colocar en 2 tubos sin anticoagulante. 2. Extraer 10 ml de sangre de un individuo de grupo sanguneo A o B. Colocar 7ml en un tubo con anticoagulante 3. Centrifugar todas las muestras a 3000 r.p.m. (revoluciones por minuto) durante 10 minutos 4. Extraer el suero de los tubos con sangre O y someterlo al proceso de descomplementacin: calentar el suero 55C por 15 20 minutos. Descartar el paquete globular. NOTA: esta temperatura desnaturaliza las protenas del complemento pero no los anticuerpos. 5. Separar el plasma de los tubos con sangre del grupo A B y guardarlo en refrigeracin para proteger las protenas del complemento de su condicin termolbil y guardar los eritrocitos. 6. Realizar el lavado de los eritrocitos con PBS: a. Aadir 5 cc. de PBS al paquete eritrocitario y centrifugar a 1500 r.p.m. por 10 minutos . b. Retirar el sobrenadante y repetir el paso por 2 veces ms. 7. Una vez lavados los eritrocitos realizar una dilucin al 2% de eritrocitos para dispensar 1000l en cada uno de los 5 tubos del ensayo. Clculo: Preparar 6000 L de solucin de eritrocitos al 2% (siempre se prepara un poco ms de lo necesario) ___________________________________________________________________ 2l 100L X 6000L
X= 6000 L x 2 L 100 L X= 120 L SOLUCIN DE ERITROCITOS AL 2% Tomar 120l de eritrocitos lavados + 5880 l de Na Cl al 0.9% como disolvente. ___________________________________________________________________ 8. Colocar 1000l de solucin de eritrocitos al 2% en cada uno de los 5 tubos y rotularlos. 9. Aadir 500l de suero O descomplementado desde el tubo N1 hasta el N4. En el tubo nmero 5 se coloca 3ml de agua destilada en lugar de suero O. 10. Los tubos se llevan a Bao Mara a 37C por 20 minutos (temperatura fisiolgica) 11. A la preparacin incubada agregar el suero A B que contiene las protenas del complemento de acuerdo al siguiente esquema:
REACTIVO/TUBO
CONTROL (-) 1
TITULACIONES (complemento) 1:02 1:01 2 3
CONTROL 2:01 4 (+) 5
Eritrocitos 2% (grupo A o B) en NaCl 0.9% ANTIGENOS Suero O ANTICUERPOS SIN COMPLEMENTO Suero A COMPLEMENTO Agua Destilada
1000l
1000l
1000l
1000l
1000l
500l
500l
500l
500l
250 l -
500 l -
1000l -
3000 l
12. Incubar los tubos por 20 minutos ms. 13. Luego de la incubacin, centrifugar todos los tubos a 1500 r.p.m. con el fin de sedimentar los restos de eritrocitos y los eritrocitos no hemolisados. 14. Observar la coloracin del sobrenadante de cada tubo. 15. Recoger el sobrenadante con una pipeta y en un espectrofotmetro medir la densidad ptica del sobrenadante de todos los tubos, construyendo una curva de porcentaje de hemlisis utilizando la siguiente frmula:
DOs: DOb: DOo:
Densidad ptica del sobrenadante de los tubos N2 A N4 Densidad ptica del control negativo (tubo N 1 ) Densidad ptica del control positivo (tubo N 5)
De acuerdo con esta curva, la concentracin de complemento necesario para producir 50% de hemlisis (con el control positivo como el 100%) constituye el CH50.
IX. TEMAS DE CONSULTA: Consulte el siguiente tema para que lo revise en el laboratorio junto con su ayudante: Cuadros clnicos asociados a alteraciones en la actividad total del complemento y de sus reguladores. IX. BIBLIOGRAFA ABBAS, A., Cellular and Molecular Immunology, 5th edition, Elsevier/Saunders, 2008, 564p, ISBN: 1-4160-2389-5. P326 330. ARENDRUP, M., HANSEN, J., CLAUSEN, H., NIELSEN, C., MATHIESEN, L., Antibody to histo-blood group A antigen neutralizes HIV produced by lymphocytes from blood group A donors but not from blood group B or O donors, AIDS, 4 4414. 6
BERGER, S., DAHA, M., Complement in glomerular injury, Semin Immunopathol, 2007, 29:375384. FAUCI, A., BRAUNWALD, E., KASPER, D., et al., Harrisons principles of internal medicine, 17th edition, McGrawHill, 2008, Vol. II, ISBN 978-0-07-147693-5 p- 2030- 2061 GABAY, C., Acute-phase proteins and other systemic response to inflammation, NEJM, 1999, 340-344-354 JANEWAY, C., TRAVERS, P., WALPORT, M., SHLOMCHIK, M., Immunobiology: the immune system in health and disease. 6th edition, Garland Science, 2005, 823p, ISBN 0 8153 4101 6. KIRSCHFINK, M., MOLLNES, T., Modern Complement Analysis, clinical and diagnostic laboratory immunology, 2003, Vol. 10, No. 6p. 982989 MACKAY I., ROSEN, F., Review article: Complement first of two parts, The New England Journal of Medicine., N Engl J Med, 2001, Vol 344, No. 14. P 1058 1066. MACKAY I., ROSEN, F., Review article: Complement second of two parts, The New England Journal of Medicine., N Engl J Med, 2001, Vol 344, No. 15. P 1140 1144. MEDZHITOV, R., JANEWAY, C., Advances in immunology: Innate immunity, NEJM, 2000, 343:338 44. NEIL, S., MCKNIGHT, A., GUSTAFSSON, K., WEISS, R., 2005, HIV-1 incorporates ABO histo-blood group antigens that sensitize virions to complement-mediated inactivation, Blood, 105, 12: 46939. SAVVAS, C., Therapeutic inhibition of the complement system, PRAECIS, pharmacological review, 1998, 50: 59-87. SIMPSON, S., A Bacterial Anticomplement, Nat. Immunol, 2007, 10.1038/ni1450 SVETOMIR, N., Acquired C1 estearase inhibitor deficiency, Annals of Internal Medicine, 132, 2000, p144-55. Crispin, J. Pathogenesis of human systemic lupus erythematosus: recent advances [Documento PDF]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2823952/pdf/nihms-169854.pdfCrow, M. Developments in the clinical understanding of lupus [Documento PDF]. Disponible en: http://arthritis-research.com/content/pdf/ar2762.pdf Enberg, M. Infecciones en pacientes con Lupus Eritematoso Sistmico [Documento PDF]. Disponible en: http://www.scielo.cl/pdf/rmc/v137n10/art14.pdf Snchez, S. Lupus eritematoso: enfermedad autoinmune sistmica y rgano especfica. [Documento PDF]. Disponible en: http://www.medigraphic.com/pdfs/revbio/bio-2004/bio043e.pdf Font, J. Lupus eritematoso sistmico [Documento PDF]. Disponible en: http://www.jano.es/ficheros/sumarios/1/65/1491/57/1v65n1491a13052760pdf001.pdf
ELABORACIN AYUDANTES DE CTEDRA DE INMUNOLOGA Paola Santacruz Ana Mara Zambrano Bertha Loaiza S. Christian Len Christian Rosero Gabriela Pesantez Nadia Montero Sebastin Paredes Vicente Huilca SUPERVISIN: Dr. Fernando Semprtegui Jefe de Ctedra.
Quito, Septiembre, 2011
S-ar putea să vă placă și
- AminoaciduriasDocument2 paginiAminoaciduriasNorma Candelaria MendozaÎncă nu există evaluări
- Determinacion de ColesterolDocument3 paginiDeterminacion de ColesterolJesús ReyesÎncă nu există evaluări
- Caso Clinico GeriatricoDocument4 paginiCaso Clinico GeriatricoPablo Cesar Soto100% (1)
- Sensibilidad Somatica 3 1222790501483926 8Document29 paginiSensibilidad Somatica 3 1222790501483926 8ajseals0% (1)
- Práctica de LeucogramaDocument7 paginiPráctica de LeucogramaAsael VzÎncă nu există evaluări
- Practica 8 AaDocument8 paginiPractica 8 AaBoris Milton Mamani IchutaÎncă nu există evaluări
- Perfil Lipidico Consulta 3Document3 paginiPerfil Lipidico Consulta 3Natalia GarciaÎncă nu există evaluări
- GlucosaDocument6 paginiGlucosaapoliman01Încă nu există evaluări
- Química Sanguínea y Biometría HemáticaDocument29 paginiQuímica Sanguínea y Biometría HemáticaNestor Santana100% (1)
- Furunculosis, Antrax, TBC Cutaneo, Lepra.......Document10 paginiFurunculosis, Antrax, TBC Cutaneo, Lepra.......BeTty CoLkeÎncă nu există evaluări
- Practica 2-b VDRLDocument7 paginiPractica 2-b VDRLAna Gabriela Fernandez MontenegroÎncă nu există evaluări
- FT Glucosa en Orina Benedict1Document2 paginiFT Glucosa en Orina Benedict1Alexander Gelves ParadaÎncă nu există evaluări
- Informe #3 - GGT y ALPDocument8 paginiInforme #3 - GGT y ALPKar BejaranoÎncă nu există evaluări
- REFRACTOMETRIADocument6 paginiREFRACTOMETRIARita TrigosoÎncă nu există evaluări
- Nefelometria y TurbidimetriaDocument11 paginiNefelometria y TurbidimetriaStefany Fasce MonsalveÎncă nu există evaluări
- Tema 1. Soluciones y DilucionesDocument76 paginiTema 1. Soluciones y DilucionesNayra LeonÎncă nu există evaluări
- 6-Pruebas de Función RenalDocument37 pagini6-Pruebas de Función RenalDenia EstradaÎncă nu există evaluări
- Glucogeno Tipo V (Mcardie)Document12 paginiGlucogeno Tipo V (Mcardie)Edgar Omar Campos MartinezÎncă nu există evaluări
- Práctica FagocitosisDocument8 paginiPráctica FagocitosisBrenda VenancioÎncă nu există evaluări
- Cirrosis HepáticaDocument3 paginiCirrosis HepáticaOscar CarrilloÎncă nu există evaluări
- Guia 6. Propiedades de Aminoacidos y Proteinas - BQ1Document5 paginiGuia 6. Propiedades de Aminoacidos y Proteinas - BQ1EMMANUEL MADRO�EROÎncă nu există evaluări
- Alteración Del Metabolismo de La GlucosaDocument2 paginiAlteración Del Metabolismo de La GlucosaVincent Soriano50% (4)
- PH FecalDocument3 paginiPH FecalrellenodechileconcarÎncă nu există evaluări
- Libro BromatologiaDocument133 paginiLibro BromatologiaDelicia ColqueÎncă nu există evaluări
- Sindrome de KartagenerDocument4 paginiSindrome de KartagenerFernanda Pineda GeaÎncă nu există evaluări
- Trabajo de FarmacoDocument14 paginiTrabajo de FarmacoJonathan MurgaÎncă nu există evaluări
- Aportaciones de ShewartDocument2 paginiAportaciones de ShewartMichael Santiago SimbaÎncă nu există evaluări
- Prueba de La OptoquinaDocument1 paginăPrueba de La OptoquinaOscar Chuquiyauri PomacinoÎncă nu există evaluări
- Neumonia X Candida Sesion ClinicaDocument59 paginiNeumonia X Candida Sesion Clinicabetto50Încă nu există evaluări
- Generalidades GeneticaDocument3 paginiGeneralidades GeneticaDra Daniela TorresÎncă nu există evaluări
- Glu PapaDocument5 paginiGlu PapaDavid100% (1)
- Informe ListeriaDocument25 paginiInforme ListeriaBiancaRozasÎncă nu există evaluări
- Extracción de Lípidos PDFDocument3 paginiExtracción de Lípidos PDFchristianÎncă nu există evaluări
- Tabla 2 EtritrocitosDocument3 paginiTabla 2 EtritrocitosHERIBERTOÎncă nu există evaluări
- Errores Post Analítico en El Laboratorio ClínicoDocument1 paginăErrores Post Analítico en El Laboratorio ClínicoSmerlin Vasquez100% (1)
- Casos de Episodio Convulsivo y AnsiedadDocument6 paginiCasos de Episodio Convulsivo y AnsiedadDanielPerezÎncă nu există evaluări
- 5 Electroforesis de Proteínas en Acetato de Celulosa Proteínas SéricasDocument9 pagini5 Electroforesis de Proteínas en Acetato de Celulosa Proteínas SéricasKath RodríguezÎncă nu există evaluări
- PRACTICA 2 Curva de Tolerancia A La GlucosaDocument6 paginiPRACTICA 2 Curva de Tolerancia A La GlucosaalexisÎncă nu există evaluări
- Practica Fosfatasa y ProteinaDocument11 paginiPractica Fosfatasa y ProteinaFernanda YañezÎncă nu există evaluări
- Procedimiento Toma de MuestrasDocument24 paginiProcedimiento Toma de MuestrasEdson Duvan Ramos SantacruzÎncă nu există evaluări
- MEtabolismo BasalDocument5 paginiMEtabolismo BasalAlfredo Leon AlayoÎncă nu există evaluări
- Identificacion de BiomoleculasDocument11 paginiIdentificacion de BiomoleculasDiego Giraldo BoteroÎncă nu există evaluări
- Hipernatremia en PCT CriticoDocument8 paginiHipernatremia en PCT CriticoRichard BravoÎncă nu există evaluări
- 2018-CL2-Análisis Cuantitativo de CarbohidratosDocument19 pagini2018-CL2-Análisis Cuantitativo de CarbohidratosDanielaÎncă nu există evaluări
- FarmacologiaDocument11 paginiFarmacologiaDaniela ElejaldeÎncă nu există evaluări
- CiclosporosisDocument14 paginiCiclosporosisDalia CLÎncă nu există evaluări
- Practica N2 Tincion GramDocument5 paginiPractica N2 Tincion GramBM-yesica So Jin KpopÎncă nu există evaluări
- Determinación Cuantitativa de Got y GPTDocument5 paginiDeterminación Cuantitativa de Got y GPThenyÎncă nu există evaluări
- PRÁCTICA #08 EnzimasDocument6 paginiPRÁCTICA #08 Enzimasjimmy gomezÎncă nu există evaluări
- Evaluacion Analitica Del Metabolismo de Carbohidratos: Tecnólogo Médico Esp. Laboratorio Clínico y Anatomía PatológicaDocument64 paginiEvaluacion Analitica Del Metabolismo de Carbohidratos: Tecnólogo Médico Esp. Laboratorio Clínico y Anatomía Patológicavalentinatay100% (1)
- 10 Clase Impregnaciones ArgénticasDocument32 pagini10 Clase Impregnaciones ArgénticasJeanette Cristina Herrera CadenasÎncă nu există evaluări
- Cuantificacion ADNDocument7 paginiCuantificacion ADNMario Rangel50% (2)
- Práctica #7 Consumo de Glucosa X LevadurasDocument4 paginiPráctica #7 Consumo de Glucosa X LevadurasDayanna MendozaÎncă nu există evaluări
- CARAMELIZACIONDocument1 paginăCARAMELIZACIONMarco JuniorÎncă nu există evaluări
- VENADO Enfermedades Del VenadoDocument14 paginiVENADO Enfermedades Del VenadoJaime Coronilla100% (1)
- Nom 010 STPS 1999Document24 paginiNom 010 STPS 1999jr7@Încă nu există evaluări
- Análisis de La LecheDocument21 paginiAnálisis de La LecheAlejandro Flores100% (1)
- .Sistema de Complemento .Document11 pagini.Sistema de Complemento .Janacua Figueroa DianaÎncă nu există evaluări
- Sistema de ComplementoDocument9 paginiSistema de ComplementoLauraCarolinaRestrepoÎncă nu există evaluări
- Sistema de ComplementoDocument17 paginiSistema de ComplementoCarlosErazoÎncă nu există evaluări
- Prueba N°4 Sistema NerviosoDocument4 paginiPrueba N°4 Sistema NerviosoSandra García HernándezÎncă nu există evaluări
- Aplicacion Primer GradoDocument55 paginiAplicacion Primer Gradojessy217Încă nu există evaluări
- El Sistema ExcretorDocument2 paginiEl Sistema ExcretorYatzhury Yamileh Cruice HansÎncă nu există evaluări
- Naturales 03 CirculatorioDocument5 paginiNaturales 03 CirculatorioFlavia BruggerÎncă nu există evaluări
- Triptico El Cuerpo HumanoDocument2 paginiTriptico El Cuerpo HumanoGirnalda Torres Guillén100% (2)
- HEMOSTASIADocument35 paginiHEMOSTASIAmedun2009100% (4)
- Practica de Grupos SanguineosDocument5 paginiPractica de Grupos SanguineosGonzalo Puertas VargasÎncă nu există evaluări
- ATV Apuntes Modulo 2 Parte IDocument107 paginiATV Apuntes Modulo 2 Parte IStefan StanÎncă nu există evaluări
- Sistema LinfáticoDocument16 paginiSistema LinfáticoJASBLEEDY DAYANA BONILLAÎncă nu există evaluări
- Aparato RespiratorioDocument4 paginiAparato RespiratorioWoatma WoatmaÎncă nu există evaluări
- Sistema LinfáticoDocument21 paginiSistema LinfáticoHector Jesús Mejias Monasterios100% (1)
- Aparato Respiratorio-Gabriela Vera AcostaDocument22 paginiAparato Respiratorio-Gabriela Vera AcostaGabriela AcostaÎncă nu există evaluări
- Semiología Del X Par CranealDocument6 paginiSemiología Del X Par CranealMichelle GomezÎncă nu există evaluări
- Fisioterapia PulmonarDocument45 paginiFisioterapia PulmonarValeria Zausa100% (2)
- Tema 06. Ej - RespiratorioDocument4 paginiTema 06. Ej - Respiratorioalejandracostafernandez77Încă nu există evaluări
- Perri Noemi Haydee: Paciente: IamaDocument2 paginiPerri Noemi Haydee: Paciente: IamaDiego GargiuloÎncă nu există evaluări
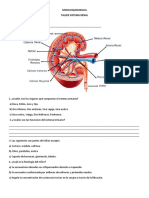
- Taller Sistema RenalDocument5 paginiTaller Sistema RenalSofy morenoÎncă nu există evaluări
- Circulación AnimalDocument2 paginiCirculación AnimalMartaSoledadRamosGuillenÎncă nu există evaluări
- ANATOMÍA - PreuniversitarioDocument8 paginiANATOMÍA - PreuniversitarioJenrry Pariona83% (6)
- Medula Espinal Mapa de MorfofisiologiaDocument1 paginăMedula Espinal Mapa de MorfofisiologiaAngel Daniel DominguezÎncă nu există evaluări
- Fisioterapia Respira 197798 Downloadable 255864Document9 paginiFisioterapia Respira 197798 Downloadable 255864yessenia chiuntiÎncă nu există evaluări
- Anatomia y Fisiologia HumanaDocument11 paginiAnatomia y Fisiologia HumanaJesus RevillaÎncă nu există evaluări
- ZJ 3 RO21 O2 e 76 L 9 V I0 Eixs O1 D Af 9 XFV183133Document1 paginăZJ 3 RO21 O2 e 76 L 9 V I0 Eixs O1 D Af 9 XFV183133Yajaira Castro ReinosoÎncă nu există evaluări
- Características Fisiológicas de Los PesesDocument14 paginiCaracterísticas Fisiológicas de Los PesesAni Patricia Dl RosarioÎncă nu există evaluări
- Tejido SanguíneoDocument11 paginiTejido SanguíneoVivis GonzalezÎncă nu există evaluări
- FZ 070301Document25 paginiFZ 070301carlos diegoÎncă nu există evaluări
- Protocolo de HemorragiasDocument23 paginiProtocolo de HemorragiasJefferson Alexiis MontañezÎncă nu există evaluări
- 01 Anatomia BasicaDocument4 pagini01 Anatomia BasicaYefferson Salinas100% (1)
- Taller de Circulación en El Ser Humano 2Document2 paginiTaller de Circulación en El Ser Humano 2Maicol Andres Medina0% (1)
- El Sistema CardiovascularDocument4 paginiEl Sistema CardiovascularCris PolancoÎncă nu există evaluări