Documente Academic
Documente Profesional
Documente Cultură
Revision de Termodinamica Fisico Quimica-Me211r
Încărcat de
Carlos Catalán CórdovaDescriere originală:
Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Revision de Termodinamica Fisico Quimica-Me211r
Încărcat de
Carlos Catalán CórdovaDrepturi de autor:
Formate disponibile
UNIVERSIDAD NACIONAL DE INGENIERIA
FACULTAD DE INGENIERIA GEOLOGICA MINERA Y
METALURGICA
REVISION DE TERMODINAMICA
FISICO QUIMICA
ESCUELA DE METALURGIA
Funciones de Trayectoria
Las que su valor depende del camino seguido.
0 W d W
W d W
i ciclo
2
1
i
= =
=
}
}
No son diferenciales exactas, su derivada cclica
es diferente de cero.
Pueden ser Variables Extensivas o Intensivas.
El Trabajo y el Calor son Funciones de
Trayectoria.
0 Q d Q
Q d Q
i ciclo
2
1
i
= =
=
}
}
Funciones de Estado
Las que tienen el mismo valor inicial y final no
importando el camino recorrido.
}
}
= = A
= A
0 dE E
dE E
ciclo
E
E
2
1
Son diferenciales exactas, su integral cclica es
igual a cero.
Son Variables Extensivas o Intensivas.
Son: T, V, P, E, H, S, G, n, Cp, o, |, ........etc.
Estado) de Funcin (X
0 dX X
dX X
ciclo
2
1
=
= =
=
}
}
Diferenciales Cruzadas
dy y) N(x, dx y) M(x, df
y
f
y) N(x, ;
x
f
y) M(x, : Si
dy
y
f
dx
x
f
df
total l Diferencia
y) f(x, f
x
y
x
y
+ =
|
|
.
|
\
|
c
c
=
|
.
|
\
|
c
c
=
|
|
.
|
\
|
c
c
+
|
.
|
\
|
c
c
=
=
Diferenciales Cruzadas
cruzadas) Derivadas (
x
N
y
M
y x
f
x y
f
: iguales son 2 des posibilida 4 estas De
y
f
;
y x
f
;
x y
f
;
x
f
: son des posibilida diversas las
y) f(x, de Derivada segunda la Para
y
x
2 2
2
2 2 2
2
2
|
.
|
\
|
c
c
=
|
|
.
|
\
|
c
c
c c
c
=
c c
c
c
c
c c
c
c c
c
c
c
Diferenciales Cruzadas
|
.
|
\
|
c
c
=
|
|
.
|
\
|
c
c
+ =
x
N
y
M
dy N dx M df
: Resumiendo
Si se cumple la igualdad son diferenciales exactas.
Si no se cumple la igualdad son diferenciales
inexactas.
Regla Cclica de Derivacin
0 y) (
y
Z
x) (
x
Z
dZ
0 dZ
constante permanece y varia no Z Si
dy
y
Z
dx
x
Z
dZ
: ser total l diferencia La
y) f(x, Z Si
Z
x
Z
y
x
y
= c
|
|
.
|
\
|
c
c
+ c
|
.
|
\
|
c
c
=
=
|
|
.
|
\
|
c
c
+
|
.
|
\
|
c
c
=
=
Regla Cclica de Derivacin
1 -
x
Z
Z
y
y
x
0 1
Z
y
y
x
x
Z
Z
y
: por ndo Multiplica
0
y
Z
y
x
x
Z
y) ( : entre Dividiendo
y x
Z
x
Z
y
x
x Z
y
Z
=
|
.
|
\
|
c
c
|
.
|
\
|
c
c
|
|
.
|
\
|
c
c
= +
|
.
|
\
|
c
c
|
|
.
|
\
|
c
c
|
.
|
\
|
c
c
|
.
|
\
|
c
c
=
|
|
.
|
\
|
c
c
+
|
|
.
|
\
|
c
c
|
.
|
\
|
c
c
c
Ecuaciones Fundamentales De la
Termodinmica
Las Variables fundamentales son: P, V, T, E, S
Las Variables Compuestas son: H, A, G
De la combinacin de la 1ra Ley y 2da Ley de la
Termodinmica se deduce, la primera Ecuacin
Fundamental.
dS=dQ
rev
/ T(a) (2da Ley)
dQ
rev
= dE + p dV(b) (1ra Ley)
(b) Dividiendo entre T se tiene:
(a) En (c):
Por definicin de las propiedades compuestas:
dQ
rev
/ T =(1/T) dE +(p/T) dV(c)
H = E + pV; A = E TS ; G = E + Pv- TS
dS =(1/T) dE +(p/T) dV
dE =T dS - pdV(I) (1ra. Ecuacin Fundamental)
Diferenciando:
dH = dE + p dV + V dp .(1)
(I) En (1)
dA = dE T dS S dT .(2)
dG = dE +p dV + V dp T dS S dT .(3)
dH = T dS - pdV + p dV + V dp
dH = T dS + V dp (II) (2da Ec. Fundamental)
(I) En (2)
dA = T dS - pdV T dS S dT
dA = S dT pdV (III)
dG = T dS - pdV +p dV + V dp T dS S dT
dG = S dT + V dp(IV)
dE = T dS - pdV..(I)
dH = T dS + V dp (II)
dA = S dT pdV .(III)
dG = S dT + V dp(IV)
En Resumen la Ecuaciones Fundamentales De la
Termodinamica son:
Relaciones de Maxwell
Las Ecuaciones fundamentales son diferenciales
exactas por lo que sus derivadas cruzadas sern
iguales.
P T
V T
P S
V S
T
V
P
S
(IV) Fund. Ec.
T
P
V
S
(III) Fund. Ec.
S
V
P
T
(II) Fund. Ec.
S
P
V
T
(I) Fund. Ec.
|
.
|
\
|
c
c
=
|
.
|
\
|
c
c
|
.
|
\
|
c
c
=
|
.
|
\
|
c
c
|
.
|
\
|
c
c
=
|
.
|
\
|
c
c
|
.
|
\
|
c
c
=
|
.
|
\
|
c
c
Energa
Energa Total (U) = Energa interna + energa
cintica macroscpica +
Energa macroscpica potencial
Energa Interna (E).- Es la energa que posee un
sistema como una consecuencia de las interacciones
de sus tomos (energa qumica) y al movimiento
aleatorio de sus molculas (energa trmica).
W - q E = A
Entalpa (H)
p
p
T
H
C
|
.
|
\
|
c
c
=
H = E + PV (Definicin)
A p = cte
AH = AE + pAV
AH = q
Capacidad calorfica o Calor especfico a p= cte
Capacidad calorfica o Calor especfico a V= cte
V
V
T
E
C
|
.
|
\
|
c
c
=
Sin embargo podemos consignar tablas de
entalpa versus temperatura que se ajustan para
un amplio rango de presiones.
La entalpa es independiente de la presin para
un gas ideal; esto es solo aproximadamente cierto
para gases reales, slidos y lquidos.
Calor Estndar de formacin.- es el incremento
de la entalpa del sistema cuando una unidad de
masa (o una mol) de un compuesto se forma a
partir de sus elementos estando los componentes
en el estado standar.( 1 atm. De presin en su fase
ms estable a una temperatura de 25 C.
AHf es cero para los elementos.
Calor Estndar de Reaccin.- es el incremento de
la entalpa del sistema cuando una reaccin
qumica se desarrolla cuando tanto reactantes
como productos estn al estado estndar.
AH
R
calor de Reaccin.
f
o
reactantes
i
f
o
productos
i
o
R
H x - H x H A A = A
v v
Cambio Reversible.- cuando el sistema durante
un ciclo, regresa a sus condiciones iniciales. El
sistema realiza un trabajo mximo en los
alrededores.
Cambios irreversibles y
reversibles
Cambio Irreversible.- cuando el sistema durante
un ciclo, no regresa a sus condiciones iniciales.
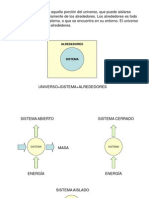
Sistema aislado.- cuando el sistema no tiene
intercambio de calor ni de materia con los
alrededores.
Proceso Espontneo.- cuando el sistema aislado se
produce un cambio irreversible.
Durante el cambio espontneo (cambio
irreversible en un sistema aislado) el sistema
incrementa su entropa.
Entropa
Cuando un sistema aislado sufre un cambio
reversible no incrementa su entropa; la entropa
solamente se transfiere de un lugar a otro en el
mismo sistema.
Si un incremento de entropa ocurre en un
sistema aislado durante un cambio se le puede
considerar como una medida de la
irreversibilidad del cambio.
Para un sistema no aislado: la entropa es una
funcin de estado parcialmente definida por:
Entropa
Donde dS es el incremento (diferencial) en
entropa resultante de una adicin (diferencial) de
calor dq reversible al sistema a la temperatura T.
Rev
T
dq
dS
|
.
|
\
|
=
Cuando no hay un Cambio de Fases la adicin de
calor dq a p constante, simplemente resulta en
un incrmento de temperatura dT, obtenido a
partir de Cp dT = dq
Entropa
}
= = A
f
o
T
T
p
i
_
f
_ _
T
dT C
S - S S
Cuando hay un Cambio de Fases
Entropa
}
A
+ + =
fase de Cambios
PC
PC
T
0
p
o
_ _
T
H
T
dT C
S S
fase. de cambio del K) ( ra temperatu T
masa) de unidad (por fase de cambio de latente) (calor entalpa H
K) por masa de unidad por (entalpia especfico Calor C
puro) cristal es si (cero K 0 a S S
masa de unidad por entropa S
PC
PC
p
_
o
_
_
=
= A
=
=
=
Definicin: G = E + PV TS = H -TS
Energa Libre de Gibbs (G)
Un sistema sufre una cambio cuando su energa
interna decrece (- AE). El trabajo til reversible que
se puede obtener con este cambio a P y T constantes,
ser igual a la reduccin en G.
S T - H G A A = A
Equilibrio
Para un sistema cerrado sin reacciones a
dP S VdT dG
S -
P
G
y V
T
G
dP
P
G
dT
T
G
dG
T P
T P
=
=
|
.
|
\
|
c
c
=
|
.
|
\
|
c
c
|
.
|
\
|
c
c
+
|
.
|
\
|
c
c
=
Equilibrio
Para un sistema de composicin variable
i
n P,
i
2
n P,
2
1
n P,
1
n ,...., n , n T, n ,...., n , n P,
dn
n
G
...... dn
n
G
dn
n
G
dP
P
G
dT
T
G
dG
j j j
i 2 1 i 2 1
|
|
.
|
\
|
c
c
+ +
|
|
.
|
\
|
c
c
+
|
|
.
|
\
|
c
c
+
|
.
|
\
|
c
c
+
|
.
|
\
|
c
c
=
V
P
G
y S -
T
G
i i
n T, n P,
=
|
.
|
\
|
c
c
=
|
.
|
\
|
c
c
Equilibrio
Para un sistema de composicin variable
=
|
|
.
|
\
|
c
c
+ + =
i
1 i
i
n T, P,
i
dn
n
G
VdP SdT - dG
j
Potencial Qumico ( )
i
es el potencial qumico
j
n T, P,
i
i
n
G
|
|
.
|
\
|
c
c
=
=
+ + =
i
1 i
i i
dn VdP SdT - dG
Potencial Qumico ( )
Para un sistema cerrado a temperatura y presin
constante se tiene:
=
=
i
1 i
i i
dn dG
Para el Equilibrio
0 dn dG
i
1 i
i i
= =
=
Potencial Qumico ( )
La Energa libre para una reaccin se puede
calcular en funcin de los potenciales qumicos:
(P) Productos (R) Reactantes
.... pP nN mM ... cC bB aA + + + + + +
..... c b a - ......... p n m G
C B A P N M
+ + + = A
= A
R
R R
P
P P
G v v
Potencial Qumico Gases Ideales
El potencial qumico de un gas ideal puro esta
dado por la relacin:
p ln RT (T)
o
+ =
El potencial qumico de un gas ideal en una
mezcla de gases ideales por la relacin:
i
o
i i
p ln RT (T) + =
Equilibrio Qumico en una Mezcla
de Gases Ideales
(P) Productos (R) Reactantes
.... pP nN mM ... cC bB aA + + + + + +
i
o
i i
p ln RT (T) + =
..... p bRTln b p aRTln a
.... p nRTln n p mRTln m G
B
B
o
A A
A
o
N
N
o
M
M
o
+ + + = A
..... p bRTln b p aRTln a
.... p nRTln n p mRTln m G
B
B
o
A A
A
o
N
N
o
M
M
o
+ + + = A
Equilibrio Qumico en una Mezcla
de Gases Ideales
..... p bRTln p aRTln .... p nRTln p mRTln
...) b a ..... n m ( G
B A A N M
B
o
A
o
N
o
M
o
+
+ + + = A
....... p . p
..... . p . p
ln RT G G
b
B
a
A
n
N
m
M
o
+ A = A
Q ln RT G G
o
+ A = A
Equilibrio Qumico en una Mezcla
de Gases Ideales
0
....... ) p .( ) (p
..... . ) p .( ) (p
ln RT G G
e
b
B e
a
A
e
n
N e
m
M
o
= + A = A
....... ) p .( ) (p
..... . ) p .( ) (p
K
e
b
B e
a
A
e
n
N e
m
M
p
=
Kp = Constante de Equilibrio de presin
Equilibrio Qumico en una Mezcla
de Gases Ideales
p
o
K ln RT G = A
v A
+ +
=
=
=
P) ( K K
....... x . x
..... . x . x
K
P) (
....... p . x
..... . x . x
K
x p
b
B
a
A
n
N
m
M
x
-...... b - a - ..... n m
b
B
a
A
n
N
m
M
p
p
i
= x
i
P reemplazando en K
p
se tiene:
Equilibrio Qumico en una Mezcla
de Gases Ideales
v A
+ +
=
=
=
RT) ( K K
....... C . C
..... . C . C
K
RT) (
....... C . C
..... . C . C
K
C p
b
B
a
A
n
N
m
M
C
-...... b - a - ..... n m
b
B
a
A
n
N
m
M
p
Para Gases ideales p
i
= C
i
RT reemplazando en K
p
se tiene:
S-ar putea să vă placă și
- Formulario TermodinamicaDocument11 paginiFormulario TermodinamicaJeivan Alejandro Morales SerranoÎncă nu există evaluări
- Cap 1 Fundamentos Del EquilibrioDocument39 paginiCap 1 Fundamentos Del EquilibrioPlaymovie Bush100% (1)
- Segundo Principio TermodinamicoDocument12 paginiSegundo Principio TermodinamicoJose Severiano Luis Bravo Mora. Ph.D.Încă nu există evaluări
- Equilibrio MaterialDocument35 paginiEquilibrio MaterialAlexandra Carvajal100% (1)
- Termodinámica Las SolucionesDocument21 paginiTermodinámica Las SolucionesEl Angel CortezÎncă nu există evaluări
- Lab 1 CuestionarioDocument7 paginiLab 1 CuestionarioShakira LaricoÎncă nu există evaluări
- Chuleta Term oDocument3 paginiChuleta Term oalex6gg0% (1)
- Balance de EnergíaDocument20 paginiBalance de EnergíaEric HansenÎncă nu există evaluări
- Termoquimica EjemploDocument44 paginiTermoquimica EjemploCarolina Tejada GomezÎncă nu există evaluări
- Criterio de Equilibrio Sistemas Con Reacciones SimplesDocument18 paginiCriterio de Equilibrio Sistemas Con Reacciones SimplesMario FloresÎncă nu există evaluări
- Equilibrio Material y QuimicoDocument77 paginiEquilibrio Material y Quimicogenesis gonzalezÎncă nu există evaluări
- Energía LibreDocument35 paginiEnergía Librechio_garcia_2Încă nu există evaluări
- Segunda Ley de La Termodinámica - VirDocument9 paginiSegunda Ley de La Termodinámica - VirJuan Pablo IngrassiaÎncă nu există evaluări
- Repaso de TermodinamicaDocument32 paginiRepaso de Termodinamicajaviel999Încă nu există evaluări
- Chuletario de Termodinámica.Document3 paginiChuletario de Termodinámica.ap0cal1pse100% (1)
- Formulario de Termodinámica.Document5 paginiFormulario de Termodinámica.AbrahanguerraÎncă nu există evaluări
- Resumen de Ecuaciones - Unidad 3Document8 paginiResumen de Ecuaciones - Unidad 3Rocio BedogniÎncă nu există evaluări
- Clase 1 (Dr. Ponce) - Fisicoquímica IIDocument14 paginiClase 1 (Dr. Ponce) - Fisicoquímica IIWilliam EspinozaÎncă nu există evaluări
- Tema - 3 - Termodinámica QuímicaDocument44 paginiTema - 3 - Termodinámica QuímicaJose GutierrezÎncă nu există evaluări
- Balanceenergia 10356Document22 paginiBalanceenergia 10356Jugo AmenÎncă nu există evaluări
- Formulario TermodinamicaDocument2 paginiFormulario TermodinamicaRasLyon BlessÎncă nu există evaluări
- Expontaneidad y Equilibrio 14Document38 paginiExpontaneidad y Equilibrio 14Nathalie Marcos CespedesÎncă nu există evaluări
- Constante de Equilibrio QuimicoDocument8 paginiConstante de Equilibrio QuimicoCamila Natalia Zapata AlvaradoÎncă nu există evaluări
- Actividad5 FísicaDocument10 paginiActividad5 FísicaGema Sofía LagunaÎncă nu există evaluări
- Fórmulas TermodinámicaDocument3 paginiFórmulas TermodinámicaThiago OsorioÎncă nu există evaluări
- Sitemas PluricomponentesDocument35 paginiSitemas PluricomponentesNatalia MartínÎncă nu există evaluări
- Problema TermodinamicaDocument5 paginiProblema TermodinamicaCarlos CollinsÎncă nu există evaluări
- Tema 6 TermoquimicaDocument51 paginiTema 6 TermoquimicaJose Luis Gutierrez GonzalezÎncă nu există evaluări
- Problema de TermodinámicaDocument52 paginiProblema de TermodinámicaDonek SantanderÎncă nu există evaluări
- Sistema de MulticomponentesDocument25 paginiSistema de MulticomponentesJeffer LiviapomaÎncă nu există evaluări
- 8.0 Equilibrio TMDDocument8 pagini8.0 Equilibrio TMDCarlo Bastidas JaimesÎncă nu există evaluări
- Formulario BiofísicaDocument47 paginiFormulario BiofísicaJuan García MenéndezÎncă nu există evaluări
- SegundayTerceraLeyes 14269Document20 paginiSegundayTerceraLeyes 14269alejandra navarroÎncă nu există evaluări
- Tablas y Diagramas TermodinamicosDocument24 paginiTablas y Diagramas TermodinamicosJose SifontesÎncă nu există evaluări
- Clase7 Cap3 Potenciales Termodinámicos PDFDocument43 paginiClase7 Cap3 Potenciales Termodinámicos PDFDENNIS PABEL RAMIRO MAMANI SIMEONÎncă nu există evaluări
- Actividad Evaluativa Eje 2 - Aplicaciones de Las Ecuaciones Diferenciales - ForoDocument10 paginiActividad Evaluativa Eje 2 - Aplicaciones de Las Ecuaciones Diferenciales - ForoEsteban ToroÎncă nu există evaluări
- Apuntes de FisicoquimicaDocument89 paginiApuntes de FisicoquimicaJulian SoloÎncă nu există evaluări
- Balance de Energia Procesos No Reactivos PDFDocument56 paginiBalance de Energia Procesos No Reactivos PDFJuan Gonzalo RoseÎncă nu există evaluări
- Apuntes Teóricos TermoquímicaDocument23 paginiApuntes Teóricos TermoquímicaNahualaÎncă nu există evaluări
- Propiedadestermodinamicas 14534Document18 paginiPropiedadestermodinamicas 14534MASTER_SANDMANÎncă nu există evaluări
- UntitledDocument12 paginiUntitledNayeli GutierrezÎncă nu există evaluări
- Termodinámica - USMP - IX ClaseDocument50 paginiTermodinámica - USMP - IX ClaseAlonso Contreras Gastañadui100% (2)
- Formulario TERMOdinamicaDocument2 paginiFormulario TERMOdinamicaMario Alexis Quispe GutierrezÎncă nu există evaluări
- Seminario 1 - Primera Ley de La TermodinámicaDocument35 paginiSeminario 1 - Primera Ley de La TermodinámicaJaunleoÎncă nu există evaluări
- Equilibrio de FasesDocument52 paginiEquilibrio de FasesJorshinio Salazar CastilloÎncă nu există evaluări
- Procesos Fisicos de GasesDocument40 paginiProcesos Fisicos de GasesPaulina SantanaÎncă nu există evaluări
- Gradiente Conjugado Con EjemploDocument48 paginiGradiente Conjugado Con EjemploandresunÎncă nu există evaluări
- SESION 9-Termoquìmica.Document29 paginiSESION 9-Termoquìmica.Gabriel Armando Orellana NolascoÎncă nu există evaluări
- Ingeniería química. Soluciones a los problemas del tomo IDe la EverandIngeniería química. Soluciones a los problemas del tomo IÎncă nu există evaluări
- Ejercicios de Integrales y Ecuaciones Integrales-DiferencialesDe la EverandEjercicios de Integrales y Ecuaciones Integrales-DiferencialesÎncă nu există evaluări
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe la EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaÎncă nu există evaluări
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe la EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSEvaluare: 4.5 din 5 stele4.5/5 (7)
- Angulo Adecuado Entre La Manguera Fanel Y El Cordón DetonanteDocument33 paginiAngulo Adecuado Entre La Manguera Fanel Y El Cordón DetonanteCarlos Catalán CórdovaÎncă nu există evaluări
- Principales Reglas para Dividir Un YacimientoDocument4 paginiPrincipales Reglas para Dividir Un YacimientoCarlos Catalán CórdovaÎncă nu există evaluări
- AnatexiaDocument6 paginiAnatexiaCarlos Catalán CórdovaÎncă nu există evaluări
- Estimación Por Bloques 2015-IDocument21 paginiEstimación Por Bloques 2015-ICarlos Catalán CórdovaÎncă nu există evaluări
- Modelo de Falla Circular 5.0 Final Por Franklin ValerianoDocument35 paginiModelo de Falla Circular 5.0 Final Por Franklin ValerianoCarlos Catalán CórdovaÎncă nu există evaluări
- Pasado, Presente y Futuro de La ProducciónDocument39 paginiPasado, Presente y Futuro de La ProducciónCarlos Catalán CórdovaÎncă nu există evaluări
- Tunel SeikanDocument5 paginiTunel SeikanCarlos Catalán Córdova100% (1)
- Cantar de Mio CidDocument1 paginăCantar de Mio CidCarlos Catalán Córdova67% (3)
- La Oración Compuesta (Coordinada y Yuxtapuesta)Document4 paginiLa Oración Compuesta (Coordinada y Yuxtapuesta)Carlos Catalán CórdovaÎncă nu există evaluări
- Estudio Técnico Económico para La Ampliación de La Planta Concentradora de Minerales BerthaDocument22 paginiEstudio Técnico Económico para La Ampliación de La Planta Concentradora de Minerales BerthaCarlos Catalán CórdovaÎncă nu există evaluări
- Balance de Agua en Una Operación Minera SubterráneaDocument18 paginiBalance de Agua en Una Operación Minera SubterráneaCarlos Catalán CórdovaÎncă nu există evaluări
- Balance de Agua en Una Operación Minera SubterráneaDocument18 paginiBalance de Agua en Una Operación Minera SubterráneaCarlos Catalán CórdovaÎncă nu există evaluări
- Cinética de Reacción para El CobreDocument10 paginiCinética de Reacción para El CobreCarlos Catalán CórdovaÎncă nu există evaluări
- Equilibrio en Soluciones (Método Colorimétrico)Document18 paginiEquilibrio en Soluciones (Método Colorimétrico)Carlos Catalán CórdovaÎncă nu există evaluări
- Balance de Agua en Una Operación Minera SubterráneaDocument41 paginiBalance de Agua en Una Operación Minera SubterráneaCarlos Catalán Córdova0% (1)
- Trabajo de Kriging 3DDocument13 paginiTrabajo de Kriging 3DCarlos Catalán CórdovaÎncă nu există evaluări
- PDF Informe Quincenal Mineria Como Se Calcula El Valor de Los Concentrados de MineralesDocument10 paginiPDF Informe Quincenal Mineria Como Se Calcula El Valor de Los Concentrados de MineralesCarlos Catalán CórdovaÎncă nu există evaluări
- Geo1-Variograma Con Datos CompositadosDocument21 paginiGeo1-Variograma Con Datos CompositadosCarlos Catalán CórdovaÎncă nu există evaluări
- Capac SpectorDocument16 paginiCapac SpectorinzyÎncă nu există evaluări
- Balance General de Momento LinealDocument13 paginiBalance General de Momento LinealPedro Antonio Laos Pereyra0% (1)
- Sesion 04 de MayoDocument16 paginiSesion 04 de Mayoisis pinedoÎncă nu există evaluări
- Iv - Bim-Guia N09 - Descubrimos Fracciones EquivalentesDocument4 paginiIv - Bim-Guia N09 - Descubrimos Fracciones EquivalentesLizbeth AlayoÎncă nu există evaluări
- RMT2 PDFDocument10 paginiRMT2 PDFWalter HanccoÎncă nu există evaluări
- Análisis Causa RaízDocument94 paginiAnálisis Causa RaízAlfredo ZuñigaÎncă nu există evaluări
- Factores CaligraficoDocument9 paginiFactores CaligraficoOnesimo Julian Zotelo GarciaÎncă nu există evaluări
- Practica1 Calificada 2 - Estadistica - InferencialDocument5 paginiPractica1 Calificada 2 - Estadistica - InferencialSamantha De CárdenasÎncă nu există evaluări
- Perez Rosalia Resolviendo Rentas EquivalentesDocument4 paginiPerez Rosalia Resolviendo Rentas EquivalentesRosalia100% (4)
- Unidad 3 Cálculo Vectorial Funciones Vectoriales de Una Variable Real.Document32 paginiUnidad 3 Cálculo Vectorial Funciones Vectoriales de Una Variable Real.Jennifer Zazueta100% (1)
- Estudiante ASISTENCIADocument10 paginiEstudiante ASISTENCIAPAoo ENooÎncă nu există evaluări
- Trabajo Funciones y Sucesiones UnadDocument10 paginiTrabajo Funciones y Sucesiones UnadJohn Anderson Gomez CanizalesÎncă nu există evaluări
- Influencia de Agua Intersticial Sobre Macizos RocososDocument121 paginiInfluencia de Agua Intersticial Sobre Macizos RocososAngélica MartOrn100% (1)
- Teoria de Productos NotablesDocument1 paginăTeoria de Productos NotablesGean Del Piero P. Lozada100% (1)
- PORTAFOLIO DE EVIDENCIAS-SEGUNDO CICLO YaDocument29 paginiPORTAFOLIO DE EVIDENCIAS-SEGUNDO CICLO YaGLADIS ORBELINA SERRANO DE MORALESÎncă nu există evaluări
- Caracteristicas Dinamicas de Los Sistemas FisicosDocument16 paginiCaracteristicas Dinamicas de Los Sistemas Fisicosfrancisco laraÎncă nu există evaluări
- Actividad 1 1p 2qDocument2 paginiActividad 1 1p 2qjjiménez_339513Încă nu există evaluări
- Tarea 1 Esfuerzo y Deformación Simple TDocument6 paginiTarea 1 Esfuerzo y Deformación Simple TAdrián RodríguezÎncă nu există evaluări
- Actividades Matematica Primer Grado - Buscar Con Google PDFDocument1 paginăActividades Matematica Primer Grado - Buscar Con Google PDFRoman FigueirasÎncă nu există evaluări
- Cap6 GrafosDocument24 paginiCap6 GrafosMayling AguilarÎncă nu există evaluări
- DIODOSDocument6 paginiDIODOSafonseca5Încă nu există evaluări
- Distribución de ProbabilidadDocument5 paginiDistribución de ProbabilidadNORHAILISÎncă nu există evaluări
- Qué Es HipótesisDocument3 paginiQué Es HipótesisIESAMÎncă nu există evaluări
- 4°,5°sec Física-Tema2Document4 pagini4°,5°sec Física-Tema2VictorÎncă nu există evaluări
- Resumen Teoría - PHP PDFDocument45 paginiResumen Teoría - PHP PDFpuertasrojasÎncă nu există evaluări
- Equilibrio Liquido LiquidoDocument2 paginiEquilibrio Liquido Liquidozerachiel17Încă nu există evaluări
- Los Hoyos Negros y La Curvatura Del EspacioDocument2 paginiLos Hoyos Negros y La Curvatura Del EspacioKevinÎncă nu există evaluări
- Ficha de Trabajo 2 - Matemática - Números Enteros - 1ero de Secundaria - 2024Document5 paginiFicha de Trabajo 2 - Matemática - Números Enteros - 1ero de Secundaria - 2024a03259Încă nu există evaluări
- Colaborativo Matematicas Unidad 4 GFDocument11 paginiColaborativo Matematicas Unidad 4 GFKenia Johana SibajaÎncă nu există evaluări