Documente Academic
Documente Profesional
Documente Cultură
Termodinamica Proyecto Final
Încărcat de
Luna Hanabi0 evaluări0% au considerat acest document util (0 voturi)
24 vizualizări55 paginiDrepturi de autor
© © All Rights Reserved
Formate disponibile
PPT, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PPT, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
24 vizualizări55 paginiTermodinamica Proyecto Final
Încărcat de
Luna HanabiDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PPT, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 55
Instituto Politcnico Nacional
Escuela Superior de Ingeniera Qumica Industrial e Industrias
Extractivas
Nombre de la Profesora: Silvia Alejandra Gonzalez V.
Nombre de la Alumna: Rosa Patricia Garca Reyes
Materia: Termodinmica del Equilibrio Qumico
Grupo: 2IV50
Termodinmica del Equilibrio
Qumico
INTRODUCCION
Qu es la Termodinmica?
La rama de la fsica que hace foco en el estudio
de los vnculos existentes entre el calor y las
dems variedades de energa
Qu es el Equilibrio Qumico?
Es cuando el equilibrio qumico se establece
cuando existen dos reacciones opuestas que
tienen lugar simultneamente a la misma
velocidad
Variables Termodinmicas
Las variables que tienen relacin con el estado
interno de un sistema, y entre ellas las ms
importantes en el estudio de la termodinmica
son
Masa:Es una medida
de la cantidad de
materia que posee un
cuerpo
Volumen: Es una
magnitud fsica
extensiva que es
asociada a la
propiedad de los
cuerpos fsicos de ser
extensos o materiales.
Densidad: Es una
magnitud escalar referida
a la cantidad de masa
contenida en un
determinado volumen de
una sustancia
Presin: Es una
magnitud fsica que mide
como la proyeccin de la
fuerza en direccin
perpendicular por unidad
de superficie (esa
magnitud es escalar)
Temperatura: Es la medida de la energa
trmica de una sustancia
Criterios Termodinmicos y
Criterio de la Cintica
Qumica
Leyes de la Termodinmica
Primera ley de la termodinmica
Tambin conocido como principio de
conservacin de la energa para
la termodinmica, establece que si
se realiza trabajo sobre un
sistema o bien ste intercambia
calor con otro, la energa interna
del sistema cambiar. Visto de
otra forma, esta ley permite
definir el calor como la energa
necesaria que debe intercambiar
el sistema para compensar las
diferencias entre trabajo y energa
interna. Fue propuesta por
Antoine Lavoisier.
Segunda Ley de la Termodinmica
Impone restricciones para las transferencias de energa
que hipotticamente pudieran llevarse a cabo teniendo
en cuenta slo el primer principio. Esta ley apoya todo
su contenido aceptando la existencia de una magnitud
fsica llamada entropa, de tal manera que, para un
sistema aislado (que no intercambia materia ni energa
con su entorno), la variacin de la entropa siempre
debe ser mayor que cero.
Tercera Ley de la Termodinmica
Propuesta por Walther Nernst, afirma que es imposible alcanzar
una temperatura igual al cero absoluto mediante un nmero
finito de procesos fsicos. Puede formularse tambin como
que a medida que un sistema dado se aproxima al cero
absoluto, su entropa tiende a un valor constante especfico.
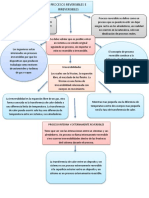
SISTEMAS
Un sistema termodinmico (tambin denominado sustancia de
trabajo) se define como la parte del universo objeto de
estudio
Los sistemas termodinmicos pueden ser aislados, cerrados o
abiertos.
Sistema aislado: Es aqul
que no intercambia ni
materia ni energa con los
alrededores.
Sistema cerrado: Es aqul
que intercambia energa
(calor y trabajo) pero no
materia con los
alrededores (su masa
permanece constante).
Sistema abierto: es aqul que intercambia energa
y materia con los alrededores.
En la siguiente figura se han representado los
distintos tipos de sistemas termodinmicos.
Qu es la Cintica Qumica?
Es la rama de la ciencia que estudia las
velocidades con que ocurren las reacciones.
Principales Factores que afectan la velocidad de
reaccin:
Concentracin de reactivos
Temperatura
Catalizador
rea Superficial
Coeficiente de Actividad y
Coeficiente de Fugacidad
Coeficiente de Actividad
El coeficiente de actividad es una medida del grado de
divergencia del comportamiento de la sustancia con
respecto al ideal.
La relacin entre la constante de equilibrio termodinmica,
Ko, y la de concentraciones, Kc, puede ponerse como:
Ko = Kc K
donde K es el producto de los coeficientes de actividad
elevados a los coeficientes estequiomtricos. Los
coeficientes de actividad varan de la unidad debido
principalmente a las diferentes fuerzas intermoleculares que
experimentan en la disolucin con respecto al estado de
referencia, por lo tanto cuando en la reaccin intervienen
especies cargadas, la discrepancia ser mayor.
Coeficiente de Fugacidad
El potencial qumico no puede ser expresado como una cantidad
absoluta, y los valores numricos del potencial qumico son
difciles de relacionar con cantidades fsicas ms comprensibles.
Ms an el potencial qumico se acerca a un valor infinito
negativo cuando la presin se acerca a cero. Por sta razn, el
potencial qumico no es de gran ayuda en los clculos de
equilibrio de fases. En lugar de ello, la fugacidad, inventada por
G. N. Lewis en1901, es empleada como sustituta.
La fugacidad parcial de la especie i ( i f ) en una mezcla es como
una pseudo- presin, de unidad en trminos del potencial
qumico
Reaccin Qumica y Energa
Libre de Gibbs, Minimizacion
de la Energa Libre de Gibbs
Qu es una reaccin qumica?
Es un proceso por el cual una o ms sustancias,
llamadas reactivos, se transforman en otra u
otras sustancias con propiedades diferentes,
llamadas productos.
En una reaccin qumica, los enlaces entre los
tomos que forman los reactivos se rompen.
Entonces, los tomos se reorganizan de otro
modo, formando nuevos enlaces y dando lugar a
una o ms sustancias diferentes a las iniciales.
Ecuacin Qumica
Para leer o escribir una ecuacin qumica, se deben seguir
las siguientes reglas:
*Las frmulas de los reactivos se escriben a la izquierda, y
las de los productos a la derecha, separadas ambas por
una flecha que indica el sentido de la reaccin
.
*A cada lado de la reaccin, es decir, a derecha y a izquierda
de la flecha, debe existir el mismo nmero de tomos de
cada elemento.
Cuando una ecuacin qumica cumple esta segunda regla, se
dice que est ajustada o equilibrada. Para equilibrar
reacciones qumicas, se ponen delante de las frmulas unos
nmeros llamados coeficientes, que indican el nmero
relativo de tomos y molculas que intervienen en la
reaccin.
Tipos de Reacciones
Reaccin de Sntesis: Elementos o compuestos sencillos que se
unen para formar un compuesto ms complejo. La siguiente es
la forma general que presentan este tipo de reacciones:
A+B AB
Reaccin de Descomposicin: Un compuesto se fragmenta en
elementos o compuestos ms sencillos. En este tipo de reaccin
un solo reactivo se convierte en zonas o productos
AB A+B
Reaccin Simple Sustitucin: Un elemento
reemplaza a otro en un compuesto
A + BC AC + B
Reaccin de doble desplazamiento: Los iones en
un compuesto cambian lugares con los iones de
otro compuesto para formar dos sustancias
diferentes.
AB + CD AD + BC
Energa Libre de Gibbs
La energa libre de Gibbs (G), se define como
aquella parte de la energa total de un sistema
que puede convertirse en trabajo en condiciones
isotrmicas.
Constante de Equilibrio y
Calculo a Partir de la Energa
Libre de Gibbs en Formacin
Constante de Equilibrio
La constante de equilibrio (K) se expresa como la
relacin entre las concentraciones molares
(mol/l) de reactivos y productos. Su valor en
una reaccin qumica depende de la
temperatura, por lo que sta siempre debe
especificarse. La expresin de una reaccin
genrica es:
Calculo Energa Libre de Gibbs
donde H es la entalpa o contenido de calor; T es la
temperatura y S es la entropa del sistema. Fue
desarrollada en los aos 1870 por el fsico-
matemtico estadounidense Williard Gibbs.
Cambios de energa libre estndar
La energa libre de reaccin, se denota, , es el cambio
de energa en una reaccin a condiciones estndares.
En esta reaccin los reactivos en su estado estndar
se convierten en productos en su estado estndar.
Dada la siguiente ecuacin qumica:
La energa libre se calcula como
Donde A y B son los reactivos en estado estndar y; C y D son los productos en
su estado estndar. Adems a, b, c y d son sus respectivos coeficientes
estequiomtricos. en general:
Dependencia de K con la
temperatura
Ley de Accin de Masas
En un proceso elemental, el producto de las
concentraciones en el equilibrio de los productos
elevadas a sus respectivos coeficientes
estequiometricos, dividido por el producto de las
concentraciones de los reactivos en el equilibrio
elevadas a sus respectivo coeficientes
estequiometricos, es una constante para cada
temperatura, llamada constante de equilibrio
Ejemplos
Relacin entre las formas de
expresar la contante de equilibrio
Sea la ecuacin general , donde
todas las especies son gaseosas, Para ese
equilibrio Kc valdr
Relacin entre las constantes de
equilibrio y el grado de disociacin
Una de las grandes aplicaciones de la ley de
equilibrio qumico es, precisamente, el calculo
del rendimiento de una reaccin qumica, es
decir, el grado de desplazamiento de
equilibrio hacia los productos conocida a Kc
Se puede asegurar que un alto valor de Kc, implica
un elevado desplazamiento del equilibrio hacia los
productos y , por contra, un bajo valor de Kc,
implicara que l evolucin del equilibrio qumico ha
sido desfavorable para los productos. Por ello es
importante medir el grado de disociacin
Grado de Disociacin : En tanto por uno de un
proceso quimico es el cociente entre numero de mles
disociados dividido entre el numero totaes de moles
iniciales
Relacin entre la Kp y la
Temperatura
Existe una relacin entre la constante de
equilibrio Kp y la variacin de energa libre en
proceso qumico, esta relacin viene establecida
por la ecuacin:
De esta ecuacin se deduce que tanto como
Kp, depende de la temperatura de reaccin,
por tanto operando a dos temperaturas
distintas, tenemos:
Restando ambas expresiones y haciendo
operaciones resulta:
Ecuacin de Vant Hoff
La ecuacin de Vant Hoff es comnmente
utilizada para determinar los valores de
constantes de equilibrio a una cierta temperatura
a partir de los valores de otra temperatura.
Tambin ofrece medios de obtener calores de
reaccin cuando las constantes de equilibrio son
conocidas en dos temperaturas
Otra forma de la ecuacin de Vant Hoff describe
el cambio de la constante de equilibrio hacia la
concentracin Kc con la temperatura:
Factores que modifican el
equilibrio Ley de Le Chatelier
Esto se utiliza habitualmente para aumentar el
rendimiento de un proceso qumico deseado o,por el
contrario, disminuirlo si es una reaccin indeseable.
Se puede predecir de una manera cualitativa por el
Principio de Le Chatelier: Si en un sistema en
equilibrio se modifica alguno de los factores que
influye en el mismo (temperatura, presin o
concentracin), el sistema evoluciona de forma que se
desplaza en el sentido que tienda a contrarrestar
dicha variacin
Equilibrios Heterogneos
slido-lquido
Un equilibrio heterogneo, que es aquel que
consta de dos fases: una solida y otra en
disolucin acusa que contiene iones que
estn presentes en la fase slida
La reacciones de precipitacin: se define
como aquellas que tienen lugar entre iones
en disolucin para formar sustancias
insolubles
Solubilidad
Solubilidad de un soluto en un disolvente es la
concentracin, en mol/L, que tiene el soluto
dentro del disolvente cuando la disolucin est
saturada, medida a una temperatura determinada.
Es, por tanto, la concentracin mxima que se
puede disolver a esa temperatura
Relacin entre solubilidad y
producto de solubilidad
Es importante apreciar que el valor de Ks no depende de la
presencia de otras sustancias en
disolucin. Como toda constante de equilibrio, Ks, depende
exclusivamente de la temperatura. por el
contrario, la solubilidad de una sal puede cambiar si aadimos a
la disolucin otras sustancias que
aporten iones comunes.
Supngase que una vez establecido el equilibrio
Efecto de ion comn.
aadimos ms iones F disolviendo, por ejemplo, algo de
NaF. El incremento originado en la concentracin de F
perturbar el equilibrio inicial. El sistema, de acuerdo con el
principio de Le Chatelier, se desplazar hacia la izquierda,
consumiendo parte de los iones F
adicionales para contrarrestar parcialmente el efecto
perturbador. Como resultado precipitar algo de PbF2. En
consecuencia, cuando se establezca un nuevo equilibrio el
PbF2 disuelto ser menor que el que haba en el equilibrio
inicial. Resumiendo, la solubilidad del PbF2 disminuye al
adicionarse NaF.
En este ejemplo, los iones F presentes en la disolucin
proceden de dos fuentes, el PbF2 inicialy el NaF aadido
posteriormente. Puesto que el ion F es un ion comn a
ambas sales recibe el nombre de ion comn.
El descenso de la solubilidad de una sal ocasionado por la
adicin de un ion comn se
denomina efecto de ion comn.
S-ar putea să vă placă și
- Funciones de ExelDocument46 paginiFunciones de ExelLuna HanabiÎncă nu există evaluări
- Ta PDFDocument2 paginiTa PDFLuna HanabiÎncă nu există evaluări
- EstadisticaDescriptiva PDFDocument10 paginiEstadisticaDescriptiva PDFLuna HanabiÎncă nu există evaluări
- Epistemologa Cienciassociales 120526104048 Phpapp02Document1 paginăEpistemologa Cienciassociales 120526104048 Phpapp02Luna HanabiÎncă nu există evaluări
- Tecnicas de Comunicacion ExpoDocument6 paginiTecnicas de Comunicacion ExpoLuna HanabiÎncă nu există evaluări
- Cuestionario Admon IIDocument1 paginăCuestionario Admon IILuna HanabiÎncă nu există evaluări
- Literatura MedievalDocument19 paginiLiteratura MedievalJorge Luis IzaguirreÎncă nu există evaluări
- Luego Compararon Las Posibilidades de Aplicación de Las Principales Corrientes Sociológicas y Psicológicas en El Análisis OrganizacionalDocument4 paginiLuego Compararon Las Posibilidades de Aplicación de Las Principales Corrientes Sociológicas y Psicológicas en El Análisis OrganizacionalAnthonnyÎncă nu există evaluări
- Intro Ducci OnDocument11 paginiIntro Ducci OnLuna HanabiÎncă nu există evaluări
- Tema 7Document7 paginiTema 7Luna HanabiÎncă nu există evaluări
- Teoria Estructuralista ChiavenatoDocument18 paginiTeoria Estructuralista ChiavenatoLuna HanabiÎncă nu există evaluări
- Libro Gloria Delgado Capitulo 9 (1) Capitulo 9Document70 paginiLibro Gloria Delgado Capitulo 9 (1) Capitulo 9Luna HanabiÎncă nu există evaluări
- Modeloseconmicos 121102004331 Phpapp02 140223165027 Phpapp02Document33 paginiModeloseconmicos 121102004331 Phpapp02 140223165027 Phpapp02Luna HanabiÎncă nu există evaluări
- Luis EcheverriaDocument18 paginiLuis EcheverriaLuna HanabiÎncă nu există evaluări
- Formas verbales del verbo dormir en españolDocument6 paginiFormas verbales del verbo dormir en españolLuna HanabiÎncă nu există evaluări
- Elprncipecap Ialx 120321212313 Phpapp01 2Document12 paginiElprncipecap Ialx 120321212313 Phpapp01 2Luna HanabiÎncă nu există evaluări
- Balance de MateriaDocument11 paginiBalance de MateriaLuna HanabiÎncă nu există evaluări
- Conferencia de La Profesora Ileana GossioDocument1 paginăConferencia de La Profesora Ileana GossioLuna HanabiÎncă nu există evaluări
- Capitulo 30Document7 paginiCapitulo 30Luna HanabiÎncă nu există evaluări
- Elsexeniodeluisecheverra 120104012704 Phpapp01Document13 paginiElsexeniodeluisecheverra 120104012704 Phpapp01Luna HanabiÎncă nu există evaluări
- Luisecheverralvarez19701976 151104173741 Lva1 App6891Document5 paginiLuisecheverralvarez19701976 151104173741 Lva1 App6891Luna HanabiÎncă nu există evaluări
- Reseña Ernesto SabatoDocument7 paginiReseña Ernesto SabatoLuna HanabiÎncă nu există evaluări
- Esterificación de FischerDocument5 paginiEsterificación de FischerJovani MonroyÎncă nu există evaluări
- Gobiernospos Revolucionarioscuadrocomparativo 120613131209 Phpapp02Document3 paginiGobiernospos Revolucionarioscuadrocomparativo 120613131209 Phpapp02Luna Hanabi100% (1)
- Capitulo 4 EL ImperialismoDocument29 paginiCapitulo 4 EL ImperialismoLuna Hanabi100% (1)
- Thomas Hobbes Pensamiento PoliticoDocument13 paginiThomas Hobbes Pensamiento PoliticoLuna HanabiÎncă nu există evaluări
- Identificación de La PoleasDocument1 paginăIdentificación de La PoleasLuna HanabiÎncă nu există evaluări
- La Filosofía Política de HobbesDocument45 paginiLa Filosofía Política de HobbesLuna HanabiÎncă nu există evaluări
- Capitulo 7 Pagando El Orden y El ProgresoDocument7 paginiCapitulo 7 Pagando El Orden y El ProgresoLuna HanabiÎncă nu există evaluări
- DEFINICIONESDocument1 paginăDEFINICIONESLuna HanabiÎncă nu există evaluări
- Ptap CalculoDocument11 paginiPtap CalculoJesus TineoÎncă nu există evaluări
- Caida de Los Cuerpos en FluidosDocument36 paginiCaida de Los Cuerpos en FluidosJuan LlanoÎncă nu există evaluări
- El Ensayo de Tracción de Un Material Consiste en Someter A Una Probeta Normalizada A Un Esfuerzo Axial de Tracción Creciente Hasta Que Se Produce La Rotura de La ProbetaDocument2 paginiEl Ensayo de Tracción de Un Material Consiste en Someter A Una Probeta Normalizada A Un Esfuerzo Axial de Tracción Creciente Hasta Que Se Produce La Rotura de La ProbetaLeonor LucenaÎncă nu există evaluări
- Ucci - Termo 01 - 2018-2Document12 paginiUcci - Termo 01 - 2018-2Jordan Bazan JimenezÎncă nu există evaluări
- Lab5 TransferenciaDocument11 paginiLab5 TransferenciaYanelys HerreraÎncă nu există evaluări
- Fase 3Document7 paginiFase 3johan sebastian vega cardenas100% (1)
- Marco Teorico OpeDocument4 paginiMarco Teorico OpeGaby BuÎncă nu există evaluări
- Diseño de Los Conductos de VentilacionDocument14 paginiDiseño de Los Conductos de VentilacionEstefania ValdiviezoÎncă nu există evaluări
- Tarea QuimicaDocument4 paginiTarea Quimicadiego davidÎncă nu există evaluări
- Informe de Pérdidas de Carga en Tuberías y Conductos - Grupo 1Document37 paginiInforme de Pérdidas de Carga en Tuberías y Conductos - Grupo 1Joaquin Santiago Torres SaldañaÎncă nu există evaluări
- Análisis matricial de una parrillaDocument18 paginiAnálisis matricial de una parrillaAnthony Guerrero FacioÎncă nu există evaluări
- Termodinámica: Análisis Termodinámico de Equipos Módulo IiiDocument50 paginiTermodinámica: Análisis Termodinámico de Equipos Módulo IiipatriveraÎncă nu există evaluări
- Proceso Reversible e IrreversibleDocument1 paginăProceso Reversible e IrreversibleSEGURIDAD DCR INMACULADAÎncă nu există evaluări
- Modelación de Flujo Libre UNALDocument33 paginiModelación de Flujo Libre UNALNicolas Daniel Cifuentes CruzÎncă nu există evaluări
- Informe EstaticaDocument21 paginiInforme EstaticaKenedy Delacruz MorilloÎncă nu există evaluări
- Cuestionario Previo 4Document3 paginiCuestionario Previo 4Grettell Galilea Maldonado BolañosÎncă nu există evaluări
- Metodo FangerDocument12 paginiMetodo FangerTania OsornioÎncă nu există evaluări
- Bomba vertical de pulpa para proyecto de KREISSEL PUMPDocument1 paginăBomba vertical de pulpa para proyecto de KREISSEL PUMPEmpresa KreiselpumpenÎncă nu există evaluări
- Destilacion FraccionadaDocument5 paginiDestilacion FraccionadaAlex CristobalÎncă nu există evaluări
- Como Seleccionar El Intercambiador de Ca PDFDocument3 paginiComo Seleccionar El Intercambiador de Ca PDFCamilo Puentes OlayaÎncă nu există evaluări
- TAG VálvulasDocument7 paginiTAG VálvulasmanuelÎncă nu există evaluări
- Mantenimiento de Sala de CalderaDocument98 paginiMantenimiento de Sala de Calderaadriana castilloÎncă nu există evaluări
- Práctica 1Document29 paginiPráctica 1Gabriela TorresÎncă nu există evaluări
- FFT Solucion Segundo Examen Parcial PDFDocument10 paginiFFT Solucion Segundo Examen Parcial PDFNancyÎncă nu există evaluări
- (ACV-S02) Tarea Calificada 1 (EP1)Document21 pagini(ACV-S02) Tarea Calificada 1 (EP1)Yuly Nery Cuty Quispe50% (2)
- Metodo Balance EnergeticoDocument5 paginiMetodo Balance Energeticomanulo85Încă nu există evaluări
- Cap 1 Parte 1Document121 paginiCap 1 Parte 1Franklin feelÎncă nu există evaluări
- Resumen Semana 3 y 4Document5 paginiResumen Semana 3 y 4Daniela GrimaldoÎncă nu există evaluări
- Difusor de AdmisionDocument23 paginiDifusor de Admisiongabriel BalcazaÎncă nu există evaluări
- Guialeyesdelosgases 140509200845 Phpapp01Document3 paginiGuialeyesdelosgases 140509200845 Phpapp01Orlando PayaresÎncă nu există evaluări