Documente Academic
Documente Profesional
Documente Cultură
Análisis Volumetrico
Încărcat de
argentina-20090 evaluări0% au considerat acest document util (0 voturi)
21 vizualizări21 paginiTitlu original
análisis volumetrico (1)
Drepturi de autor
© © All Rights Reserved
Formate disponibile
PPTX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PPTX, PDF, TXT sau citiți online pe Scribd
0 evaluări0% au considerat acest document util (0 voturi)
21 vizualizări21 paginiAnálisis Volumetrico
Încărcat de
argentina-2009Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca PPTX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 21
1.
La reaccin debe ocurrir de acuerdo a una ecuacin qumica
definida. No deben existir reacciones colaterales.
2. La reaccin debe terminar por completo en el punto de
equivalencia, es decir, la constante de equilibrio de la
reaccin debe ser muy grande.
3. Debe contarse con un mtodo para determinar cuando se
alcanza el punto de equivalencia, debe estar disponible un
indicador o algn mtodo instrumental que permita al analista
saber cuando detener la adicin de un titulante.
4. Es conveniente que la reaccin sea rpida para que la
titulacin pueda realizarse en unas cuantos minutos.
REQUISITOS PARA LAS REACCIONES
UILIZADAS EN ANLISIS VOLOMTRICO.
VOLUMETRA
Es una rama de la qumica analtica cuantitativa que
tiene como fin o principio medir exactamentee el
volumen de una solucin patrn que reacciona
estequiomtricamente con una porcin medida de la
muestra.
REACCIONES QUE SE UTILIZAN EN
LAS TITULACIONES.
1. Reacciones cido base.
2. Oxido-Reduccin.
3. Reacciones de precipitacin.
4. Reacciones de formacin de complejos.
VOLUMETRA CIDO - BASE
A. Titulaciones cido - Base en sistemas acuosos
Curvas.
Deteccin del punto final.
Indicadores.
Electrodo para medir pH.
Se encuentran totalmente disociados, por lo tanto el pH a lo
largo de la titulacin se puede calcular directamente de las
cantidades estequiomtricas de cido y de base que van
reaccionando. En el punto de equivalencia el pH est
determinado por el grado de disociacin del agua; a 25C el
pH del agua pura es de 7.00.
Los iones hidronio en una solucin acuosa de un cido
fuerte provienen de 2 fuentes:
1. De la reaccin del cido con el agua y
2. Dela disociacin del agua, sin embargo, en casi todas las
soluciones diluidas la contribucin del cido fuerte excede
con mucho a la contribucin del disolvente
A.1. CIDO FUERTE - BASE FUERTE.
As para una solucin de cido fuerte como HCl con una
concentracin mayor a 10
-6
, se puede escribir:
[H
3
O
+
] = [HCl] + [OH
-
] se aproxima a [HCl]
En donde [OH
-
] representa la concentracin de los iones hidronio
provenientes de la disociacin del agua.
Para una solucin de una base fuerte, como el NaOH, se le
aplica una relacin semejante. Es decir:
[OH
-
] = [NaOH] + [H
3
O
+
] ] se aproxima a [NaOH]
K
w
= [H
3
O
+
] [OH
-
]
-log [H
3
O
+
] [OH
-
] = -log [H
3
O
+
] - log [OH
-
]
pK
w
= pH pOH
-log 1 X 10
-14
Ejemplo: Realiza los clculos necesarios para hacer una curva
de titulacin terica para la titulacin de 50 mL de HCl = 0.5 M con
NaOH 0.1M.
Antes de agregar la base, la solucin es 0.05 M en H
3
O
+
y
pH = -log [H
3
O
+
]
pH = -log 0.05
pH = 1.30
Luego de adicionarle 10 mL de NaOH la [H
3
O
+
] disminuye
[HCl]= No. de mmol de HCl que permanecen despues de aadir NaOH
Volumen total de solucin
[HCl]= No. de mmol iniciales de HCl No. De mmol de NaOH aadidas
Volumen total de solucin
= (50 mL X 0.05 M) (10 mL X 0.1 M)
50 mL +10 mL
= (2.5 mmol -1 mmol)/ 60 mL =2.5 X10
-2
M
[H
3
O
+
] = 2.5 X10
-2
pH = -log [H
3
O
+
] = -log (2.5 X10
-2
) = 1.602
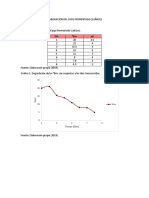
CAMBIOS DEL PH DURANTE LA TITULACIN DE
UN CIDO FUERTE CON UNA BASE FUERTE.
Volumen de
NaOH, mL.
pH
50 mL de
HCl0.05M con
NaOH 0.1M.
500 mL de HCl
0.0005M con
NaOH .001 M.
0 1.30 3.30
10 1.60 3.60
20 2.15 4.15
24 2.87 4.87
24.90 3.87 5.87
25 7.00 7.00
25.10 10 8.12
26 12 9.12
30 11 9.80
A.2. CIDO DBIL - BASE FUERTE
Curva de valoracin. NaOH 0.1M sobre 25 mL CH
3
COOH 0.1M
El punto de equivalencia se encontrar a un pH bsico
HOAc + Na
+
+ OH
-
H
2
O + Na
+
OAc
-
El punto de
Equivalencia se
encontrar a pH
bsico.
A.3. BASE DBIL - CIDO FUERTE
Curva de valoracin. HCl 0.1M sobre 25 mL NH3 0.1M
NH
3
+ H
+
+Cl
-
NH
4
+
+ Cl
-
El punto de
Equivalencia se
encontrar a pH
cido.
A.4. SISTEMAS POLIPRTICOS.
Los cidos capaces de donar ms de un protn en reacciones cido-base se
denominan diprticos, triprticos etctera. Dichos cidos presentan
tantas etapas de disociacin como protones pueden donar. Presentan la
peculiaridad de que las especies intermedias de la ionizacin so siempre
sustancias anfiprticas.
Los cidos poliprticos presentan tantos
puntos de equivalencia como protones
pueden ser valorados con base fuerte.
En el caso del H
3
PO
4
, dado los valores de las sucesivas constantes
de acidez, slo es posible la valoracin hasta al anin HPO
4
.
As, para valorar 10.0 mL de H
3
PO
4
0.10 M con NaOH 0.1 M se
requiere un volumen de 10.0 mL de NaOH para alcanzar el primer
punto de equivalencia (naranja de metilo).
Lgicamente, para alcanzar el segundo punto de equivalencia se
necesita un volumen adicional de 10.0 mL de NaOH (fenolfaleina).
Los cationes pueden ejercer intensas acciones atractivas sobre los grupos
negativos o sobre los extremos negativos de molculas neutras polares, dando
lugar a la formacin de combinaciones de orden superior MLn que se
denominan complejos. Al in metlico se le denomina in central del complejo
y los grupos L, denominados ligandos, se unen al in central mediante un
enlace covalente coordiando (coordiando dativo).
VOLUMETRA EN REACCIONES DE FORMACIN
DE COMPLEJOS.
la formacin de complejos se puede explicar por al teora cido-
base de Lewis. As, el in central es un aceptor de pares de
electrones o cido de Lewis y cada ligando un dador de pares de
electrones o base de Lewis.
Muchas sustancias biolgicas importantes son compuestos de
coordinacin. La hemoglobina y la clorofila son ejemplos. La
hemoglobina es una protena que transporta oxgeno en la
sangre. Contiene iones Fe2+ enlazados a grandes anillos
porfirina.
El anlisis volumtrico por formacin de complejos utiliza con
frecuencia los cidos aminopolicarboxlicos como
agentes complejantes de un gran nmero de elementos metlicos.
Las denominadas "complexonas" poseen un grupo funcional
caracterstico: -N(CH
2
-COOH)
2
, siendo la ms simple el cido
imino diactico: HN(CH
2
COOH)
2
.
La estructura del EDTA es:
(HOOC-CH
2
)
2
N-CH
2
-CH
2
-N(CH
2
-COOH)
2
DETERMINACIN DE Ca
2+
y Mg
2+
por titulacin con EDTA
Me
2+
+ H
2
Y
2-
MY
2-
+ 2 H
+
Me = Ca(II) y Mg(II)
Mg-NET + EDTA Mg-EDTA + NET
VOLUMETRA EN REACCIONES DE FORMACIN
DE PRECIPITADOS.
Es similar a la Valoracin cido base, los clculos de equilibrio se basan en el
kps, como producto de la reaccin se forma una sal poco soluble que precipita
cuando se llega al punto de equivalencia, donde la concentracin de la
sustancia buscada en la solucin es mnima; en ese momento el indicador
reacciona con el analito, detectndose de esta manera el punto final de la
valoracin
X
-
+ Ag
+
XAg
Analito agente ppte precipitado
Los mtodos analticos utilizan tres indicadores,
para las valoraciones por precipitacin, que se han
empleado con xito,
El mtodo de Mohr utiliza in cromato para precipitar el
cromato de plata de color rojo ladrillo.
El mtodo de Volhard utiliza in Fe3
+
, para formar un
complejo colorido rojo con el ion tiocianato, SCN- y
El mtodo de Fajans emplea indicadores de adsorcin.
MTODO DE MOHR
El mtodo se utiliza para determinar iones
cloruro y
bromuro de metales alcalinos, magnesio y
amonio.
La valoracin se hace con solucin patrn
de AgNO
3
. El indicador es el ion cromato
CrO
4
=
, que comunica a la solucin en el
punto inicial una coloracin amarilla y forma
en el punto final un precipitado rojo ladrillo
de cromato de plata,Ag
2
CrO
4.
Las
reacciones que ocurren en la determinacin
de iones cloruro son:
Cl
-
+ Ag
+
AgCl (Precipitado blanco)
CrO
4
=
+ 2Ag
+
Ag
2
CrO
4
(Precipitado
rojo ladrillo)
La solucin debe tener un pH neutro o cercano a la
neutralidad. Un pH de 8.3 es adecuado para la
determinacin.
La solucin patrn de AgNO
3
se puede preparar por el
mtodo directo dado que el nitrato de plata es un
reactivo tipo primario; con el objeto de compensar los
errores en la precipitacin del punto final se prefiere el
mtodo indirecto y la solucin se valora con NaCl
qumicamente puro. Cuando la solucin tipo se prepara
por el mtodo indirecto no es necesario el ensayo en
blanco, porque el exceso empleado en la valoracin de
la sustancia problema se compensa con el empleado
en la valoracin del AgNO
3
.
S-ar putea să vă placă și
- 2018 03 17 130118-PCyCCronograma1CVie TNAula 705 MA 2018Document2 pagini2018 03 17 130118-PCyCCronograma1CVie TNAula 705 MA 2018argentina-2009Încă nu există evaluări
- EINAGA01 - Guía de Ejercicios Resueltos - Vectores en R 2 y R 3 - Práctica 1 - 2013Document40 paginiEINAGA01 - Guía de Ejercicios Resueltos - Vectores en R 2 y R 3 - Práctica 1 - 2013danco26Încă nu există evaluări
- Alea To RiosDocument3 paginiAlea To Riosargentina-2009Încă nu există evaluări
- Propiedades y Definiciones de AlgebraDocument56 paginiPropiedades y Definiciones de Algebraargentina-2009Încă nu există evaluări
- Numeros Complejos PDFDocument28 paginiNumeros Complejos PDFjanttÎncă nu există evaluări
- 2018 03 17 130118-PCyCCronograma1CVie TNAula 705 MA 2018Document2 pagini2018 03 17 130118-PCyCCronograma1CVie TNAula 705 MA 2018argentina-2009Încă nu există evaluări
- Alea To RiosDocument3 paginiAlea To Riosargentina-2009Încă nu există evaluări
- Polinomios Teoria Aula VirtualDocument11 paginiPolinomios Teoria Aula VirtualLechero De Corazon MHÎncă nu există evaluări
- Tabla de Links Clases de AyGADocument4 paginiTabla de Links Clases de AyGAargentina-2009Încă nu există evaluări
- FT Bio Transformaci OnDocument12 paginiFT Bio Transformaci OnAna SuÎncă nu există evaluări
- Enzimas clave en la industria cárnicaDocument46 paginiEnzimas clave en la industria cárnicaargentina-2009Încă nu există evaluări
- Tipos de Discontinuidad de Funciones, EjemplosDocument4 paginiTipos de Discontinuidad de Funciones, Ejemplosargentina-2009Încă nu există evaluări
- Cro No GramaDocument3 paginiCro No Gramaargentina-2009Încă nu există evaluări
- Gramatica Noruega CompletaDocument78 paginiGramatica Noruega CompletaHerminia Delgado Núñez100% (4)
- 1º Ppcio Sistemas AbiertosDocument6 pagini1º Ppcio Sistemas Abiertosargentina-2009Încă nu există evaluări
- Guìa de Estudio 2017Document3 paginiGuìa de Estudio 2017argentina-2009Încă nu există evaluări
- Calidad - Variables y Capacidad 2Document16 paginiCalidad - Variables y Capacidad 2argentina-2009Încă nu există evaluări
- TP #10 - Aire Húmedo - v. 2.013 - R - 1Document61 paginiTP #10 - Aire Húmedo - v. 2.013 - R - 1argentina-2009Încă nu există evaluări
- Aditivos y Antibioticos 2016Document29 paginiAditivos y Antibioticos 2016argentina-2009Încă nu există evaluări
- Pesticidas y Plaguicidas 2016Document23 paginiPesticidas y Plaguicidas 2016argentina-2009Încă nu există evaluări
- Pesticidas y Plaguicidas 2016Document23 paginiPesticidas y Plaguicidas 2016argentina-2009Încă nu există evaluări
- Parámetros Calidad Del TrigoDocument7 paginiParámetros Calidad Del TrigoCésar Augusto Flores SilvaÎncă nu există evaluări
- Parciales IDocument34 paginiParciales Igabriel2112Încă nu există evaluări
- Tipos de Nutricion BacterianaDocument2 paginiTipos de Nutricion Bacterianaargentina-2009Încă nu există evaluări
- CM ES5 1PA U2 PDFDocument20 paginiCM ES5 1PA U2 PDFargentina-2009Încă nu există evaluări
- Informe TP Nº2 - Análisis de CarnesDocument6 paginiInforme TP Nº2 - Análisis de Carnesargentina-2009Încă nu există evaluări
- TINCIONESDocument6 paginiTINCIONESargentina-2009Încă nu există evaluări
- Informe TP Nº1 - ANÁLISIS de MIEL (Versión Final)Document7 paginiInforme TP Nº1 - ANÁLISIS de MIEL (Versión Final)argentina-2009Încă nu există evaluări
- Claims nutricionales y de salud: marco regulatorio en ArgentinaDocument37 paginiClaims nutricionales y de salud: marco regulatorio en Argentinaargentina-2009Încă nu există evaluări
- Suplementacion PDFDocument13 paginiSuplementacion PDFargentina-2009Încă nu există evaluări
- Mandate Una Tapa Tapas Route, Granadilla de AbonaDocument27 paginiMandate Una Tapa Tapas Route, Granadilla de AbonaJack MontgomeryÎncă nu există evaluări
- Plan de exportación para Fullpacktex Cia. LtdaDocument85 paginiPlan de exportación para Fullpacktex Cia. LtdaKatherine ZamoraÎncă nu există evaluări
- ISO 13485 EspañolDocument35 paginiISO 13485 EspañolMichelleAlvarezÎncă nu există evaluări
- Resultados de Cañazo y ChancacaDocument3 paginiResultados de Cañazo y ChancacaAndrea CondoÎncă nu există evaluări
- 004 TDRs Mantenimiento de Oruga 2022Document3 pagini004 TDRs Mantenimiento de Oruga 2022wilisz quinaÎncă nu există evaluări
- Matematica Financiera - Informe de Libros - X - Men - 44Document4 paginiMatematica Financiera - Informe de Libros - X - Men - 44Emmanuel UrielÎncă nu există evaluări
- Escuelas Nuevas y Maestros DiferentesDocument2 paginiEscuelas Nuevas y Maestros DiferentesItzel CatalánÎncă nu există evaluări
- 0016 Mantenimiento Predictivo Aplicado A Aerogenerador NM 52 PDFDocument28 pagini0016 Mantenimiento Predictivo Aplicado A Aerogenerador NM 52 PDFDenisse GarciaÎncă nu există evaluări
- Dispositivos Electronicos2016Document266 paginiDispositivos Electronicos2016ivanÎncă nu există evaluări
- Tipos de Mercado, EXPOSICION..¡¡¡Document7 paginiTipos de Mercado, EXPOSICION..¡¡¡Milagros HuamaniÎncă nu există evaluări
- Gestión Efectiva Operaciones - Cálculo Parque FlotasDocument7 paginiGestión Efectiva Operaciones - Cálculo Parque FlotasCHARLES HUMBERTOÎncă nu există evaluări
- Receta Pizza IntegralDocument5 paginiReceta Pizza IntegralClara Luz MÎncă nu există evaluări
- Ejercicios PropuestosDocument5 paginiEjercicios PropuestosCivil GrupodosÎncă nu există evaluări
- Control de Costos Taller 5Document20 paginiControl de Costos Taller 5Angel Sanchez40% (5)
- Catalogo SMC Overview (2011)Document238 paginiCatalogo SMC Overview (2011)Mog AcevesÎncă nu există evaluări
- Abb Lista de Precios Transf PDFDocument6 paginiAbb Lista de Precios Transf PDFdmejiagaÎncă nu există evaluări
- Formato Solicitud de Apoyos Economicos 12052020Document2 paginiFormato Solicitud de Apoyos Economicos 12052020JohanAlfonso100% (1)
- Estudio Mercado Japón 2016 ICEX 1 PDFDocument44 paginiEstudio Mercado Japón 2016 ICEX 1 PDFDiego GarciaÎncă nu există evaluări
- Carta presentación CV asistente RRHHDocument12 paginiCarta presentación CV asistente RRHHedcarchv100% (1)
- Cuatro Enemigos en El Network MarketingDocument2 paginiCuatro Enemigos en El Network MarketingEdwin TorresÎncă nu există evaluări
- 10 Criterios para Poner Nombre A Una EmpresaDocument14 pagini10 Criterios para Poner Nombre A Una Empresafelixdavidleiva6520Încă nu există evaluări
- Recetas Lady MasterDocument31 paginiRecetas Lady Masterxbmart100% (5)
- Evidencia 14Document5 paginiEvidencia 14Erica FlorianÎncă nu există evaluări
- SOP Impresion OEDocument12 paginiSOP Impresion OEjuliana paola rey pereiraÎncă nu există evaluări
- Auditoría administrativa de procesos en empresa de transporteDocument17 paginiAuditoría administrativa de procesos en empresa de transporteArmando Quijano BardónÎncă nu există evaluări
- Potencias y RaicesDocument5 paginiPotencias y RaicesAlfredo Sotelo PejerreyÎncă nu există evaluări
- Flujo de caja: análisis y objetivosDocument25 paginiFlujo de caja: análisis y objetivosBrayan Jose CárdenasÎncă nu există evaluări
- Silca EspanolDocument25 paginiSilca EspanolMasoud Yousefey100% (1)
- 2 - Trabajo de Planificacion Equipo #3Document20 pagini2 - Trabajo de Planificacion Equipo #3chofis389Încă nu există evaluări
- Contexto de La Gerencia ActualDocument36 paginiContexto de La Gerencia ActualGaby GabrielaÎncă nu există evaluări