Documente Academic
Documente Profesional
Documente Cultură
Acido Base 2
Încărcat de
JhoanHuayasSalvatierraTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Acido Base 2
Încărcat de
JhoanHuayasSalvatierraDrepturi de autor:
Formate disponibile
cidos fuertes cidos dbiles
HCl
HBr
HI
HClO
3
HClO
4
H
2
SO
4
HNO
3
HF
HNO
2
CH
3
COOH
HCN
HClO
C
6
H
5
COOH
Hidrlisis de sales
Es la reaccin de los iones de una sal
con el agua.
Slo es apreciable cuando estos iones
proceden de un cido o una base dbil:
Hidrlisis cida (de un catin):
NH
4
+
+ H
2
O NH
3
+ H
3
O
+
Hidrlisis bsica (de un anin):
CH
3
COO
+H
2
O CH
3
COOH
+OH
Tipos de hidrlisis.
Segn procedan el catin y el anin de un cido o una
base fuerte o dbil, las sales se clasifican en:
Sales procedentes de cido fuerte y base fuerte.
Ejemplo: NaCl
Sales procedentes de cido dbil y base fuerte.
Ejemplo: NaCN
Sales procedentes de cido fuerte y base dbil.
Ejemplo: NH
4
Cl
Sales procedentes de cido dbil y base dbil.
Ejemplo: NH
4
CN
Sales procedentes de cido
fuerte y base fuerte.
Ejemplo: NaCl
NO SE PRODUCE HIDRLISIS ya que
tanto el Na
+
que es un cido muy dbil
como el Cl
que es una base muy dbil
apenas reaccionan con agua. Es decir los
equilibrios:
Na
+
+ 2 H
2
O NaOH
+ H
3
O
+
Cl
+ H
2
O HCl
+ OH
estn muy desplazado hacia la izquierda.
Sales procedentes de cido
dbil y base fuerte.
Ejemplo: Na
+
CH
3
COO
SE PRODUCE HIDRLISIS BSICA ya que
el Na
+
es un cido muy dbil y apenas
reacciona con agua, pero el
CH
3
COO
es una base fuerte y si reacciona
con sta de forma significativa:
CH
3
COO
+ H
2
O CH
3
COOH
+ OH
lo que provoca que el pH > 7 (dis. bsica).
Sales procedentes de cido
fuerte y base dbil.
Ejemplo: NH
4
Cl
SE PRODUCE HIDRLISIS CIDA ya
que el NH
4
+
es un cido relativamente
fuerte y reacciona con agua mientras que
el Cl
es una base dbil y no lo hace de
forma significativa:
NH
4
+
+ H
2
O NH
3
+ H
3
O
+
lo que provoca que el pH < 7 (dis. cida).
Sales procedentes de cido
dbil y base dbil.
Ejemplo: NH
4
CN
En este caso tanto el catin NH
4
+
como el
anin CN
se hidrolizan y la disolucin
ser cida o bsica segn qu ion se
hidrolice en mayor grado.
K
b
(CN
) = 2 x 10
5
M y
K
a
(NH
4
+
) = 5,6 x 10
10
M ,
en este caso, la disolucin es bsica ya
que K
b
(CN
) > K
a
(NH
4
+
)
Ejercicio : Razone utilizando los equilibrios correspondientes, si
los pH de las disoluciones que se relacionan seguidamente son
cidos, bsicos o neutros. a) Acetato potsico 0,01 M; b) Nitrato
sdico0,01M; c) Sulfato amnico 0,01 M; d) Hidrxido de bario
0,01 M.
a) Acetato potsico: pH bsico, ya que
CH
3
COO
+ H
2
O CH
3
COOH
+ OH
por ser el c. acetico dbil, mientras que el K
+
no
reacciona con agua por ser el KOH base fuerte.
b) nitrato sdico: pH neutro, ya que ni el anin NO
3
ni el catin Na
+
reaccionan con agua por proceder
el primero del HNO
3
y del NaOH el segundo,
ambos electrolitos fuertes.
c) Sulfato amnico: pH cido, ya que
NH
4
+
+ H
2
O NH
3
+ H
3
O
+
por ser el amoniaco dbil, mientras que el
SO
4
2
no reacciona con agua por ser el
H
2
SO
4
cido fuerte.
d) Hidrxido de bario: pH bsico pues se
trata de una base fuerte (los hidrxidos de
los metales alcalinos y alcalino-trreos son
bases bastantes fuertes)
Disoluciones amortiguadoras (tampn)
Son capaces de mantener el pH despus de aadir
pequeas cantidades tanto de cido como de base.
Estn formadas por:
Disoluciones de cido dbil + sal de dicho cido dbil
con catin neutro:
Ejemplo: cido actico + acetato de sodio.
Disoluciones de base dbil + sal de dicha base dbil
con anin neutro:
Ejemplo: amoniaco y cloruro de amonio.
Variacin del pH al aadir pequeas
cantidades de NaOH o HCl
Ed. Santillana
Ejemplo: Calcular el pH de una disolucin
tampn formada por una concentracin
0,2 M de cido actico y 0,2 M de acetato de
sodio. K
a
(CH
3
COOH) = 1,8 10
5
M.
El acetato est totalmente disociado:
CH
3
COONa CH
3
COO
+ Na
+
El cido actico se encuentra en equilibrio
con su base conjugada (acetato):
H
2
O + CH
3
COOH CH
3
COO
+ H
3
O
+
c
in
(M) 0,2 0,2 0
c
eq
(M) 0,2 x 0,2 + x x
Ejemplo: Calcular el pH de una disolucin
tampn formada por una concentracin
0,2 M de cido actico y 0,2 M de acetato de
sodio. K
a
(CH
3
COOH) = 1,8 10
5
M
CH
3
COO
H
3
O
+
(0,2+x) x
1,8 10
5
M = =
CH
3
COOH (0,2 x)
De donde se deduce que:
x = H
3
O
+
= 1,8 10
5
M
pH = log H
3
O
+
= 4,74
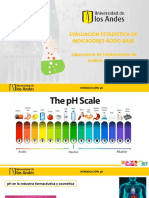
Indicadores de pH
(cido- base)
Son sustancias que cambian de color al
pasar de la forma cida a la bsica:
HIn + H
2
O In
+ H
3
O
+
forma cida forma bsica
El cambio de color se considera apreciable
cuando [HIn] > 10[In
] o [HIn]< 1/10[In
]
In
H
3
O
+
HIn
K
a
= H
3
O
+
= K
a
HIn In
pH = pK
a
+ log In
/ HIn = pK
a
1
Algunos indicadores de pH
Indicador
Color
forma
cida
Color forma
bsica
Zona de
viraje
(pH)
Violeta de
metilo
Amarillo Violeta 0-2
Rojo Congo Azul Rojo 3-5
Rojo de
metilo
Rojo Amarillo 4-6
Tornasol Rojo Azul 6-8
Fenolftalen
a
Incoloro Rosa 8-10
Valoraciones cido-base
Valorar es medir la
concentracin de un
determinado cido o
base a partir del
anlisis volumtrico de
la base o cido
utilizado en la reaccin
de neutralizacin.
Grfica de valoracin de
vinagre con NaOH
Zona de viraje fenolftalena
20 40 60 V NaOH(ml)
12
10
8
6
4
2
pH
Valoraciones cido-base.
La neutralizacin de un cido/base con
una base/cido de concentracin
conocida se consigue cuando
#eq cido = #eq base
En realidad, la sal formada se encuentra
disociada, por lo que la nica reaccin
es:
H
3
O
+
+ OH
2H
2
O
Valoraciones cido-base
#eq
cido
= #eq
base =
V
base
x N
base
En el caso de sales procedentes de cido
o base dbiles debe utilizarse un
indicador que vire al pH de la sal
resultante de la neutralizacin.
S-ar putea să vă placă și
- Manual de Puentes Año 2019Document634 paginiManual de Puentes Año 2019Ricardo Paco Ortigozo100% (1)
- Presentacincartografia 151208191055 Lva1 App6891 PDFDocument38 paginiPresentacincartografia 151208191055 Lva1 App6891 PDFJhoanHuayasSalvatierraÎncă nu există evaluări
- Texturas secundarias de minerales opacosDocument9 paginiTexturas secundarias de minerales opacosJhoanHuayasSalvatierraÎncă nu există evaluări
- Formato de Logueo de CoresDocument1 paginăFormato de Logueo de CoresJhoanHuayasSalvatierraÎncă nu există evaluări
- UEA Heraldos NegrosDocument18 paginiUEA Heraldos NegrosJhoanHuayasSalvatierraÎncă nu există evaluări
- ABC Historia UniversalDocument21 paginiABC Historia UniversalSharon Ventura91% (11)
- Grupo Facebook preguntas admisión universidadesDocument12 paginiGrupo Facebook preguntas admisión universidadesAlberto Aduvire Rafael33% (3)
- Uso Del FieldMove ClinoDocument16 paginiUso Del FieldMove ClinoJhoanHuayasSalvatierraÎncă nu există evaluări
- Densidad PDFDocument16 paginiDensidad PDFElizabeth GomezÎncă nu există evaluări
- Clasificación de Suelos SucsDocument44 paginiClasificación de Suelos SucsEduardo Herrera TrujilloÎncă nu există evaluări
- Catalog Ode Ensayo S de Lab OratorioDocument27 paginiCatalog Ode Ensayo S de Lab OratorioAlex David MuñivargasÎncă nu există evaluări
- Reporte de Minerales OpacosDocument21 paginiReporte de Minerales OpacosJhoanHuayasSalvatierraÎncă nu există evaluări
- Fases de Los Proyectos de InversionDocument3 paginiFases de Los Proyectos de InversionJhoanHuayasSalvatierraÎncă nu există evaluări
- Informe Del Morro SolarDocument30 paginiInforme Del Morro SolarWilfredo Jesus Navarro ChaguaÎncă nu există evaluări
- Texturas Secundarias de MineralesDocument13 paginiTexturas Secundarias de MineralesJhoanHuayasSalvatierraÎncă nu există evaluări
- Proyecto Fiorella NaomiDocument25 paginiProyecto Fiorella NaomiJhoanHuayasSalvatierra0% (1)
- Minera Del Carbón en VenezuelaDocument47 paginiMinera Del Carbón en VenezuelaJhoanHuayasSalvatierraÎncă nu există evaluări
- Balotario para Examen FinalDocument13 paginiBalotario para Examen FinalJhoanHuayasSalvatierraÎncă nu există evaluări
- Estratigrafía SecuencialDocument10 paginiEstratigrafía SecuencialJhoanHuayasSalvatierraÎncă nu există evaluări
- Floc Flotacion de MalaquitaDocument11 paginiFloc Flotacion de MalaquitaFlia Diaz Zuniga100% (1)
- Formación Ciudadana y CívicaDocument2 paginiFormación Ciudadana y CívicaJhoanHuayasSalvatierraÎncă nu există evaluări
- Riesgo y Rentabilidad - Enrique Quispe AyalaDocument17 paginiRiesgo y Rentabilidad - Enrique Quispe AyalaJhoanHuayasSalvatierraÎncă nu există evaluări
- Geodinamica ExternaDocument23 paginiGeodinamica ExternaAyinn MkÎncă nu există evaluări
- Peru SATDocument16 paginiPeru SATJhoanHuayasSalvatierraÎncă nu există evaluări
- Guía para La Excursión Geológica Carretera Tarapoto-MoyobambaDocument15 paginiGuía para La Excursión Geológica Carretera Tarapoto-MoyobambaJhoanHuayasSalvatierraÎncă nu există evaluări
- 2013 Figueredo Frias GEO11-P8 PDFDocument20 pagini2013 Figueredo Frias GEO11-P8 PDFFernando Bravo LlanaÎncă nu există evaluări
- 15-11 Exploracion GeologicaDocument5 pagini15-11 Exploracion GeologicaIsaac VisualÎncă nu există evaluări
- Ley de Seguridad y Salud en El TrabajoDocument45 paginiLey de Seguridad y Salud en El TrabajoJhoanHuayasSalvatierraÎncă nu există evaluări
- Afloramiento de VetaDocument1 paginăAfloramiento de VetaJhoanHuayasSalvatierraÎncă nu există evaluări
- Perforaciones 2012Document21 paginiPerforaciones 2012Gerardo J RmÎncă nu există evaluări
- Manual TituladorDocument44 paginiManual TituladorKaori MatsumotoÎncă nu există evaluări
- Determinacion de Metronidazol PDFDocument12 paginiDeterminacion de Metronidazol PDFMiguel Adrian GaonaÎncă nu există evaluări
- Manual Qab BQD 2024-1Document99 paginiManual Qab BQD 2024-1Karla Jimena Cruz RobledoÎncă nu există evaluări
- Practica 3Document8 paginiPractica 3Eduardo HernandezÎncă nu există evaluări
- Titulación ácido-base HCl y NaOHDocument13 paginiTitulación ácido-base HCl y NaOHLuigi BenegasÎncă nu există evaluări
- LABORATORIO N 3 Determinación de Acido Acetico en VinagreDocument14 paginiLABORATORIO N 3 Determinación de Acido Acetico en VinagreGary PlacenciaÎncă nu există evaluări
- Informe Curvas de NeutralizacionDocument11 paginiInforme Curvas de NeutralizacionSOYSUCODEPIÑAÎncă nu există evaluări
- Valoración ácido-base con NaOH y HClDocument8 paginiValoración ácido-base con NaOH y HClCórdova HeidyÎncă nu există evaluări
- Volumetría ÁcidoDocument6 paginiVolumetría ÁcidoDaniel CabeshaÎncă nu există evaluări
- Cuantificación Del Grado Pureza de HCLDocument14 paginiCuantificación Del Grado Pureza de HCLFernanda GómezÎncă nu există evaluări
- Curvas de Valoración Ácido BaseDocument7 paginiCurvas de Valoración Ácido Basemayerlin hoyos doradoÎncă nu există evaluări
- Volumetría de NeutralizaciónDocument69 paginiVolumetría de NeutralizaciónJhossy Aisha NyaÎncă nu există evaluări
- Alcalimetria y AcidimetriaDocument27 paginiAlcalimetria y AcidimetriaEvhiTovalinoLeonÎncă nu există evaluări
- Guía de Ejercicios y Manual de Laboratorio QUIM 001Document10 paginiGuía de Ejercicios y Manual de Laboratorio QUIM 001Trini JaqueÎncă nu există evaluări
- LauraDocument9 paginiLauraLaura PerezÎncă nu există evaluări
- Constante equilibrio complejoDocument7 paginiConstante equilibrio complejo01001001Încă nu există evaluări
- GUIA de LAB #7 EQUILIB QUÍM BQU01Document12 paginiGUIA de LAB #7 EQUILIB QUÍM BQU01Sebastian MQÎncă nu există evaluări
- Presentacion 2.volumetria Acido - BaseDocument22 paginiPresentacion 2.volumetria Acido - BaseDANIEL VICTOR TRIGOSO LOSTAUNAUÎncă nu există evaluări
- Ácidos y Bases: Reacciones Químicas FundamentalesDocument14 paginiÁcidos y Bases: Reacciones Químicas FundamentalesDaniel CMÎncă nu există evaluări
- CuestionarioDocument13 paginiCuestionarioRodrigo Dalence100% (1)
- Ácidos y bases: definiciones y teorías claveDocument3 paginiÁcidos y bases: definiciones y teorías claveFernando B. Glez.Încă nu există evaluări
- Estandarización Acido BaseDocument6 paginiEstandarización Acido BasejuanÎncă nu există evaluări
- Cuadro ComparativoDocument1 paginăCuadro ComparativoMiriam TenecotaÎncă nu există evaluări
- Práctica #10 Volumetría de Neutralización 1Document3 paginiPráctica #10 Volumetría de Neutralización 1Luis ChaconÎncă nu există evaluări
- Informe 1Document11 paginiInforme 1Diana RamírezÎncă nu există evaluări
- Monografia Metodo WinklerDocument12 paginiMonografia Metodo WinklerVíctor FurbinoÎncă nu există evaluări
- AlcalinidadDocument11 paginiAlcalinidadLeonardoFabioMoralesÎncă nu există evaluări
- Capitulo 15 Ac BaseDocument10 paginiCapitulo 15 Ac BaseAlberto Perez PerezÎncă nu există evaluări
- Presentación Evaluación Estadística de IndicadoresDocument25 paginiPresentación Evaluación Estadística de IndicadoresGabrielaÎncă nu există evaluări
- Informe de Laboratorio - Quimica-Fisica - Patrick2ES PDFDocument7 paginiInforme de Laboratorio - Quimica-Fisica - Patrick2ES PDFMishelle CaveÎncă nu există evaluări