Documente Academic
Documente Profesional
Documente Cultură
Unidad 1. Gases Reales - 2011
Încărcat de
Skimboard Ccs VargasDescriere originală:
Titlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Unidad 1. Gases Reales - 2011
Încărcat de
Skimboard Ccs VargasDrepturi de autor:
Formate disponibile
FISICOQUMICA
FISICOQUMICA
Unidad 1. Gases Reales
Unidad 1. Gases Reales
Profesora: Ing. Eunice De Freitas
Agosto
2010
Universidad Nacional Experimental Politcnica
Antonio Jos de Sucre
Vice-rectorado Lus Caballero Mejas
Departamento de Ingeniera Industrial
Agenda
Agenda
Objetivos de la Unidad Objetivos de la Unidad
Contenido: Contenido:
Leyes de los Gases Leyes de los Gases
Desviaciones respecto del Comportamiento Ideal. Desviaciones respecto del Comportamiento Ideal.
Modificacin de la Ecuacin de Gas Ideal. Modificacin de la Ecuacin de Gas Ideal.
Punto Crtico. Punto Crtico.
Ecuacin de Van Der Waals. Ecuacin de Van Der Waals.
Ley de Los Estados Correspondientes. Ley de Los Estados Correspondientes.
Ecuaciones de Estado. Ecuaciones de Estado.
La Ecuacin del Virial. La Ecuacin del Virial.
Correlaciones Generalizadas de Pitzer. Correlaciones Generalizadas de Pitzer.
Mezclas Gaseosas. Mezclas Gaseosas.
Conclusiones Conclusiones
Objetivos
Objetivos
Determinar el factor de compresibilidad Z, a Determinar el factor de compresibilidad Z, a
partir de las cartas generalizadas, conocidas partir de las cartas generalizadas, conocidas
dos de las propiedades P-V-T. dos de las propiedades P-V-T.
Predecir el comportamiento P-V-T de un gas, Predecir el comportamiento P-V-T de un gas,
utilizando el factor de compresibilidad y las utilizando el factor de compresibilidad y las
cartas generalizadas apropiadas. cartas generalizadas apropiadas.
Predecir el comportamiento P-V-T de un gas a Predecir el comportamiento P-V-T de un gas a
travs de una ecuacin de estado. travs de una ecuacin de estado.
Estimar el comportamiento de una mezcla de Estimar el comportamiento de una mezcla de
gases, a partir de la ley de Dalton, Amagat o gases, a partir de la ley de Dalton, Amagat o
Kay. Kay.
Leyes de los Gases
Leyes de los Gases
Ley de Boyle-Mariotte:
El volumen ocupado por una misma masa
gaseosa, a temperatura constante, es inversamente
proporcional a la presin que soporta.
P x V = Ctte
Ley de Gay-Lussac:
Si la presin se mantiene constante, el volumen de
una masa gaseosa es directamente proporcional a
la temperatura absoluta.
V = T x Ctte
Ley de Avogadro:
Partiendo de la hiptesis de que volmenes iguales
de gases a la misma temperatura y presin
contienen el mismo nmero de molculas. Sostuvo
que:
V = n x Ctte
Ley de los Gases Ideales
Ley de los Gases Ideales
Restriccin: P 15 atm Restriccin: P 15 atm
El valor de la constante resulta de medir el
producto PV de n moles de un gas a muy
baja presin y a temperatura constante.
Lim PV/n =
P 0
Finalmente se obtiene la Ley de los Gases Ideales:
Donde =RT, y R es la Constante Universal de Los Gases.
PV = nRT
PV = RT
_
Gases Ideales
Gases Ideales
Consideraciones:
Consideraciones:
Los gases estn formados por un
Los gases estn formados por un
gran nmero de molculas que se
gran nmero de molculas que se
mueven de modo continuo y
mueven de modo continuo y
aleatorio.
aleatorio.
El volumen de estas partculas es
El volumen de estas partculas es
despreciable frente al volumen del
despreciable frente al volumen del
recipiente.
recipiente.
Las fuerzas de atraccin y repulsin
Las fuerzas de atraccin y repulsin
entre las molculas del gas son
entre las molculas del gas son
insignificantes.
insignificantes.
Las molculas chocan entre s y con
Las molculas chocan entre s y con
las paredes del recipiente en forma
las paredes del recipiente en forma
elstica.
elstica.
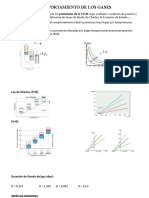
Factor de Compresibilidad. Es la razn
entre el volumen molar medido u
observado y el volumen molar ideal.
Z = Vobs / Videal
Z = PV/RT
Se representa como una funcin de la
presin a temperatura constante.
Desviaciones respecto
del Comportamiento
Ideal
Factor de Compresibilidad
Factor de Compresibilidad
Fig.1. Desviaciones del comportamiento de Gas Ideal a Presiones Elevadas
F
a
c
t
o
r
d
e
C
o
m
p
r
e
s
i
b
i
l
i
d
a
d
(
Z
)
Factor de Compresibilidad
Factor de Compresibilidad
Fig.2. Representacin de Z versus P para el metano a varias temperaturas.
Z =
Fig.3. Diagrama de Factor de Compresibilidad
Generalizado.
Cartas del Factor de
Compresibilidad Generalizado
Fig.4. Diagrama de Z Generalizado de Nelson-Obert. Presiones Altas.
Cartas del Factor de
Cartas del Factor de
Compresibilidad Generalizado.
Compresibilidad Generalizado.
Fig.5. Diagrama de Z Generalizado de Nelson-Obert. Presiones Medias.
Pr=1,75
Tr=1,2
Z=0,64
Cartas del Factor de
Cartas del Factor de
Compresibilidad Generalizado.
Compresibilidad Generalizado.
Fig.6. Diagrama de Z Generalizado de Nelson-Obert. Presiones Bajas.
Cartas del Factor de
Cartas del Factor de
Compresibilidad Generalizado.
Compresibilidad Generalizado.
Fig.7. Diagrama de Z Generalizado con escalas especiales.
Ley de los Estados
Ley de los Estados
Correspondientes
Correspondientes
Todos los gases, comparados a la
Todos los gases, comparados a la
misma temperatura reducida y a la
misma temperatura reducida y a la
misma presin reducida, tienen
misma presin reducida, tienen
aproximadamente el mismo factor de
aproximadamente el mismo factor de
compresibilidad y todos se desvan
compresibilidad y todos se desvan
del comportamiento de gas ideal en
del comportamiento de gas ideal en
un grado semejante.
un grado semejante.
Modificacin de la Ecuacin
Modificacin de la Ecuacin
de Gas Ideal
de Gas Ideal
Factores considerados:
Factores considerados:
Las partculas de un gas tienen volumen
Las partculas de un gas tienen volumen
propio, ocupan una determinada regin
propio, ocupan una determinada regin
del espacio que las contiene, por lo que
del espacio que las contiene, por lo que
reduce el ocupado.
reduce el ocupado.
El efecto de las fuerzas de atraccin a
El efecto de las fuerzas de atraccin a
distancias intermedias da lugar a la
distancias intermedias da lugar a la
reduccin de la fuerza con que las
reduccin de la fuerza con que las
partculas del gas golpean las paredes
partculas del gas golpean las paredes
del recipiente que las contiene y por
del recipiente que las contiene y por
ende, de la presin.
ende, de la presin.
Punto Crtico
Punto Crtico
Fig.8. Diagrama de fases en 3D
El punto crtico
El punto crtico
para la transicin
para la transicin
gas_lquido, es el
gas_lquido, es el
conjunto de
conjunto de
condicio
condicio
-
-
nes fsicas
nes fsicas
en las que la
en las que la
densidad y otras
densidad y otras
propie
propie
-
-
dades del
dades del
lquido y del vapor
lquido y del vapor
se hacen idnticas.
se hacen idnticas.
Fig.9. Diagrama PV de un gas puro
Punto cr ti co
C
En el punto crtico:
En el punto crtico:
Punto Crtico
Punto Crtico
Ecuacin de Estado de
Ecuacin de Estado de
Van der Waals (1879)
Van der Waals (1879)
2
) ( V
a
b V
RT
P
Pc
Tc R
a
2 2
64
27
Pc
RTc
b
8
1
Restriccin: P 30 atm
Los valores de las constantes a y b son
caractersticos de cada gas.
Dichas constantes pueden ser calculadas
a travs de los datos de T y P en el
punto crtico.
Limitaciones de la Ecuacin de
Limitaciones de la Ecuacin de
Van der Waals
Van der Waals
1.
1.
A presiones bajas y volmenes altos:
A presiones bajas y volmenes altos:
Pb y ab/V
Pb y ab/V
2 2
se desprecian, entonces
se desprecian, entonces
PV = RT a/V PV
PV = RT a/V PV
<RT
<RT
2.
2.
A presiones altas y volmenes bajos:
A presiones altas y volmenes bajos:
a/V ~ ab/V
a/V ~ ab/V
2 2
por lo que se anulan, luego
por lo que se anulan, luego
PV = RT + Pb PV>RT
PV = RT + Pb PV>RT
3.
3.
Presiones muy bajas:
Presiones muy bajas:
a/V y b son pequeos PV=RT
a/V y b son pequeos PV=RT
Gas Ideal
Gas Ideal
Ecuaciones de Estado
Ecuaciones de Estado
Ecuacin de Redlich-Kwong
Ecuacin de Redlich-Kwong
) (
) ( 2
1
b V V T
a
b V
R T
P
+
Pc
Tc R
a
2
5
2
42748 , 0
Pc
RTc
b 08664 , 0
No tiene restricciones
Ecuaciones de Estado
Ecuaciones de Estado
Ecuacin de Beattie-Bridgeman
Ecuacin de Beattie-Bridgeman
Las constantes Ao, Bo, C, a y b se encuentran Las constantes Ao, Bo, C, a y b se encuentran
tabuladas para un cierto nmero de gases. tabuladas para un cierto nmero de gases.
,
_
,
_
1
]
1
,
_
+
V
a
Ao
T V
C
V
b
Bo V RT V P 1 1 1
3
2
Restricciones: < 0,8 c
N Constantes: 5 (Ao, Bo, C, b, a)
Ecuaciones de Estado
Ecuaciones de Estado
Forma Reducida de la Ecuacin de
Forma Reducida de la Ecuacin de
Beattie-Bridgeman
Beattie-Bridgeman
( )
[ ]
2 2
1
Ri
Ri
i
R
R
R
V
A
B V
V
E T
P
3
R Ri
T V
c
E
,
_
Ri
V
a
o A A 1
,
_
Ri
V
b
o B B 1
Ci
Ri
V
V
V
Pc
RTc
V
Ci
4758 , 0
o A
18764 , 0
o B
05 , 0
c
1127 , 0
a
03833 , 0
b
Ecuaciones de Estado
Ecuaciones de Estado
Empricas
Empricas
Ecuacin de Benedict-Webb-Rubin
Ecuacin de Benedict-Webb-Rubin
Las constantes Ao, Bo, Co, a, b, c, Las constantes Ao, Bo, Co, a, b, c, y , y , se encuentran se encuentran
tabuladas para un cierto nmero de gases. tabuladas para un cierto nmero de gases.
( )
,
_
,
_
+ + + +
,
_
+
2
2 3 2 6 3 2 2
1
1 1
V
e
V V T
c
V
a
a RTb
V T
Co
Ao RTBo
V V
RT
P
Restricciones: < 1,2 c
N constantes: 8 (Ao, Bo, Co, a, b, c, , )
Ecuacin del Virial
Ecuacin del Virial
En funcin del Volumen Molar
En funcin del Volumen Molar
B, C, D, etc., son denominados Coeficientes del B, C, D, etc., son denominados Coeficientes del
Virial y solo son funcin de la temperatura. Virial y solo son funcin de la temperatura.
( ) ( ) ( )
... 1
3 2
+ + + +
V
T D
V
T C
V
T B
RT
V P
Z
Ecuacin del Virial
Ecuacin del Virial
En funcin de la Presin
En funcin de la Presin
Relacionando ambos conjuntos de
Relacionando ambos conjuntos de
coeficientes:
coeficientes:
... ' ' ' 1
3 2
+ + + + P D P C P B
RT
V P
Z
RT
B
B '
2
2
) (
'
RT
B C
C
3
3
) (
2 3
'
RT
B BC D
D
+
Ecuacin del Virial
Ecuacin del Virial
Para propsitos de ingeniera, para gases a bajas
Para propsitos de ingeniera, para gases a bajas
y a moderadas presiones, dos o tres trminos son
y a moderadas presiones, dos o tres trminos son
suficientes para una aproximacin razonable a
suficientes para una aproximacin razonable a
los valores resultado de las series.
los valores resultado de las series.
Para presiones cercanas a 5 bar, se prefiere
Para presiones cercanas a 5 bar, se prefiere
utilizar la ecuacin del Virial truncada a dos
utilizar la ecuacin del Virial truncada a dos
trminos.
trminos.
Para presiones por encima de 5 bar pero por
Para presiones por encima de 5 bar pero por
debajo de la crtica, los mejores resultados se
debajo de la crtica, los mejores resultados se
obtienen de la ecuacin expresada en volumen y
obtienen de la ecuacin expresada en volumen y
truncada a tres trminos.
truncada a tres trminos.
La desventaja de utilizar la Ecuacin del Virial es
La desventaja de utilizar la Ecuacin del Virial es
la dificultad para calcular los coeficientes sin
la dificultad para calcular los coeficientes sin
recurrir a datos experimentales.
recurrir a datos experimentales.
Pitzer comprob que los datos de presin de vapor de Pitzer comprob que los datos de presin de vapor de
fluidos simples como el Ar, Kr y Xe, estaban fluidos simples como el Ar, Kr y Xe, estaban
contenidos sobre la misma lnea en el diagrama contenidos sobre la misma lnea en el diagrama
(logP (logP
r r
sat sat
vs 1/Tr) y que dicha lnea pasaba por el punto vs 1/Tr) y que dicha lnea pasaba por el punto
definido por logP definido por logP
r r
sat sat
=1 y Tr=0.7 =1 y Tr=0.7
Correlaciones Generalizadas de
Correlaciones Generalizadas de
Pitzer
Pitzer
Fig.10. Logaritmo de la presin de saturacin reducida versus
temperatura reducida.
El factor acntrico (w) se define como la
El factor acntrico (w) se define como la
diferencia logartmica evaluada a la
diferencia logartmica evaluada a la
Tr=0,7.
Tr=0,7.
Existe un valor especfico de factor
Existe un valor especfico de factor
acntrico para cada gas.
acntrico para cada gas.
Pitzer introdujo este tercer parmetro
Pitzer introdujo este tercer parmetro
para contrarrestar las limitaciones del
para contrarrestar las limitaciones del
principio de Estados Correspondientes.
principio de Estados Correspondientes.
Correlaciones Generalizadas de
Correlaciones Generalizadas de
Pitzer
Pitzer
Correlaciones Generalizadas de
Correlaciones Generalizadas de
Pitzer
Pitzer
1.
1.
Segundos Coeficientes del Virial
Segundos Coeficientes del Virial
Restriccin: Vr 2 Restriccin: Vr 2
,
_
,
_
+ +
r
r
T
P
R T c
B P c
R T
B P
R T
V P
Z 1 1
B w B
RTc
BPc
O
+
6 , 1
422 . 0
083 , 0
r
O
T
B
2 , 4
172 , 0
139 , 0
r
T
B
, donde w es el factor acntrico.
Correlaciones Generalizadas de
Correlaciones Generalizadas de
Pitzer
Pitzer
2.
2.
Factor de Compresibilidad
Factor de Compresibilidad
Generalizado
Generalizado
Z Z
o o
y Z y Z
1 1
son funciones de la T son funciones de la T
R R
y la P y la P
R R
Z w Z Z
O
Restriccin: Vr < 2 Restriccin: Vr < 2
Correlaciones Generalizadas de
Correlaciones Generalizadas de
Pitzer
Pitzer
10
Correlacin del Factor de
Correlacin del Factor de
Compresibilidad Generalizado
Compresibilidad Generalizado
Fig.12. Correlacin generalizada para Z
0
, Pr<1
Fig.13. Correlacin
generalizada para Z
0
,
Pr>1
Correlacin del Factor de
Correlacin del Factor de
Compresibilidad Generalizado
Compresibilidad Generalizado
Correlacin del Factor de
Correlacin del Factor de
Compresibilidad Generalizado
Compresibilidad Generalizado
Fig.14. Correlacin
generalizada para Z
1
,
Pr<1
Fig.15. Correlacin generalizada
para Z
1
, Pr>1
Correlacin del Factor de
Correlacin del Factor de
Compresibilidad Generalizado
Compresibilidad Generalizado
Mezclas de Gases
Mezclas de Gases
Ley de Dalton o Ley de La Sumatoria de
Ley de Dalton o Ley de La Sumatoria de
las Presiones Parciales.
las Presiones Parciales.
Presin Parcial: Es la presin que
Presin Parcial: Es la presin que
ejercera un solo componente de una
ejercera un solo componente de una
mezcla gaseosa si ocupara por s solo
mezcla gaseosa si ocupara por s solo
el mismo volumen que ocupa la
el mismo volumen que ocupa la
mezcla, a la misma temperatura que
mezcla, a la misma temperatura que
la mezcla.
la mezcla.
Restriccin: P
Restriccin: P
< 50 atm
< 50 atm
n
i
T
Pi P
1
n
i
T
ni n
1
T i
P y Pi
T
i
i
n
n
y
Mezclas de Gases
Mezclas de Gases
Mtodo Pseudo-crtico o Ley de Kay
Mtodo Pseudo-crtico o Ley de Kay
Restriccin:
Restriccin:
50 atm P 300 atm
50 atm P 300 atm
..... + +
B B A A C
Pc y Pc y P
..... + +
B B A A C
Tc y Tc y T
c P
P
P
R
c T
T
T
R
c P
c RT
V
Ci
ci V
V
V
Ri
Mezclas de Gases
Mezclas de Gases
Ley de Amagat
Ley de Amagat
El volumen total ocupado por una
El volumen total ocupado por una
mezcla de gases es igual a la sumatoria
mezcla de gases es igual a la sumatoria
de los volmenes ocupados por cada
de los volmenes ocupados por cada
gas.
gas.
Restriccin: P
Restriccin: P
>
>
300 atm
300 atm
n
i
T
Vi V
1
n
i
T
ni n
1
T i i
V y V
Conclusiones
Conclusiones
La exactitud de una Ecuacin de Estado en La exactitud de una Ecuacin de Estado en
particular depende de su formulacin funcional, del particular depende de su formulacin funcional, del
gas mismo y de la regin de aplicacin. gas mismo y de la regin de aplicacin.
En muchos clculos de ingeniera, el empleo del En muchos clculos de ingeniera, el empleo del
Factor de Compresibilidad es la tcnica ms Factor de Compresibilidad es la tcnica ms
conveniente y por lo regular ofrece la suficiente conveniente y por lo regular ofrece la suficiente
exactitud. exactitud.
En todo proceso productivo, el conocimiento de las En todo proceso productivo, el conocimiento de las
propiedades P-V-T de los gases, juegan un papel propiedades P-V-T de los gases, juegan un papel
importante en lo que respecta a la Seguridad importante en lo que respecta a la Seguridad
Industrial. Industrial.
S-ar putea să vă placă și
- Apuntes Sobre GasesDocument34 paginiApuntes Sobre GasesAlvaro Ivan Irala Barrios100% (1)
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesDe la EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesÎncă nu există evaluări
- FQ I PQ Gases TCMDocument558 paginiFQ I PQ Gases TCMLeandro MontesÎncă nu există evaluări
- VI-Gases - Quimica IDocument48 paginiVI-Gases - Quimica IJoseph Carlos León TaipeÎncă nu există evaluări
- Diferencias Entre Gas Real e IdealDocument7 paginiDiferencias Entre Gas Real e IdealRosmery Orellana Nina100% (2)
- Gases Reales 20-IiDocument5 paginiGases Reales 20-IiDanny Palma AyalaÎncă nu există evaluări
- 1.2 Gases RealesDocument36 pagini1.2 Gases RealesElizabeth Vivar RojasÎncă nu există evaluări
- 1.2 Gases RealesDocument55 pagini1.2 Gases RealesLuis CONDORI SOTO100% (1)
- Gases RealesDocument6 paginiGases RealesRenato EspinosaÎncă nu există evaluări
- Clase I - Segunda ParteDocument28 paginiClase I - Segunda ParteJuan Manuel AldereteÎncă nu există evaluări
- Term Odin Á MicaDocument18 paginiTerm Odin Á MicaJose Pineda RamirezÎncă nu există evaluări
- Fisicoquimica P2Document13 paginiFisicoquimica P2Paul Silva GalvezÎncă nu există evaluări
- Clase 5Document40 paginiClase 5Frans Erquinio CangalayaÎncă nu există evaluări
- Introducción y Conceptos Básicos Ing. Juan Carlos Valdez LoaizaDocument58 paginiIntroducción y Conceptos Básicos Ing. Juan Carlos Valdez LoaizaSanto 125Încă nu există evaluări
- Clase 2 GasesDocument52 paginiClase 2 GasesPaula MoralesÎncă nu există evaluări
- Gases 2 HojasDocument26 paginiGases 2 HojasHector LuceroÎncă nu există evaluări
- Semana 2 FQ Gases RealesDocument24 paginiSemana 2 FQ Gases RealesJacqueline Machón CamposÎncă nu există evaluări
- 1.2 Gases Reales - AnotacionesDocument39 pagini1.2 Gases Reales - AnotacionesBea EgÎncă nu există evaluări
- Gases Ideales y RealesDocument39 paginiGases Ideales y RealesMaría RicoÎncă nu există evaluări
- Ensayo Gas IdealDocument12 paginiEnsayo Gas Idealjeankarlovelazquez12Încă nu există evaluări
- Quimica Fisica Gases Semana 1Document54 paginiQuimica Fisica Gases Semana 1andrewsslaternovoariosÎncă nu există evaluări
- Gases RealesDocument71 paginiGases RealesDaniel Camilo BustosÎncă nu există evaluări
- Presentación de PowerPointDocument29 paginiPresentación de PowerPointSicomoseaRamiresÎncă nu există evaluări
- Presentación Termo 3 CorteDocument75 paginiPresentación Termo 3 CorteAndrea Chitiva MorenoÎncă nu există evaluări
- Clase 11Document50 paginiClase 11MARIA MAGDALENA PATRICIO DE LA CRUZÎncă nu există evaluări
- Sesión 4 Gases Ideales y RealesDocument8 paginiSesión 4 Gases Ideales y RealesPaola Stefania Villarreal VeraÎncă nu există evaluări
- Unidad 7. Gases IdealesDocument24 paginiUnidad 7. Gases IdealesasimonÎncă nu există evaluări
- Gas Ideal F2Document29 paginiGas Ideal F2AmIn20122Încă nu există evaluări
- Ecuacion de VAn Der WaalsDocument16 paginiEcuacion de VAn Der WaalsJamilLoayzaVelascoÎncă nu există evaluări
- Segundo Trabajo de TermodinamicaDocument18 paginiSegundo Trabajo de TermodinamicaAlfonzo Antonio Natera OrtegaÎncă nu există evaluări
- Gases Reales - USILDocument29 paginiGases Reales - USILjoseÎncă nu există evaluări
- Gases Reales 2 CGTDocument26 paginiGases Reales 2 CGTHector Aliaga TantavilcaÎncă nu există evaluări
- Sustancias PurasDocument64 paginiSustancias PurasJaimeHoÎncă nu există evaluări
- Antologia Unidad 5Document29 paginiAntologia Unidad 5Erika Perez Fernando100% (1)
- Unidad-1 (Subunidad 1.4) PDFDocument27 paginiUnidad-1 (Subunidad 1.4) PDFMiguel S. RodriguezÎncă nu există evaluări
- Propiedades Sustancias Puras 2Document49 paginiPropiedades Sustancias Puras 2jazmin solis hernandezÎncă nu există evaluări
- Clase Gases. Leyes de Los GasesDocument42 paginiClase Gases. Leyes de Los GasesEMILIO RODRIGUEZ CALDERONÎncă nu există evaluări
- GasesDocument11 paginiGasesSofia Belén Da SilvaÎncă nu există evaluări
- Trabajo de Termo Propiedades ResidualesDocument25 paginiTrabajo de Termo Propiedades ResidualesLuis Gamero50% (2)
- Comportamiento de Los GasesDocument25 paginiComportamiento de Los GasesERIKA LOZADA RUSSELÎncă nu există evaluări
- Comportamiento de Los GasesDocument25 paginiComportamiento de Los GasesElsa Marzana SanizoÎncă nu există evaluări
- Clase+2 TD 2022Document34 paginiClase+2 TD 2022patriarca28Încă nu există evaluări
- IntroIQ Clase 17 y 18Document27 paginiIntroIQ Clase 17 y 18AR QuímicaÎncă nu există evaluări
- Gases RealesDocument36 paginiGases RealesLucero Fierro100% (1)
- Trabajo de FluidosDocument82 paginiTrabajo de FluidosRoberto Martinez100% (1)
- Clase 2 Gases RealesDocument74 paginiClase 2 Gases RealesPETER ANDRES JACOBO ABURTOÎncă nu există evaluări
- Ecuaciones de Estado para Gases No IdealesDocument29 paginiEcuaciones de Estado para Gases No IdealesFernando LópezÎncă nu există evaluări
- Cuestionarios Practica 5Document8 paginiCuestionarios Practica 5jopisteck01Încă nu există evaluări
- Gases IdealesDocument12 paginiGases IdealesRayulss HernandezÎncă nu există evaluări
- Balance de Materia Y Energia PI-111B: Universidad Nacional de Ingenieria Facultad de Ingienieria Quimica Y TextilDocument38 paginiBalance de Materia Y Energia PI-111B: Universidad Nacional de Ingenieria Facultad de Ingienieria Quimica Y TextilMauricio Norabuena MontesÎncă nu există evaluări
- Termodinamica AplicadaDocument44 paginiTermodinamica AplicadaEric AmaroÎncă nu există evaluări
- Gases RealesDocument12 paginiGases RealesDEXTRE BETETA IVAN JUNIORÎncă nu există evaluări
- 0 - Propiedades Fisicas de Los Fluidos PurosDocument12 pagini0 - Propiedades Fisicas de Los Fluidos PurosMichell Hernández RiveraÎncă nu există evaluări
- GASESDocument11 paginiGASESFaiberth MoscoteÎncă nu există evaluări
- GasesDocument25 paginiGasesFiorella A. Isabella V.Încă nu există evaluări
- Estudio de Los Gases Ideales y Reales - Lab 1Document27 paginiEstudio de Los Gases Ideales y Reales - Lab 1Rosario CcahuanticoÎncă nu există evaluări
- Gases Idea Les 2012Document12 paginiGases Idea Les 2012Fernando ToledoÎncă nu există evaluări
- Taller Cálculos Con Ecuaciones Cúbicas de Estado para PetróleoDocument16 paginiTaller Cálculos Con Ecuaciones Cúbicas de Estado para PetróleoSantiagoVélezSÎncă nu există evaluări
- Calculo Del Factor Z de Los Gases Por ElDocument18 paginiCalculo Del Factor Z de Los Gases Por ElAngel ViberosÎncă nu există evaluări
- Taller - 1 - Analisis - Termico SoluciónDocument8 paginiTaller - 1 - Analisis - Termico Soluciónmario0% (1)
- 11 2014 Ebullicion y CondensacionDocument42 pagini11 2014 Ebullicion y CondensacionAnonymous LZ15h6AyÎncă nu există evaluări
- Termodinamica Ciclo de RankineDocument22 paginiTermodinamica Ciclo de RankineFabricio NuňezÎncă nu există evaluări
- Fisicoquimica Presion de VaporDocument38 paginiFisicoquimica Presion de VaporMaJuTorresRimey0% (1)
- Centrales TérmicasDocument19 paginiCentrales TérmicasNicol ZarzaÎncă nu există evaluări
- Regulación de Potencia y Fallos en Instalaciones FrigoríficasDocument2 paginiRegulación de Potencia y Fallos en Instalaciones FrigoríficasRuben MarichalÎncă nu există evaluări
- Semana 6 - Tema 1Document30 paginiSemana 6 - Tema 1Angelito MuñozÎncă nu există evaluări
- QUIMICA Seminario TermodinamicaDocument22 paginiQUIMICA Seminario TermodinamicaEnrique PGÎncă nu există evaluări
- Pia Termodinamica de Gases y VaporesDocument7 paginiPia Termodinamica de Gases y VaporesJorge AlbertoÎncă nu există evaluări
- Homework #2Document5 paginiHomework #2Anonymous nHya4Z4Încă nu există evaluări
- Practica 1Document13 paginiPractica 1EliasSalvadorLopezÎncă nu există evaluări
- Ejercicios TransferenciaDocument25 paginiEjercicios TransferenciaAdrianJose Lopezpintado67% (3)
- Solucionario Fisicoquimica Tercer ParcialDocument107 paginiSolucionario Fisicoquimica Tercer ParcialGiovana Conde Apaza100% (2)
- Equilibrio Reporte 3Document18 paginiEquilibrio Reporte 3Armando ChavezÎncă nu există evaluări
- P722U WebManual SPN 20120321-1Document35 paginiP722U WebManual SPN 20120321-1Hugo NamoradoÎncă nu există evaluări
- Introducción A La Termotransferencia - Camaraza Medina, YananDocument1.166 paginiIntroducción A La Termotransferencia - Camaraza Medina, YananCristian Clarke C100% (1)
- Taller TermodinámicaDocument9 paginiTaller TermodinámicaMARÍA JOSÉ CARRILLO SOLER100% (1)
- 12-Evaporación Del Licor NegroDocument64 pagini12-Evaporación Del Licor NegroPablo Andres Espinoza Lecaros100% (1)
- 3ra PC de Termo II 2020-IIDocument3 pagini3ra PC de Termo II 2020-IIGeymer Silva CubasÎncă nu există evaluări
- Conservacion de VaporDocument54 paginiConservacion de VaporSony CÎncă nu există evaluări
- Specific HeatDocument2 paginiSpecific HeatSebastian Costa100% (1)
- Problemas Ciclos Otto y DieselDocument3 paginiProblemas Ciclos Otto y DieselJuan Uriel Ibarra0% (1)
- Ciclos de Carnot ExposicionDocument12 paginiCiclos de Carnot ExposicionDaniela Cabascango0% (1)
- Pre Informe Intercambiador Tubos y Coraza FinalDocument9 paginiPre Informe Intercambiador Tubos y Coraza FinalDaniela Gomez GarciaÎncă nu există evaluări
- Automatizacion Planta Piloto IntercambiadorDocument120 paginiAutomatizacion Planta Piloto IntercambiadorSoraya Lesly Villalba SanchezÎncă nu există evaluări
- Calorimetriappt 56894b0f5bedaDocument33 paginiCalorimetriappt 56894b0f5bedaLuis Zambrano PalmaÎncă nu există evaluări
- Cap 4 - Turbulencia - 07 - 2 Por PaginaDocument17 paginiCap 4 - Turbulencia - 07 - 2 Por PaginaJorge Aguilar VillamorÎncă nu există evaluări
- DocumentoDocument12 paginiDocumentoDuvan melendezÎncă nu există evaluări
- PLAN DE DESARROLLO CURRICULAR 5ºsec FISICADocument17 paginiPLAN DE DESARROLLO CURRICULAR 5ºsec FISICAananaurafloresÎncă nu există evaluări
- Tercer Examen de RefrigeracionDocument2 paginiTercer Examen de RefrigeracionJairo Omar Yamunaque AbadÎncă nu există evaluări