Documente Academic
Documente Profesional
Documente Cultură
23525Amino-Acizi, Peptide, Proteine Partea III, Proteine
Încărcat de
Marina GavrilasTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
23525Amino-Acizi, Peptide, Proteine Partea III, Proteine
Încărcat de
Marina GavrilasDrepturi de autor:
Formate disponibile
C.
Csunderlik__
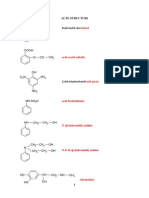
Amino-acizi, Peptide i Proteine __________________1 PROTEINE
Proteinele sunt compui macromoleculari alctuite din amino-acizii naturali care sunt legai prin legturi peptidice CO NH; sunt polipeptide cu mas molecular mai mare de 10.000D i cu structur i funcii mai complexe dect peptidele. Clasificare: Proteinele se clasific n dou clase mari: - proteine simple formate din lanuri polipeptidice alctuite din 23 de aminoacizi proteinogeni (cei 20 codificai n ADN i nc 2 sau 3 care sunt derivai); - proteine conjugate sau proteide, care conin pe lng proteine simple i alte molecule denumite grupe prostetice; Exist diverse tipuri de proteine conjugate care conin alturi de proteine simple i ali compui naturali principali sau secundari i care ndeplinesc funcii importante n organismele vii. Cteva exemple sunt prezentate mai jos: - nucleoproteine, sunt alctutie din proteine legate de acizi nucleici (acizi ribonucleici, ARN) ca grup prostetic. Se gsesc n ribozomi, virui; - glicoproteine, n care proteinele sunt legate de mono- sau oligozaharide; se gsesc n globulinele din snge (-globuline); - fosfoproteine, n care grupa prostetic este acidul fosforic sub form de ester al grupei hidroxil din serin (exemplu: cazeina din lapte); - lipoproteine, n care grupa prostetic este format din lipide neutre, fosfolipide sau colesterol (se gsesc n plasma sangvin i au rol de transport al lipidelor n organism); - hemoproteine, n care grupa prostetic este un complex al ferului bivalent cu un colorant porfirinic (hemul); se gsete n hemoglobin i citocromi i are rolul de a transporta oxigenul de la plmni la esuturi; - metaloproteine, n care grupa prostetic este un metal (Fe, Ca, Zn, Mo) care este cofactor pentru multe enzime (alcool dehidrogenaza, citocrom oxidaza, etc). n funcie de conformaia lor (determinat de geometria legturii peptidice, vezi mai sus), proteinele se mpart n dou clase mari: - proteine fibroase formate din lanuri polipeptidice liniare n care atomii din caten (Csp3 CO N - Csp3) sunt coplanari; lanurile macromoleculelor de polipetid sunt paralele, legate prin numeroase legturi de hidrogen i formeaz filamente lungi sau foi. Ca urmare a acestei structuri, proteinele fibroase sunt insolubile n ap sau n soluii de sruri i rezistente la ageni chimici. Rolul lor principal este de elemente de structur pentru esuturile conjunctive. Exemple de astfel de proteine cu rol de elemente de structur sunt: - -cheratina, se gsete n piele, pr, unghii, coarne, ln; - colagenul, se gsete n tendoane i n oase; - elastina, se gsete n esutul conjunctiv elastic (ligamente); - fibroina, n mtasea natural i n pnza de pianjen; - proteine globulare formate din lanuri polipeptidice n care atomii din caten nu sunt toi coplanari ceea ce determin o aezare spaial n care lanurile sunt ncolcite avnd o form globular compact, aproximativ sferic. Sunt solubile n ap sau n soluii apoase de sruri i formeaz soluii coloidale. Proteinele globulare au funcii importante n organism:
C. Csunderlik__
Amino-acizi, Peptide i Proteine __________________2
- enzimele care sunt biocatalizatori; - hormoni (insulina, tiroglobulina,etc), regleaz i controleaz procesele metabolice; - anticorpii (imunoglobulinele), au rol de protecie n snge mpotriva unor proteine strine organismului; - hemoglobina, albumina seric, mioglobina,etc) sunt proteine de transport pentru oxigen, lipide, acizi grai; - toxinele (toxina botulinic, toxina difteriei, ricinul, veninul) sunt proteine cu rol de protecie pentru bacterii sau alte organisme; n funcie de solubilitatea proteinele globulare se clasific n dou categorii mari: - albuminele, solubile n ap, formnd soluii coloidale; - globulinele, solubile n soluii de sruri. Denaturarea proteinelor Proteinele i pstreaz funciile specifice n condiiile normale din organism (temperatur, pH, concentraia de sruri). La schimbarea acestor condiii are loc i o modificare substanial a activitii lor. Aceast modificare este datorat de obicei unor schimbri n structura lor (mai ales a geometriei datorat structurilor secundare sau teriare). Astfel proteinele globulare cu lanul lor polipeptidic ncolcit n form sferic devine dezordonat cu o form nesferic i care i pierde proprietile fizice I activitatea biologic. Fenomenul se numete denaturarea proteinelor i are loc la nclzire (60700C), tratarea cu acizi sau baze sau cu soluii concentrate de sruri. De cele mai multe ori denaturarea este ireversibil (de exemplu coagularea albuminei din albuul de ou prin fierbere). Uneori proteinele globulare i revin la forma iniial i devine din nou activ biologic (denaaturarea reversibil). Structura proteinelor Structura proteinelor este complex i depinde att de mrimei macromoleculelor de polipeptide, de tipul i secvena amino-acizilor, de configuraia amino-acizilor naturali, de conformaia lanurilor de polipeptide, de legturile de hidrogen intra- i intermoleculare, de prezena mai multor lanuri polipetidice ca i de prezena unor grupe prostetice din proteinele complexe. Exist mai multe nivele de cunoatere i caracterizare a structurii: structura primar, structura secundar, structura teriar i structura cuaternar. Structura primar: Structura primar se refer la tipul numrul i secvana amino-acizilor din lanurile polipeptidice din proteine. Pentru determinarea structurii primare se parcurg urmtoarele etape: - separarea proteinelor de grupele prostetice; - separarea lanurilor de polipetide prin scindarea legturilor covalente care pot s existe ntre lanuri (de exemplu legturile disulfidice S-S- care apar ntre grupele SH din resturile de cistein) - hidroliza parial i total a proteinelor pentru analiza compoziiei proteinei sau a fragmentelor rezultate rpin hidroliza parial; - analiza secvenial a polipeptidelor prin analiza grupelor N- i C- terminale;
C. Csunderlik__
Amino-acizi, Peptide i Proteine __________________3
n final structura primar arat alctuirea lanurilor polipeptidice din proteine i legturile covalente (punile disulfidice) sau alte tipuri de legturi dintre lanurile de polipeptide i chiar i legturile posibile cu grupele prostetice); Structura secundar: Structura secundar se refer la aezarea spaial a macromoleculelor de proteine sau a unor fragmente de polipeptide. Aezarea spaial este determinat att de configuraia S (L, dup convenia E. Fischer) ct i de posibilitatea formrii legturilor de hidrogen ntre grupele C=O i N-H din legtura peptidic ( N-H..O=C). Astfel de legturi se pot forma intramolecular atunci cnd catena Csp3-NH-CO-Csp3- nu este coplanar, sau intermolecular atunci cnd este coplanar. Structura secundar a fost determinat prin difracie de raze X pe proteine cristalizate de ctre L. Pauling care a studiat care a studiat cele dou tipuri de proteine fibroase naturale (-cheratina i -cheratina). Au fost astfel identificate dou tipuri de structuri secundare care apar n toate tipurile de proteine: Structura sau structura pliat care apare n cazul -cheratinei: n acest caz lanurile polipeptidice sunt liniare (unghiul diedru este de 00) i legturile de hidrogen NHOC sunt intermoleculare, ntre lanurile liniare paralele. Legturile de hidrogen sunt liniare astfel nct dou lanuri polipeptidice legate prin legturi de hidrogen sunt coplanare. Pe de alt parte ntre aceste planuri sunt unghiuri diedre astfel nct structura n ansamblu este pliat:
C. Csunderlik__
Amino-acizi, Peptide i Proteine __________________4
Structura sau elicea (spirala ) Este structara -cheratinei i a proteinelor globulare, n care lanul polipeptidic nu este coplanar, unghiul diedru dintre legturile Csp3-CO-NH i HN-CO-Csp3 este diferit de 0 sau 1800 (este de obicei de 300) astfel inct atomii din caten sunt aranjai pe spiralele
C. Csunderlik__
Amino-acizi, Peptide i Proteine __________________5
unei elice. Datorit configuraiei S (L) a amino-acizilor naturali elicea este dreapt sau (n sensul acelor ceasornicului):
Spirele elicei sunt stabilizte de legturile de hidrogen care se formeaz ntre grupele NH.OC. ntr-o astfel de elice legturile de hidrogen sunt intramoleculare spre deosebire de legturile intermoleculare din sturctura .
n cazul -cheratinei i a altor proteine fibroase aceste lanuri de polipeptide sub form de elice sunt paralele i legate ntre ele i prin legturi de hidrogen intermoleculare formnd structuri mpletite filiforme. n cazul proteinelor globulare care prezint predominant structuri de elice , aceste elice devin ncolcite n structuri supramoleculare (superelice ) care sunt definite ca structuri teriare ale proteinelor globulare.
C. Csunderlik__
Amino-acizi, Peptide i Proteine __________________6
Structurile cuaternare caracterizeaz mai ales propeinele complexe formate din mai multe lanuri polipeptidice i grupe prostetice. Astfel sunt cunoscute n prezent structurile complete (inclusiv cele cuaternare) ale unor enzime, ale hemoglobinei, citocromilor etc.
S-ar putea să vă placă și
- ManualDocument25 paginiManualMarina GavrilasÎncă nu există evaluări
- Barem MSCDocument4 paginiBarem MSCMarina GavrilasÎncă nu există evaluări
- 1223 Anexa 2 - 8729 - 6642 - DistonieDocument27 pagini1223 Anexa 2 - 8729 - 6642 - Distonieandutu1Încă nu există evaluări
- Cap IiiDocument16 paginiCap IiiMarina GavrilasÎncă nu există evaluări
- In Vreme de RazboiDocument1 paginăIn Vreme de RazboiMarina GavrilasÎncă nu există evaluări
- Admitere Medicina Subiecte Cluj PDFDocument5 paginiAdmitere Medicina Subiecte Cluj PDFMarina Gavrilas100% (2)
- COMPU+ÿI CARBONILICIDocument2 paginiCOMPU+ÿI CARBONILICIMarina GavrilasÎncă nu există evaluări
- Alte Structuri1Document4 paginiAlte Structuri1Marina GavrilasÎncă nu există evaluări
- Rezultate Finale Olipiada 9feb 2013Document62 paginiRezultate Finale Olipiada 9feb 2013Marina GavrilasÎncă nu există evaluări