Documente Academic
Documente Profesional
Documente Cultură
Laborator
Încărcat de
Elena SanduTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Laborator
Încărcat de
Elena SanduDrepturi de autor:
Formate disponibile
1.
Scopul lucrarii:
Separarea si purificarea unei substante lichide de impuritati(rasini,
compusi , macromoleculari si alte substante volatile) utilizind
distilarea simpla.
2. Utilaje si materiale:
Balon cu fundul rotund, garniture wrtz,
termometru,refrigerant,alonja recipient,arzator, stativ,alcool
izopropilic, sulfat de natriu anhidru, portelan poros
ecipient
3. !otiuni teoretice:
4. "tructura alcoolic izopropilic:
5. #lcoolul izoproc este un alcool secundar si este un alcool simplu
6. $roprietatile fizice ale alcoolului izopropilic
7. %btinerea alcoolulu izopropilic
8. &odul de lucru
9. 'atele e(perimentale
10. )abelul cu date
*oncluzie
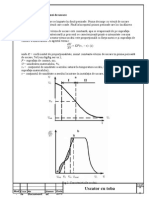
'istilarea este un procedeu de separare sau purificare a sbstantelor lichide.+n
cazul uniu amestec din doua sau mai multe lichide care au diferite puncte de
fierbere devine posibila separarea lor prin distilare. $entru aceasta amestecul de
lichide este incalzit in instalatii speciale pina la fierbere, iar vaporii condensati
se colecteza in recipiente in corespundere cu indicatiile termometrului. $unctul
de fierbere a uniu lichid se numeste temperature la care presiunea vaporilor
saturati deasupra lichidului devine egala cu presiunea atmosferica.
+n dependenta de proprietatile componentelor unui amestec si diferenta dintre
punctele de fierbere a lor se folosesc mai multe feluri de distilari. 'aca avem
scopul de a separa substanta de impuritati putin volatile (punctual de fierbere a
lor difera cu mult mai mult de ,-- * de punctual de fierber a substantei
principale) sau de particule solide , atunci aplicam distilarea simpla. 'istilarea
simpla se poate efectua la presiune atmosferica sau la presiune scazuta . in vid.
'istilarea in vid este utilizata in cazul substantelor care se descompun usor pina
la temperature de fierbere. /a presiune scazuta punctual de fierbere a
substantei se micsoreaza considerabil si lichidul se distileaza la o temperature
mai mica , de acum fara a se descompune. #nalogic, efectul descris poate fi
realizat si la distilarea cu vapori de apa. +n asemenea cazuri compusul organic
poate fi usor antrenabil cu vapori de apa din cauza ca el nu este solubil in apa ,
iar amestecul lui cu apa va fierbe la o temperature mai mica decit punctual de
fierbere atit a substantei organice, cit si a apei. $rocesul este bazat pe legea lui
'alton. $resiunea vaporilor este egala cu suma vaporilor componentilor
amestecului.
Structura alcoolului izopropilic:
#lcoolul izoproc este un alcool secundar si este un alcool simplu.
Obtinerea alcoolului izopropilic:
#lcoolii sunt compusi hidrozolici ce deriva formal de la hidrocarburi saturate, prin
inlocuirea unui sau mai multor atomi de h0drogen cu grupa .%1(hidro(il).
&etoda generala de obtinere, este hidroliza alcalina a derivatilor monohalogenati:
*12 3*13*12 4 !a%1
*12 3*13*12 4!aBr
5 %1
Unde , 56*l,Br,+.
#lcoolii se obtin la hidratarea alchenelor
*1
7
3*13*12 41%1
*12 3*13*12
%1
eactia are loc in prezenta acidului sulfuric concentrate ca formarea
intermediara de hidrogeno sulfat de izopropil (ester anorganic), care ulterior se
hidrolizeaza formind alcool:
*1
7
3*13*12 41%"%2 1
*12 3*13*12
"%2 1
*1
7
3*13*12 41%1
*12 3*13*12 41
7
"%
8
%"%2 1 %1
educerea hidrogenarea aldehidelor , conduce la formarea alcoolilor primari iar
a cetonelor la alcooli secundari:
*12 3*3*12
+
7
H
*12 3*13 *12
%1
$roprietatile chimice ale alcoolului izopropilic
$roprietatile chimice ale alcoolului izopropilic
$roprietatile chimice ale acoolilor sunt de terminate de grupa
functionala .%1 si pot fi impartite in doua categorii si anume:
reactii in care se rupe legatura *3% si se substituie gr
9rupa .%1 si reactii in care se rupe legatura %31 si se
substituie hidrogenul.
eactii cu ruperea legaturii *3%1
eactia cu acizi halogenati
#lcoolii reactioneaza cu acizii halogenati cu obtinerea de
halogenuri de achil si apa.
eactia are loc cu acizii hidra(izilor gazosi in alcool sau prin
incalzirea unei solutii concentrate de acid in apa cu
alcoolul.1idracidul poate fi generat si in mediul de reactie dintr3
o sare a sa si acid sulfuric:
*12 3*13*12
+
8 7
So H NaBr
*12 3*13*12 41
7
%
Br
*13*13*14$*l
:
6*1
2
3*13*1
2
4$%*l
:
41*l
%1
*u acidul clorhidric viteza reactiei creste , daca se lucreaza in
prezenta de ;n*l7 anhidra:
*12 3*13 *12 6*13*141
7
%
eactivitatea alcoolilor cu acizii scade in ordinea:
<*6*3*13%1<*313*13%1<3*%1<*13%1
#stfel, alcoolul izopropilic este trecut in halogenura dw alchil
prin simpla agitare la temperature camerei:
*12 3*13 *12 6 *12 3*13 *12 41
7
%
%1 *l
&ecanismul reactiei de substitutie a grupei %1 cu halogen
depinde de natura alcoolilor, /a alcoolii primar0 substitutia
nucleofila este bimoleculara , iar la cei secundari si in special ,
la cei tertiar0 este monomoleculara.
eactia cu derivati ai fosforului.
#lcoolii pot fi trecuti in derivati halogenati prin tratarea cu
triclorura, tribromura triodura de fosfor. eactia nu se produce
cu transpozitii:
*12 3*13 *12
+ 2 PBr
*12 3*13 *12
%1 Br
*12 3*13 *12
+
2
Pl
*12 3*13 *12
%1 +
=liminarea intermoleculara a apei. >ormarea de eteri.
=liminarea de apa dintre doua molecule de alcool in conditii energice duce in eteri:
eactii datorate legaturii %31
'eprotonare
#lcoolii se pot comporta ca acizi slabi , supusi deprotonarii. eactia de cedare a
protonilor pentru a produce o sare alco(idica este facuta fie cu o baza tare , precum
hidrura de sodium, fie cu sodium sau potasiu
7*12 3*13 *12 47!a67 *12 3*13 *12
%1 %!a
#pa este in p?, cu multi alcooli, deci cu hidro(id de sodium
apare un echilibru de obicei deplasat spre stinga:
*1
2
3*13 *1
2
4!a%1
*1
2
3*13 *1
2
417 %( =chilibru la stinga)
%1 %
!a
+
)otusi , trebuie observat ca bazele folosite la deprotonarea
alcoolilor sunt tari.
Bazele folosite si alcoo(izii obtinuti sunt reactanti chimici
foarte sensibili la umezeala.
"ubstitutie nucleofilica
9ruparea %1 nu este o grupa care se desprinde usor in rectiile
de substitutie nucleofilica , asa ca alcooli neutri nu iau parte la
aceste reactii.)otusi, daca o(igenul mai intii protonat pentru a
forma 3%1
+
7 , gruparea care pleaca (apa)este mult mai
stabile, iar substitutia poate avea loc , un alcool secundar
reactioneaza cu acidul clorhidric cu ajutorul clorurii de zinc.
#lcoolii pot de asemenea fi convergenti in bromuri alchilice
folosind acid hidrobromic sau tribromura de fosfor , de
e(emplu:
*12 3*13 *12 4$Br 2
2 *12 3*13 *12 412 $%2
%1 Br
'eshidratare
#lcoolii sunt substante nucleofilice , deci 3%1
+
7
, poate reactiona cu %1
pentru a produce eteri si apa intr3o reactie de deshidratare , desi aceasta este rareori
folosita , cu e(ceptia fabricarii dietil eterului.&ai folositoare este reactia de
eliminare a alcoolilor pentru a produce alchene. eactia urmeaza regula lui ;aitsev,
care spune ca cea mai stabil alchena se formeaza:
=sterificarea
$entru a forma esteri dintr3un alcool si un acid carbo(0lic , reactia , numita
esterificare >isher, este de obicei realizata cu ajutorul unui catalizator de acid
sulfuric concentrate: *1
*12 3*13 *12 4 *12 3*%%1
*12 3*%%1417 %
%1 *1
$entru ca echilibrul sa fie deplasat la dreapta sis a se obtina un randament mare de
transformare in ester, apa este eliminate, fie printr3un e(ces de 17"%8 fie prin
folosirea aparatului 'ean3"tar@. =sterii mai pot fi obtinuti si prin reactia unui
alcool cu o clorura acida in prezenta unei baze precum piridina.
#lte tipuri de esteri sunt preparati similar3de e(emplu, esterii tosil(tosilati) se obtin
prin reactia unui alcool unui alcool cu clorura de p3toluensulfonil in piridina.
%(idare
#lcoolii secundari se transforma in cetone:
*12 3*13 *12
A BO
*12 3*13 *12
%1 cetona
#lcool secundar
&odul de lucru:
"e masoara 7- ml de alcoolul izopropilic, turnam proba intr3un balon conic uscat
de :- ml capacitate si adaugam cca : g de sulfat de natriu anhidru pentru a usca
lichidul. Uscarea va dura cca 7- min. 'upa inlaturarea umiditatii scurgeti lichidul
in balonul Curtz uscat al instalatiei.#tentie . sulfatul de natriu trebuie sa ramina
in flacon iar lichidul . in balonul pentru distilare.
#daugam la lichidul de distilat ,37 bucatele de portelan poros(centri de fierbere),
astupam balonul cu un dop , prin care trece termometrul , la bratul lateral conectati
refrigerentul , alonja si recipientul , punem in circulatie apa in refrigerant si
incepem incalzirea .
+nregistram punctual de fierbere initial.
/a inceput , se vor distila impuritatile volatile . *olectati3le aparte si se vor
reprezenta o fractiune secundara. *ind temperature nu atinge cu 732* pina la
punctual de fierbere al lichidului de baza, schimbam recipientul si colectam
fractiunea principala . %prim incalzirea atunci , cind termometrul indica o
temperature cu 732 * mai mare decit punctual de fierbere al lichidului de baza. "e
stinge lampa cu gaz , se inlatura baia de apa si se lasa instalatia intacta pina la
racier . &asuram volumul fractiunii secundare, principale si al restului de lichid
ramas in balonul de distilare. +nregistram coeficientul de refractie cu refractometrul
si facem comparative cu cel din indrumar. *alculam partea de volum a fractiunii
principale , secundare, resturilor si procentul de pierdei.
Datele experimentale:
D(ml)
D
dat
67-
+ndice de
refractie
teoretic
+ndice de
refractie
e(perimental
)emperatura
'e fierbere, *
'ensitatea
gEcm
D
,
6
D
D
D
$relucrare matematica a datelor:
v3 fractia secundara
v fractia principala
v3 ce a ramas in balonul de distilat
*oncluzie
+n rezultatul efectuarii lucrarii de laborator am acumulat cunostinte despre
procedeul de separare si purificare a substantelor lichide de impuritati si am format
deprinseri de a lucra cu utilajul din laboratorul de chimie organica. #m efectuat
distilarea simpla a alcoolului izopropilic obtinind in rezultatul final in urma
distilarii simple o pierdere de F.2 G, iar indicele de refractie e(perimental ,.2H:-,
iar cel theoretic ,, 2HHF.
S-ar putea să vă placă și
- Semipreparat FragedDocument22 paginiSemipreparat FragedElena SanduÎncă nu există evaluări
- Turte DulciDocument13 paginiTurte DulciElena SanduÎncă nu există evaluări
- Tema 5Document3 paginiTema 5Elena SanduÎncă nu există evaluări
- Alte DocumenteDocument4 paginiAlte DocumenteElena SanduÎncă nu există evaluări
- Scheme PatiserieDocument7 paginiScheme PatiserieElena SanduÎncă nu există evaluări
- Aluaturi Placinte Cozonaci PascaDocument57 paginiAluaturi Placinte Cozonaci PascaAngel Cornelia96% (23)
- CiupercileDocument15 paginiCiupercileElena SanduÎncă nu există evaluări
- Semipreparat FragedDocument22 paginiSemipreparat FragedElena SanduÎncă nu există evaluări
- Intreprindere Specializata Gratar Fantastic Cu Capacitatea de 100 LocuriDocument32 paginiIntreprindere Specializata Gratar Fantastic Cu Capacitatea de 100 LocuriElena SanduÎncă nu există evaluări
- ManagmDocument12 paginiManagmElena SanduÎncă nu există evaluări
- Lab 2 Distilarea FractionaraDocument6 paginiLab 2 Distilarea FractionaraElena SanduÎncă nu există evaluări
- Note de CursDocument35 paginiNote de CursElena SanduÎncă nu există evaluări
- Modificarea Masei Și Valorii Nutritive A Cartofilor111Document10 paginiModificarea Masei Și Valorii Nutritive A Cartofilor111Elena SanduÎncă nu există evaluări
- Laboratorul Chimia OrganicaDocument3 paginiLaboratorul Chimia OrganicaElena SanduÎncă nu există evaluări
- NNNDocument1 paginăNNNElena SanduÎncă nu există evaluări
- Calcul Toba de UscareDocument2 paginiCalcul Toba de UscareElena SanduÎncă nu există evaluări
- Calcul Toba de UscareDocument2 paginiCalcul Toba de UscareElena SanduÎncă nu există evaluări
- Proiectouia 2Document5 paginiProiectouia 2Elena SanduÎncă nu există evaluări
- 20 PereDocument1 pagină20 PereElena SanduÎncă nu există evaluări
- 2 BananeDocument1 pagină2 BananeElena SanduÎncă nu există evaluări
- 19fructe SDocument1 pagină19fructe SElena SanduÎncă nu există evaluări
- Tfisa 7 Din Coacaza NeagraDocument1 paginăTfisa 7 Din Coacaza NeagraElena SanduÎncă nu există evaluări
- 4capsune SDocument1 pagină4capsune SElena SanduÎncă nu există evaluări
- T Fisa 4 CapsuniDocument2 paginiT Fisa 4 CapsuniElena SanduÎncă nu există evaluări
- BrinzaDocument1 paginăBrinzaElena SanduÎncă nu există evaluări
- CapsuniDocument1 paginăCapsuniElena SanduÎncă nu există evaluări