Documente Academic
Documente Profesional
Documente Cultură
Romanian I-PWG Pharmacogenomics Informational Brochure
Încărcat de
AngelikutzaDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Romanian I-PWG Pharmacogenomics Informational Brochure
Încărcat de
AngelikutzaDrepturi de autor:
Formate disponibile
Aceast brour informativ este destinat
personalului centrului investigaional i al IRB/IEC.
Broura a fost elaborat pentru a descrie aspectele
relevante ale prelevrii i cercetrii ADN-ului uman
n contextul perfecionrii medicamentelor de uz
farmaceutic.
genetic efectuat n scopul diagnosticrii unei boli sau al riscului
de a dezvolta o anumit boal (de exemplu, testul genetic pentru
boala Huntington). PGx studiaz variabilitatea genetic care
determin reacia la medicamente. Aceasta depinde n primul rnd
de cile legate de metabolismul medicamentelor, mecanismul de
aciune al medicamentelor, etiologia sau subtipul bolii i reaciile
adverse. PGx se suprapune cu cercetarea geneticii bolilor
deoarece diferitele subtipuri de boli
pot rspunde diferit la
medicamente.
Elaborat de
Industry Pharmacogenomics Working Group (I-PWG)
www.i-pwg.org
Ce este ADN-ul i ce este farmacogenomica?
Celulele corpului omenesc conin acid dezoxiribonucleic
(ADN). ADN-ul este transmis de ctre prini i poart un cod
(sub form de gene), care determin aspectul fizic (fenotipul) i
alte caracteristici personale. Prin procesul denumit transcriere
genetic, ADN-ul este copiat ntr-o molecul asemntoare,
acidul ribonucleic (ARN), iar n final este tradus n proteine,
de care depinde fiziologia celulei. Variaia natural a ADN-ului
este determinantul major al diferenelor care exist ntre
oameni. Aceast variaie, denumit polimorfism genetic, se
exprim att n gene, ct i n afara genelor, n ntregul genom
uman. Aceast variaie explic, parial, de ce unii oameni fac
anumite boli, iar alii nu, de ce unii oameni rspund mai bine
dect alii la anumite medicamente i de ce unii oameni
dezvolt reacii adverse iar alii nu.
Farmacogenomica (PGx) este un bra al tiinei care folosete informaia
genetic/genomic pentru a nelege mai bine de ce oamenii rspund n mod
diferit la medicamente. Termenii farmacogenomic i farmacogenetic
sunt adesea folosii ca sinonime, dei farmacogenetica se refer n general
la studierea ADN-ului, n timp ce farmacogenomica este un termen mai larg,
ce cuprinde att studiul ADN-ului, ct i al ARN-ului1 i n mod general, pe o
scar mai larg. Cercetarea farmacogenomic este diferit de testarea
1
De ce este important farmacogenomica?
PGx este o metod prin care se studiaz dac un medicament
va fi benefic sau duntor anumitor populatii. Prin identificarea
polimorfismelor genetice care sunt asociate cu eficacitatea i
sigurana
medicamentelor,
PGx
permite
terapii
medicamentoase mai individualizate, bazate pe caracterele
genetice ale pacienilor. Acest lucru este denumit uneori
medicin personalizat. Printr-o mai bun nelegere a
mecanismelor moleculare ale bolilor, PGx deschide oportuniti
de inventare a altor medicamente.
Scopul PGx este s dezvolte medicamente mai sigure,
mai eficiente i s se asigure c pacienii primesc o doz
corect dintr-un medicament corect, la timpul potrivit.
Cum este folosit farmacogenomica n conceperea
medicamentelor?
PGx devine din ce n ce mai mult o component cheie a programelor de
dezvoltare a medicamentelor. Prin folosirea PGx pentru a determina
modul n care medicamentele acioneaz diferit la subgrupuri de pacieni,
dezvoltatorii de medicamente iau decizii mai bune privind medicamentele
care trebuie produse i cum este cel mai bine s le perfecioneze.
Actualmente sunt disponibile tehnologii pentru analizarea simultan a
peste 1 milion de polimorfisme genetice ale genomului uman. Acest lucru
permite identificarea unor noi markeri genetici ai rspunsului la
medicamente i ai bolii, n absena unor cunotine preexistente privind
implicarea cilor specifice.
Cercetarea PGx este folosit actualmente n dezvoltarea medicamentelor
pentru:
Farmacogenomica - deja o realitate pe
etichetele/prospectele medicamentelor
O serie de medicamente au acum instruciuni pe
etichete/prospecte care fie recomand, fie impun un test PGx
cnd este prescris un medicament sau cnd sunt luate decizii
referitoare la dozare. Un exemplu bine-cunoscut este
anti-coagulantul warfarin. Eticheta/prospectul medicamentului
warfarin include actualmente un test PGx pentru a
minimiza riscul de hemoragie excesiv (prospectul US).
Conform FDA, n prezent exist trei categorii de informaii de
PGx pe etichetele medicamentelor:
i) testele necesare pentru prescriere
ii) testele recomandate la prescriere
iii) informaii PGx doar pentru informare.
Pentru o list actualizat de exemple privind modul n care PGx
influeneaz prospectele medicamentelor consultai:
www.fda.gov/Drugs/ScienceResearch/ResearchAreas/Pharmacogenetics/ucm083378.htm
A explica variabilitatea rspunsului la medicamente a
subiecilor din studiile clinice
A aborda problemele clinice urgente, cum ar fi reaciile
adverse neateptate
A determina eligibilitatea pentru studiile clinice (prescreening) n vederea optimizrii design-ului studiului
A dezvolta teste de diagnosticare legate de
medicamente, n vederea identificrii pacienilor care au
o probabilitate mai mare sau mai mic de a obine un
beneficiu n urma tratamentului sau care risc s aib
reacii adverse
A nelege mai bine mecanismul de aciune sau metabolismul medicamentelor noi sau deja existente
A oferi o mai bun nelegere asupra mecanismelor bolii
A le permite medicilor s prescrie medicamentele
potrivite, n doza optim, individualizat pentru fiecare
pacient
Probele de ADN din studiile clinice
o resurs nepreuit
Stabilirea mrimii adecvate a eantioanelor i datele clinice de
nalt calitate reprezint cheia progreselor n domeniul PGx.
Programele pentru dezvoltarea de medicamente sunt, aadar, o
resurs nepreuit i o oportunitate unic pentru cercetarea
deosebit de productiv din PGx. Dei PGx este o tiin care
evolueaz rapid, nelegerea complexitii codului genetic este
abia la nceput. Pe msur ce sunt fcute descoperiri tiinifice,
eantioanele prelevate astzi vor deveni o resurs valoroas
pentru cercetri viitoare.
Acest lucru poate duce n viitor la dezvoltarea unor noi
medicamente care s fie mai potrivite pentru anumii pacieni
sau subtipuri de boli.
Din aceste motive, este vital prelevarea sistematic de probe
de ADN n toate centrele care recruteaz subieci pentru studiile
clinice care includ o component PGx (n cazul n care legislaia
local o permite). Trebuie obinut, de asemenea,
consimmntul pentru conservarea probelor pentru cercetri
ulterioare, dac vor fi obinute beneficii maxime din eantioanele
de ADN donate de subieci. Domeniul de aplicare al cercetrii
care poate fi efectuat att n cursul studiului, ct i ulterior
trebuie definit cu claritate n formularul de consimmnt
informat.
Consimmnt informat
Politicile i reglementrile pentru consimmntul informat,
legal, variaz la nivel naional, de stat i local. Actualmente nu
exist reglementri pe plan internaional care s stabileasc
elementele de baz ale consimmntului informat pentru
cercetarea PGx. I-PWG a publicat un articol privind elementele
consimmntului informat, care trebuie luate n considerare n
studiile de cercetare PGx2. Aceste elemente se bazeaz pe
elementele de baz existente ale consimmntului informat
pentru cercetarea clinic pe subiecii umani3.
Eliberarea rezultatelor cercetrii genomice
subiecilor sau pacienilor n cauz
Politicile privind furnizarea rezultatelor genomice ctre subiecii
unui studiu variaz de la o companie farmaceutic la alta. Exist
multe considerente pe care companiile farmaceutice le iau n
calcul atunci cnd i stabilesc politica de furnizare a rezultatelor
cercetrii PGx subiecilor din studiul respectiv. Acestea includ
i) condiiile n care au fost obinute rezultatele genomice (adic,
3
un laborator local n comparaie cu un laborator de diagnosticare
acreditat), ii) dac rezultatele vor avea un impact asupra ngrijirii
medicale a pacientului, iii) dac este necesar consilierea
genetic, i iv) directivele, politicile, legislaia i reglementrile
internaionale, naionale i locale privind drepturile subiecilor de
a avea acces la datele obinute despre ei. Aceste considerente
sunt abordate n mod detaliat n Renegar et al. 20064.
Intimitatea, confidenialitatea i drepturile pacienilor
O problem care este, n general, perceput ca fiind relevant
pentru cercetarea genetic clinic este riscul asociat cu
divulgarea involuntar sau intenionat i utilizarea greit a
datelor genetice. Dei codificarea probelor a fost considerat n
general adecvat pentru protejarea intimitii pacientului pentru
majoritatea studiilor clinice, companiile i alte instituii implicate
n cercetarea PGx au aplicat de-a lungul timpului o serie de
msuri de precauie suplimentare, care pot fi folosite n mod
individual sau combinat, pentru a reduce i mai mult posibilul
risc de divulgare i folosire necorespunztoare a datelor
genetice. Acestea includ:
i) Etichetarea eantioanelor
Eantioanele de ADN i datele clinice corespondente pot fi
etichetate n mai multe moduri pentru a ajunge la niveluri diferite
de intimitate i confidenialitate pentru pacieni. Definiiile privind
metodele de etichetare sunt oferite n glosar i sunt descrise mai
detaliat n Directiva E151 a ICH. Este important s recunoatem
c exist un compromis ntre nivelul de protecie a vieii private
a pacientului i capacitatea de a efectua aciuni legate de
retragerea consimmntului, returnarea datelor, monitorizarea
clinic, reevaluarea subiecilor dup intervale mari de timp i
adugarea de date noi (consultai Tabelul 1)1. Categoriile de
etichetare Identificat i Anonim descrise n tabel nu sunt
aplicabile, n general, studiilor clinice farmaceutice.
Tabel adaptat dup Directiva E15 a ICH
Categoria de
codificare a
eantioanelor
Legtura dintre elementele personale de
identificare a subiectului i
Datele privind biomarkerul genomic
Trasabilitatea napoi la subiect
(Aciuni posibile, inclusiv, de
exemplu, retragerea eantioanelor
sau returnarea rezultatelor
genomice individuale la cererea
subiectului)
Da (Direct)
Permite identificarea subiecilor
Identificat
Da (Indirect)
Simplu Permite identificarea subiecilor (printr-o
cheie de codificare simpl, specific)
Capacitatea de a efectua
monitorizarea clinic,
reevaluarea subiectului
la intervale de timp sau
adugarea de date noi
Da
Da
Asemntor cu
confidenialitatea i
intimitatea obinuit din
domeniul ngrijirii
sntii
Da
Da
Standard pentru
cercetarea clinic
Da
Protecie sporit a
intimitii i
confidenialitii pentru
un singur cod
Nu
Datele genomice i
eantioanele nu mai
sunt legate de subiect
deoarece Cheia
(Cheile) de verificare
Codificat
Dublu
Anonimizat
Da (Foarte indirect)
Permite identificarea subiecilor (prin dou
chei de codificare specifice)
Nu
Nu permite reidentificarea subiecilor
deoarece cheia (cheile) de identificare a
(au) fost tears /terse
Nivelul de
confidenialitate i
protecie a intimitii
subiectului
Da
Nu
a/au fost tears /terse
Anonim
Nu Elementele de identificare nu sunt
niciodat prelevate i nu se aplic
niciodat chei de codificare. Nu permite
identificarea subiecilor
Nu
Nu
Datele genomice i
eantioanele nu sunt
niciodat legate de
subiect
ii) Separarea datelor i accesul restricionat
Pstrarea documentaiei legate de PGx separat
de alte nregistrri medicale.
Restricionarea accesului la date i eantioane cu
ajutorul bazelor de date securizate i a
depozitelor protejate pentru eantioane.
Studiile PGx n dezvoltarea farmaceutic sunt efectuate
n general n laboratoare de cercetare care nu sunt
laboratoare de diagnosticare acreditate. Din acest motiv,
4
datele de cercetare privind PGx nu pot fi folosite de obicei pentru
luarea unor decizii semnificative din punct de vedere clinic sau
corecte privind sntatea sau riscurile privind sntatea
subiectului. n plus, protejarea confidenialitii descris mai sus
servete pentru
protejarea mpotriva divulgrii nepotrivite a
acestor date. Din acest motiv, riscul posibil pentru ca subiectul
s-i piard locul de munc sau asigurarea de sntate/via este
considerat minim. Msurile luate pentru protejarea subiecilor
mpotriva riscurilor estimate trebuie menionate n formularul de
2
consimmnt informat .
iii) Legislaia privind discriminarea genetic
Multe ri i regiuni au adoptat legi pentru protejarea
persoanelor mpotriva discriminrii pe baza informaiilor
lor genetice. De exemplu, Legea american mpotriva
discriminrii genetice (GINA)5, 6 servete la protejarea
pacienilor mpotriva discriminrii cnd
ncheie
o asigurare medical sau cnd se angajeaz, pe
baza genomului unei persoane. Legislaia evolueaz
continuu pe baza considerentelor sociale, etice i
legale. O list de exemple este actualizat periodic pe
website-ul: http://www.i-pwg.org
Legi i reglementri naionale specifice privind
prelevarea de ADN
Prelevarea de mostre de ADN n studii cinice este simpl
n majoritatea jurisdiciilor. Totui, unele ri au legi i
reglementri specifice privind prelevarea, etichetarea,
depozitarea, exportul, returnarea rezultatelor i/sau
folosirea mostrelor de ADN. Procesele de prelevare a
mostrelor de ADN trebuie s respecte ntotdeauna
reglementrile rii/regiunii n care sunt prelevate
mostrele respective. Actualmente se fac eforturi pentru
mbuntirea armonizrii i standardizrii reglementrilor
i practicilor aplicabile colectrii mostrelor de ADN.
Totui, s-ar putea s treac mult timp pn se va ajunge
la un consens internaional. Dat fiind c legile i
reglementrile locale naionale specifice evolueaz n
permanen, se recomand verificarea cu regularitate a
acestor legi i reglementri pentru jurisdicia n care este
acordat consimmntul pentru prelevarea ADN-ului.
Autoriti de reglementare
Folosirea
informaiilor
PGx
pentru
mbuntirea
raportului riscbeneficiu pentru pacient n administrarea
unui medicament este ncurajat din ce n ce mai mult de
autoritile de reglementare n domeniul sntii.
5
Autoriti cum ar fi FDA (SUA Administraia Alimentelor i
Medicamentelor),
EMEA
(Agenia
European
pentru
Medicamente), MHLW (Ministerul Muncii, Sntii i Proteciei
Sociale Japonia) i ICH (Conferina Internaional privind
Armonizarea Cerinelor Tehnice pentru nregistrarea Produselor
Farmaceutice de Uz Uman) joac un rol cheie n obinerea de
progrese n acest domeniu tiinific privind modul n care acesta
este aplicat n dezvoltarea farmaceutic. Un numr semnificativ
de directive de reglementare i lucrri conceptuale au fost emise
deja 1, 3, 7-18
sunt disponibile prin: http://www.i-pwg.org.
i
Prelevarea de mostre de ADN a devenit o component cheie a
evoluiei medicinii clinice. Se anticipeaz c autoritile de
reglementare ar putea, eventual, solicita date privind PGx
19
relevante la aprobarea de medicamente .
Unde pot fi obinute informaii suplimentare
Cteva organizaii specializate contribuie la promovarea adoptrii
PGx n medicina clinic i ngrijirea medical. A fost creat o
gam larg de resurse educaionale legate de PGx care sprijin
profesionitii din domeniul medical, oamenii de tiin ai IRB/IEC
i pacienii i sunt disponibile i pentru public. Multe dintre aceste
organizaii i resurse sunt disponibile pe website-ul I-PWG:
http://www.i-pwg.org.
Ce este Industry Pharmacogenomics Working
Group (I-PWG)?
Industry
Pharmacogenomics
Working
Group
(I-PWG)
(fosta
Pharmacogenomics Working Group) este o asociaie voluntar de
companii farmaceutice angajate n cercetarea PGx. Activitile
grupului
vizeaz
subiecte
necompetitive
educaionale,
informative, etice, legale i de reglementare. Grupul ofer
informaii i opinii ale specialitilor privind aceste subiecte i
sponsorizeaz programele educaionale/informaionale pentru o
mai bun nelegere a cercetrii PGx pentru acionarii cheie. IPWG interacioneaz cu autoritile de reglementare i politicile
grupului pentru a asigura alinierea. Informaii suplimentare despre
I-PWG sunt disponibile la: http://www.i-pwg.org.
Glosar
Refer ences
Datele i mostrele identificate: Datele i mostrele identificate sunt etichetate
1. ICH E15 - Definitions for Genomic Biomarkers, Pharmacogenomics,
cu elemente de identificare personal cum ar fi numele sau numere de
identificare (de exemplu, numrul asigurrii sociale sau al asigurrii naionale).
Folosirea datelor i mostrelor identificate permite monitorizarea clinic i
Pharmacogenetics, Genomic Data and Sample Coding Categories. April 2008.
(Accessed at:
urmrirea subiecilor i nu sunt considerate n general adecvate pentru scopurile
studiilor clinice n dezvoltarea medicamentului. (Nu este aplicabil n general
PGx din cadrul studiilor clinice farmaceutice).
and at: http://www.ich.org/LOB/media/MEDIA3383.pdf)
Datele i mostrele codificate: Datele i mostrele codificate sunt etichetate cu
http://www.fda.gov/OHRMS/DOCKETS/98fr/FDA-2008-D-0199-gdl.pdf
2. Anderson DC, Gomez-Mancilla B, Spear BB, et al. Elements of informed
consent for pharmacogenetic research; perspective of the pharmacogenetics
working group. Pharmacogenomics Journal 2002;2(5):284-92.
cel puin un cod specific i nu poart niciun element de identificare personal.
3. ICH E6(R1) - Guideline for Good Clinical Practice. June 1996.
Datele i mostrele codificate cu un singur cod: sunt etichetate de obicei
cu un singur cod specific. Stabilirea unei legturi ntre date sau mostre i o
(Accessed at: http://www.ich.org/LOB/media/MEDIA482.pdf)
anumit persoan este posibil cu ajutorul unei chei de codificare simple.
4. Renegar G, Webster CJ, Stuerzebecher S, et al. Returning genetic research
results to individuals: points-to-consider. Bioethics 2006;20(1):24-36.
Datele i mostrele codificate cu dou coduri (de-identificate): sunt
etichetate iniial cu un cod specific simplu i nu poart niciun element de
identificare personal. Datele i mostrele sunt apoi re-etichetate cu un al
doilea cod, care este legat de primul cod prin intermediul unei a doua chei de
codificare. Prin folosirea ambelor chei de codificare este posibil stabilirea
unei legturi ntre date sau mostre i o anumit persoan. Folosirea celui deal doilea cod asigur protecia sporit a confidenialitii i intimitii pentru
subieci fa de folosirea unui singur cod.
Datele i mostrele anonimizate: Datele i mostrele anonimizate sunt iniial
codificate simplu sau dublu, dar legtura dintre elementele de identificare a
persoanelor i codul unic (codurile unice) este tears ulterior. Dup tergerea
legturii nu mai este posibil stabilirea unei legturi ntre date i mostre i
subiecii individuali prin intermediul cheii (cheilor) de codificare. Anonimizarea
are rolul de a preveni reidentificarea subiecilor.
Datele i mostrele anonime: Datele i mostrele anonime nu sunt etichetate
niciodat cu identificatori personali
cnd sunt prelevate iniial i nu este
generat nicio cheie de codificare. Din acest motiv, nu exist posibilitatea
realizrii unei legturi ntre datele genomice i mostrele subiecilor individuali.
Din cauza restriciilor privind capacitatea de a corela datele clinice cu mostrele
respective, ele sunt n general prea puin utile pentru cercetarea PGx. (Nu sunt
aplicabile n general PGx din cadrul studiilor clinice farmaceutice).
5. Genetic Information Nondiscrimination Act (GINA): 2007-2008.
(Accessed at: http://www.genome.gov/24519851)
6.
Hudson KL, Holohan MK, Collins FS. Keeping pace with the times--the
Genetic Information Nondiscrimination Act of 2008. New England Journal of
Medicine 2008;358(25):2661-3.
7. EMEA CHMP Reflection Paper on Pharmacogenomics in Oncology - Draft.
2008. (Accessed at:
http://www.emea.europa.eu/pdfs/human/pharmacogenetics/12843506endraft.pdf)
8. EMEA CHMP Position Paper on Terminology in Pharmacogenetics. June
2003. (Accessed at:
http://www.tga.health.gov.au/docs/pdf/euguide/emea/307001en.pdf)
9. EMEA CHMP Reflection Paper on the Use of Pharmacogenetics in the
Pharmacokinetic Evaluation of Medicinal Products. May 2007. (Accessed at:
http://www.emea.europa.eu/pdfs/human/pharmacogentics/12851706enfin.pdf)
10. EMEA CHMP Guideline on Pharmacogenetic Briefing Meetings. November
2006. (Accessed at:
http://www.emea.europa.eu/pdfs/human/pharmacogenetics/2022704en.pdf)
11. EMEA CHMP Reflection Paper on Pharmacogenomic Samples, Testing,
and Data Handling. November 2007. (Accessed at:
15. FDA Companion Guidance - Pharmacogenomic Data Submissions - draft.
August 2007. (Accessed at:
http://www.emea.europa.eu/pdfs/human/pharmacogenetics/20191406en.pdf)
http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm079855.pdf)
12. EMEA CHMP Reflection Paper on the Use of Genomics in Cardiovascular
Clinical Intervention Trials. November 2007. (Accessed at:
http://www.emea.europa.eu/pdfs/human/pharmacogenetics/27878906enfin.pdf)
16. FDA. FDA Guidance - Pharmacogenetic Tests and Genetic Tests for
Heritable Markers. June 2007. (Accessed at:
13. EMEA CHMP Biomarkers Qualification: Guidance to Applicants. 2008.
17. FDA Guidance - Pharmacogenomic Data Submissions. March 2005.
(Accessed at:
(Accessed at:
http://www.emea.europa.eu/pdfs/human/biomarkers/7289408en.pdf)
http://www.fda.gov/downloads/RegulatoryInformation/Guidances/UCM126957.pdf)
14. EMEA CHMP Understanding Terminology Used in Pharmacogenetics July
2004. (Accessed at:
http://www.emea.europa.eu/pdfs/human/pharmacogenetics/384204en.pdf)
www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/ucm077862.htm)
18. EMEA FDA - Processing Joint FDA EMEA VGDSs within the framework of
the Confidentiality Arrangement May 2006. (Accessed at :
http://www.emea.europa.eu/pdfs/general/direct/pr/FDAEMEA.pdf)
19. Rittenhouse P. Framing DNA collection in the clinic. Biocentury, The
Bernstein Report on BioBusiness March 2008:A13-5.
Created by the Industry Pharmacogenomics Working Group Education Task Force
2008 Industry Pharmacogenomics Working Group
All rights reserved.
http://www.i-pwg.or g
S-ar putea să vă placă și
- Progrese În Farmacogenomica Antiretroviralelor: L. NegruţiuDocument10 paginiProgrese În Farmacogenomica Antiretroviralelor: L. NegruţiuAngelikutzaÎncă nu există evaluări
- Fisa TerapieDocument13 paginiFisa TerapieAngelikutzaÎncă nu există evaluări
- 5-Nok Instr 18.10.2011 RDocument4 pagini5-Nok Instr 18.10.2011 RAngelikutzaÎncă nu există evaluări
- Coroane FizionomiceDocument9 paginiCoroane FizionomiceAngelikutzaÎncă nu există evaluări
- Plantatie de Canepa PDFDocument4 paginiPlantatie de Canepa PDFElena_roÎncă nu există evaluări
- Anatomia Chirurgicala A Sistemului Vascular Si LimfaticDocument24 paginiAnatomia Chirurgicala A Sistemului Vascular Si LimfaticAngelikutzaÎncă nu există evaluări
- PP T 0000002Document17 paginiPP T 0000002AngelikutzaÎncă nu există evaluări
- 1 - Vulturar-Cucuianu - Canabis - 471-476Document6 pagini1 - Vulturar-Cucuianu - Canabis - 471-476catalin85Încă nu există evaluări
- Metode de Investigare Ale Glandelor SalivareDocument15 paginiMetode de Investigare Ale Glandelor SalivareAngelikutzaÎncă nu există evaluări
- Toxicologie VeterinaraDocument64 paginiToxicologie VeterinaraOana Voinea92% (13)
- Anti Hi Pert EnsiveDocument19 paginiAnti Hi Pert EnsiveAurelia AvramÎncă nu există evaluări
- Examen ChirurgieDocument79 paginiExamen Chirurgiefrms_jr100% (1)
- Amlodipine Comp 5 Si 10 MG Instr. 22.04.2013 RDocument5 paginiAmlodipine Comp 5 Si 10 MG Instr. 22.04.2013 RAngelikutzaÎncă nu există evaluări
- GITUL1Document69 paginiGITUL1Andrei Usaci100% (2)
- Interactiuni Ligand ReceptorDocument8 paginiInteractiuni Ligand ReceptorAngelikutza100% (1)
- PF Nr-3-4 2011 Art-5Document6 paginiPF Nr-3-4 2011 Art-5AngelikutzaÎncă nu există evaluări
- ATM Si Muschii RidicatoriDocument2 paginiATM Si Muschii RidicatoriAngelikutzaÎncă nu există evaluări
- Raportul Comisiei Parlamentare de Ancheta Privind Situatia Pe Piata FarmaceuticaDocument78 paginiRaportul Comisiei Parlamentare de Ancheta Privind Situatia Pe Piata FarmaceuticaAngelikutzaÎncă nu există evaluări
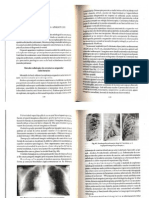
- 4.explorarea Radiologica A Aparatului RespiratorDocument20 pagini4.explorarea Radiologica A Aparatului RespiratorAngelikutzaÎncă nu există evaluări
- Apendicita™Document4 paginiApendicita™Istrati ViorelÎncă nu există evaluări
- Interactiunea Medicamentelor Cu Sucul de GrapefruitDocument3 paginiInteractiunea Medicamentelor Cu Sucul de GrapefruitAngelikutzaÎncă nu există evaluări
- Lucrari Practice ImunologieDocument41 paginiLucrari Practice ImunologieAna Bozbei94% (16)
- Ştiinţele Comportamentului, UMF Cluj-NapocaDocument269 paginiŞtiinţele Comportamentului, UMF Cluj-NapocaVLDs71% (7)
- ATM Si Muschii RidicatoriDocument2 paginiATM Si Muschii RidicatoriAngelikutzaÎncă nu există evaluări
- Sistemul NervosDocument2 paginiSistemul NervosIuliana BicecÎncă nu există evaluări
- Anatomia Functionala A OrgDocument1 paginăAnatomia Functionala A OrgAngelikutzaÎncă nu există evaluări
- Lansare de Carte1Document11 paginiLansare de Carte1AngelikutzaÎncă nu există evaluări
- Examen IgienaDocument43 paginiExamen IgienaAna Clima - Fascian67% (3)