Documente Academic
Documente Profesional
Documente Cultură
II - Olfactiv
Încărcat de
Diana Zețu100%(1)100% au considerat acest document util (1 vot)
12 vizualizări15 paginiTitlu original
II.-Olfactiv
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
100%(1)100% au considerat acest document util (1 vot)
12 vizualizări15 paginiII - Olfactiv
Încărcat de
Diana ZețuDrepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 15
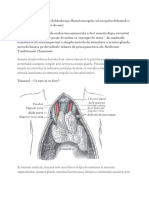
TRUNCHIUL CEREBRAL. NERVII CRANIENI.
II. Sistemul olfactiv
Partea componentă a encefalului care este implicată în transmiterea semnalelor
olfactive este de obicei desemnată cu titlul encefalul olfactiv sau rhinencephalon-ul. Partea
lui principală este bulbul olfactiv și zonele de eferentare ale lui, ceia ce de fapt este aria
retrobulbară sau nucleii olfactori anteriori; tuberculul olfactiv, cortexul prepiriform, cortexul
periamigdaloid și cortexul entorhinal; nucleii complexului amigdaloid. La mamiferele
macrosmatice toate aceste structuri sunt bine dezvoltate. La rozătoare ele ocupă majoritatea
suprafeței bazale a telencefalului.
Omul se referă la ființe microsmatice. Primordiul organului olfactiv se schiţează la
embrionul de 4 săptămîni sub forma a 2 plăci de ectoderm îngroşat, placodele olfactive, ce
sunt situate pe faţa inferioară şi laterală a mugurelul frontal.
Bulbul olfactiv este centrul primar din cadrul sistemului olfactiv și servește drept stație
de retransmitere dintre mucoasa olfactivă și centrele ofactive superioare. Bulbii olfactivi
reprezintă extensii anterioare separate ale telencefalului, care s-au format din evaginații ale
pereților emisferiali. La marsupiene și insectivore bulbul olfactiv conține un ventricul destul
de mare, dar la majoritatea altor mamifere această cavitate este mică sau totalmente
obliterată în vârsta adultă. La majoritatea mamiferelor niște peduncule olfactive scurte
conectează bulbii olfactivi cu emisferele cerebrale, dar la primate, din cauza expansiunii
pronunțate anterioare a lobilor frontali, acești pedunculi s-au transformat în coloane alungite.
La om bulbul olfactiv are forma unui corp turtit ovoid situat pe lama ciuruită a osului
etmoid. Tractul sau pedunculul olfactiv pornește de la polul posterior al bulbului olfactiv
atașându-se de suprafața bazală a lobului frontal al emisferei cerebrale. În locul de conexiune
cu lobul frontal tractul se ramifică în stria medială și stria laterală. Porțiunea învecinată
hotarului striilor, împreună cu banda diagonală a lui Broca formează teritoriul cunoscut sub
denumirea de substanța perforată anterioară. Stria olfactivă medială se extinde anterior de
aria subcalozală pe suprafața medială a lobului frontal; stria olfactivă laterală trece în
direcție laterală apoi ocolește capătul insulei pentru a intra în porțiunea rostromedială a
lobului temporal. O porțiune mică, stria olfactivă intermediană, continuă cursul tractului
olfactiv pentru ca după o distanță scurtă să se răsfire sub formă de evantai în substanța
perfoartă anterioară.
Stria olfactivă laterală pe porțiunea laterală a traiectului său de trecere de la lobul
frontal la lobul temporal este însoțită de gyrus ambiens. Această circumvoluțiune aparține
cortexului olfactiv. În conformitate cu criteriile topografice numai la mamiferele
macrosmatice cortexul olfactiv se divizează în aria prepiriformă și aria piriformă sau
periamigdaloidă.
II.1. Receptorii olfactivi
Elementele receptive ale aparatului olfactiv sunt niște celule bipolare zvelte situate în arii
specializate ale epiteliului pseudostratificat care tapetează cavitatea nazală. Epiteliul olfactiv
ocupă o suprafață de aproximativ 1 cm2 pe fiecare parte a porțiunii postero-dorsale a
cavităților nazale.
Elementele receptoare sunt dispersate printre
celulele de susținere din epiteliiul olfactiv. Fiecare din ele conține două extremități, una mai
mare apicală ce se extinde pe suprafața epiteliului și una mai fină orientată bazal.
Expansiunile terminațiunilor apicale formează protruzii asemănătoare unor noduli de la care
pornesc microvilii plasați în mucoaca ce acoperă epiteliul. Terminațiunile bazale ale
elementelor receptive continuă sub forma unor axoni amielinici extrem de subțiri (0.2-0.4
µm), grupați împreună în benzi mici, olfactory fila, care penetrează lama ciuruită și intră în
bulbul olfactiv. În interiorul bulbului olfactiv fibrele olfactive primare contactează sinaptic
cu mai multe tipuri de neuroni, cei mai remarcabili fiin celulele mitrale. Toate filiile
olfactive împreună formează nervul olfactiv. Substanța neurotransmițătoare în celulele
neurosenzoriale este glutamatul.
În mucoasa nazală olfactivă a omului se conțin aproximativ 6 milioane de neuroni
senzitivi. În aspect morfologic acești neuroni sun uniformi, în aspect molecular fenotipic,
însă, sunt foarte diversificați. O familie mare de multigene, identificată inițial la șobolani,
este respnsabilă de codificarea a mai mult de 1.000 receptori olfactivi diferiți, fiecare dintre
care interacționează cu un ligand odorifici specific. Neuronii senzitivi olfactivi, fiecare cu
receptorii săi speciali, sunt grupați în patru zone ale epiteliului nazal, care parțial se
suprapun. Este necesar a remarca, că axonii celulelor neurosenzoriale care au unul și același
receptor odorific converg spre unul din glomerulii săi specializați.
Celulel neurosenzoriale olfactive au o durată de viață scurtă de aproximativ 30-60 de
zile. Ele sunt în mod continuu înlocuite de celulele epiteliului bazal. În așa mod în decursul
vieții noi generații de axoni cresc spre bulbul olfactiv formând conexiuni sinaptice corecte cu
neuronii din componența lui.
II.2. Bulbul olfactiv
Bulbul olfactiv are o organizare laminară care se observă bine la multe mamifere și fătul
uman, la omul adult, însă, această structură laminară devine mai puțin remarcabilă. În
direcție de la suprafață spre profunzime straturile sunt în ordinea care urmează:
1. Stratul nervului olfactiv care constă din axonii extremi de fini întrețesuți ai celulelor
olfactive neurosenzoriale.
2. Stratul gromelural, care conține glomeruli - îngrămădiri de nauropili specializați în care
terminațiunile arborizate ale fibrelor nervoase olfactive contactează sinaptic cu trei tipuri de
neuroni olfactivi secundari: celulele mitrale, celulele smocuri și celulele periglomerulare.
Primele două tipuri de celulel menționate se află în straturile mai profunde ale bulbului
olfactiv; elementele de pe urmă sunt mici și granulare, și după cum reiese din denumirea lor
se află în vecinătatea glorerulilor. Un om adult de vârstă tânără are aproximativ 8.000 de
glomeruli olfativi. Experiențele cu utilizarea tehnicii de 2-deoxiglucoză au demonstrat, că
proprietățile de conformizare a moleculelor odorifice sunt aranjate într-un model spațial de
activare glomerulară. Odoranții specifici activează în mod consecutiv grupuri mici de
glomeruli învecinați. Împreună, acteste „imagini odorifice” formează o hartă „odotipică” din
stratul glomerular. Baza morfologică a acestei hărți funcționale este constituită din
conexiunile convergente dintre seturile specifice de neuroni și glomerulii „săi” specifici deja
menționați.
3. Stratul plexiform extern care reprezintă în special o îmbinare de terminațiuni dendritice, în
particular ale dendritelor primare și secundare ale celulelor mitrale și ale celulelor smocuri și
din terminațiunile direcționate spre periferie (dendritele efernte) ale celulelor granulare
interne. În afara de aceasta, stratul plexiform conține perikarionul interneuronilor superficiali
ale celulelor somuri de dimensiuni relativ mari.
4. Stratul celulelor mitrale format dintr-un platou de corpi celulari mari ai celulelor mitrale.
Printre corpii celulelor mitrale se observă și corpi ale celulelor granulare.
5. Stratul plexiform intern este compus din dendritele ascendente ale celulelor granulare
profunde, axonii celulelor mitrale și ai celulelor smocuri și colateralele lor recurente și din
axonii din componența fibrelor centrifuge de la alte părți ale encefalului. În afară de aceste
elemente în acest strat se observă perikarionul unor celulele granulare și ale celulelor mari cu
axoni scurți.
6. Stratul celulelor granulare, care constă din câteva zone compacte de celule granulare,
separate una de alta prin benzi de fibre nervoase. La fel se observă aici și corpi dispersați de
neuroni de dimensiuni mari.
7. Zona fibroasă centrală ocupată de eferențele și aferențele bulbului olfactiv. La animalele
care au ventriculul olfactiv persistent acestă zonă se numește periventriculară.
Microcircuitul bulbului olfactiv a fost și este subiectul unor numeroase studii.
Proiecția olfactivă este formată de către celulele olfactive neurosenzoriale primare și
proiecțiile neuronilor olfactivi de ordinul doi, adică celulele mitrale și celulele smocuri. De
regulă celulele mitrale care sunt de dimensiuni mari și celulele smocuri de dimensiuni mai
mici au un singur dendrit sau dendrit central care se ramifică în stratul plexiform extern.
Dendritele principale contactează sinaptic cu fibrele nervului olfactiv și cu dendtitele și
axonii celulelor periglomerulare.
Axonii celulelor mitrale și celulelor smocuri trec radial prin straturile mai profunde ale
bulbului olfactiv. În mersul lor prin bulb ei dau numeroase colaterale care contactează
celulele granulare și interneuronii din profunzime. Axonii principali ai celulelor mitrale și ale
celulelor smocuri mijlocii și profunde obțin teci mielinice și se grupează în benzi care se
îndreaptă în direcție posterioară formând proiecțiile olfactive secundare. Fibrele acestei
proiecții transportă informația olfactivă spre structurile olfactive superioare. Axonii celulelor
smocuri plasate superficial se proiectează spre partea opusă a aceluiași bulb olfactiv,
formând în așa mod un sistem intrabulbar asociativ. Celulele smocuri mijlocii și cele din
profunzime se proiectează spre zone corticale diferite de proiecția celulelor mitrale. Celulele
mitrale folosesc glutamatul în calitate de neurotransmițător atât la terminațiunile sale
dendritice cât și la cele axonale, în timp ce unele din celule smocuri sunt dopaminergice.
În așa mod glomerulul care conține toți axonii senzoriali care converg spre el și toate
celulele mitrale și smocuri cu care contactează formează unitatea funcțională de bază în
procesarea stimulului odorific.
Celulele pperiglomerulare și celulele granulare au unele proprietăți generale comune.
Ambele mențin contacte reciproce dendrodendritice cu celulele mitrale și cu celulele smocuri
și ambele au aceste celule în calitate de scop funcțional principal. Cu toate acestea, celulelel
preriglomerulare și granulare posedă caracteristici destul de diferite, cea mai proeminentă
fiind că primele sunt celulele obișnuite cu axoni scurți, iar ultimele sunt amacrine, adică
lipsite de axoni. Din cauza poziționării sale și dimensiunile mici pe care le au, celulelel
periglomerulare frecvent sunt numite celule granulare superficiale. Dendritele lor intră în
gloemruli, unde recepționează impulsurile impulsurile de la terminațiunile terminațiunilor
nervoase olfactive și la fel formează sinapse „reciproce” bidirecționate cu ramurile dendritice
ale celulelor mitrale și celor smocuri. Caracteristicele ultrastructurale ale acestor contacte
dendrodendritice sugerează că dendritele celulelor mitrale și ale celulelor smocuri au acțiune
excitatorie asupra dendritelor periglomerulare, iar cele din urmă exercită o acțiune inhibitorie
asupra celulelor mitrale și celulelor smocuri. Axonii celulelor periglomerulare se întind pe
lungimea a doi - cinci glomeruli, formând sinapse inhibitorii cu corpii și dendritele altor
celule periglomerulare și cu porțiunile incipiente ale dendritelor primare ale celulelor mitrale
și ale celulelor smocuri. În așa mod, celulele periglomerulae exercită acțiune inhibitorie
asupra celulelor mitrale și asupra celulelor smocuri în două locuri diferite și în două moduri
diferite, și anume prin intermediul conexiunilor dednrodendritice intraglomerulare și prin
intermediul conxiunilor axonodendritice subglomerulare. Populația celulelor periglomerulare
este în aspect neurochimic heterogenă. Cercetătile imunohistochimice au demonstrat că
majoritatea lor sunt GABAergice, multe sunt dopaminergice, unele posedând ambele
proprietăți simultan.
Celulele amacrine granulare (profunde) au câteva dendrite bazale scurte și o dendrită
bazală lungă direcționată periferic ce se ramifică în stratul plexiform extern printre dendritele
secundare ale celulelor mitrale și ale celulelor smocuri. Porțiunile ramificate distale ale
acestor dendrite lungi ale celulelor granulare formează fuse compacte (gemulețe). Celulele
granulare primesc sinapse axonodendritice de la colateralele recurente ale celulelor mitrale și
celulelor smocuri, precum și un important influx de la structurile telencefalului.
Dendritele secundare al celulelor mitre/smocuri și fusele celulelor granulare periferice
sunt bogat interconectate prin intermediul sinapselor dedndrodendritice, organizate în
perechi reciproc orientate. Sinapsele orientate de la celulele mitre/smocuri câtre fusurile
granulare sunt ecitatorii, pe când sinapsele orientate de la gemuleți spre mitre/smocuri -
inhibitorii. Aceste particulare sinpase perechi constituie căi inhibitorii extrem de scurte de la
o celulă mitră spre altă celulă mitră sau de la o celulă smoc spre altă celulă smoc. Buclele
formate de către colateralele celulelor mitre și celor smocuri cu clelulel granulare exercită în
așa mod o acțiune de autoinhibiție ale celor inițiale. Inhibiția realizată prin intermediul
sinapselor granulare-mitrale este una foarte puternică și este o măsură principială de control
a fluxului nervos emergent din bulbul olfactiv. Se consideră că transmiterea este mediată
GABA. Este important a menționa că conexiunea dendrodendritică este unica modalitate de
emisiune a celulelor granulare.
La fel ca și alte regiuni senzitive, bulbul olfactiv este controlat în mod extensiv și înalt
diferențiat de către encefal. Studiile neuroanatomice experimentale au demonstrat că multe
fibre centrifugale, originare din multe și diferite zone ale encefalului trec direct spre bulbul
olfactiv. Multe dintre aceste aferențe bulbare sosesc din structurile olfactiv-referite, având și
o eferență bulbară reciprocă; altele exercită influențe modulatorii generale non-olfactive.
Aferențele „olfacti-referite” iau naștere în cea mai mare parte de la nucleii olfactivi anteriori
și de la cortexul olfactiv. Sursele influențelor modulatorii generale includ neuronii
colinergici din creierul bazal anterior (în particular din nucleul extremității orizontale a
benzii diagonale), neuronii serotoninergici din nucleii dorsali ai rapheu-lui și elementele
noradrenergice din locus coeruleus.
Nucleul olfactiv anterior emite proiecții masive și bilaterale către bulbul olfactiv.
Aceste aferențe centrifugale se termină în cea mai mare parte în stratuul granular și
plexiform intern, unele, însă, coboară spre zona subglomerulară a stratului plexiform extern.
Aferențele bulbare originare din cortexul olfactiv constau din colateralele neronilor
piramidali glutamatergici, care se termină în special în stratul granular.
Aferențele bulbare noradrenergice și serotoninergice se distribuie în special în stratul
celulelor granulare și în stratul plexiform intern, precum și în stratul gromelural. Frbrele
serotoninergice se sfârșesc în interiorul glomerulilor. Aferențele colinergice se distribuie
unifrom printre toate straturile bulbului olfactiv.
În stratul plexiform extern, aferențele colinergice, noradrenergice și altele conectează
cu fusele dendritice ale celulelor granulare. Prin aceste conexiuni strategice se realizează
modularea de inhibiție dendrodendritică a celuleor mitre și a celulor smocuri. Același control
centrifug este exercitat la nivelul stratului glomerular și de celule granulare. În glomeruli
sunt implicate terminațiunile intraglomerulare ale fibrelor serotoninergice.
Cea mai mare parte a straturilor bulbului olfactiv conține un număr de interneuroni de
dimensiuni mijlocii. Aceste elemente sunt de natură inhibitorie, utilizând GABA în calitate
de neurotransmiter, realizând o legătură dintre aferențele bulbare excitatorii și interneuronii
mici, adică celulele periglomerulare și granulare. Se consideră că neuronii de dimensiuni
mijlocii posedă o acțiune de desinhibiție asupra celulelor mitre și a celor smocuri.
În adaos la neurotrasmițătorii clasici după cum sunt acetilcolina, glutamatul și GABA,
precum și monoaminele dopamina, noradrenalina și serotonina, multe neuropeptide au fost
identificate în interiorul bulbului olfactiv. Multe dintre aceste neuropetide sunt co-localizate
cu neurotransmițătorii clasici. Pot fi menționate următoarele combinații: glutamatul +
carnozina în interiorul celulelor neurosenzoriale, glutamatul + substanța P în celulel smocuri,
GABA + enkefaline în celulelel periglomerulare și granulare. Suplimentar au fost identificați
în cadrul aferențelor bulbului olfactiv substanța P și luteinizing hormone-releasing hormone
(LHRH). Se consideră că toate aceste substanțe sunt implicate în transmiterea non-sinaptică
și de volum.
II.3. Proiecțiile olfactive secundare și locurile de terminațiune ale lor
Axonii neuronilor de proiecție din bulbul olfactiv trec în direcție occipitală prin bulbul
olfactiv și se distribuie către arii olfactive secundare variate. Stria olfactorie medială nu
recepționează careva fibre olfactive secundare. După ce trimit fibre către nucleul olfactiv
anterior și tuberculul olfactiv toate proiecțiile olfactive secundare intră în componența striei
olfactive laterale. Urmând calea acestei strii, fibrele ajung la cortexul prepiriform,
periamigdaloid și entorhinal și la nucleul amigdalod cortical, unde se și termină.
La primate, iclusiv și la oameni, nucleul olfactiv anterior este unicul slab dezvoltat și
constă din gurpuri mici de neuroni situația în partea caudală a bulbului olfactiv, în
pedunculul olfactiv și în aria unde pedunculul conectează cu emisfera cerebrală. La
mamiferele macroosmatice nucleul formează un inel care înconjoară partea caudală a
ventriculului olfactiv și tentoriumului lui, separând bulbul olfactiv de restul structuriloe
olfactive.
Tuberculul olfactiv reprezintă o structură ambiguă și enigmatică. La mamiferele
macrosmatice el reprezintă o structură proeminentă de la baza emisferelor, care o structură
trilaminară distinctă. În pofida structurii aparent corticale, tuberculul olfactiv are mai multe
trăsături comune cu structurile adiacente ale striatumului. Ambele structuri posedă o
colorație intensă proprie acetilcolinesterazei, caracteristică neuronilor colinergici intrinseci,
iar straturile profunde ale tuberculului conțini numeroși neuroni de dimensiuni mijlocii, mai
mult proprii tipurilor celulare striatale. Corpurile acestor elemente formează numeroase
podețe celulare care leagă în mod direct cu nucleul accumbens și putamenul caudat. Mai
mult decât atât, regiunea striatală ventrală și tuberculul olfactiv receționează proiecții
dopaminergice puternice din aria tegmentală ventrală.
Tuberculul olfactiv și partea adiacentă a substanței nenumite și nucleul benzii
diagonale conțin reuniuni de neuroni mici cunoscute sub denumirea de insulele lui Callenja.
Aceste insule primesc fibrele terminale și vomeronazale ale nervului. La șobolan inulele lui
Calleja conțin receptori pentru estrogerni și celulel care produc LHRH și de aici se consideră
că sunt implicate în funcția reproductivă.
Cu toate că la om tuberculul olfactiv este slab dezvoltat, trei straturi prezente la
animalele macrosmatice se disting destul de bine. Ele includ: stratul fibros plexiform
superficial, stratul mediu compact constituit din celulel piramidale și elipsoide și stratul
celulelor multiforme elipsoide din profunzime. Tuberculul olfactiv este situat imediat îndată
după bifurcația striei mediale și laterale, făcând parte din spațiul anterior perforat (sau
substanța sau aria). Această arie este caracterizată de prezența unor vase penetrante mici.
Când aceste vase sunt extrase, în locul lor rămân orificiile, de unde vine și denumirea zonei
respective. Omologul tuberculului olfactiv la mamiferele macrosmatice se învecinează cu
cea mai mare parte din hotarul rostral al benzii diagonale.
Tuberculul olfactiv recepționrază fibre senzoriale de la bulbul olfactiv și fibre
asociative de la cortexul olfactiv primar.
Cortexul olfactiv primar este cea mai mare parte dintre ariile olfactive. După cum a
fost anterior menționat, el se subîmparte în aria prepiriformă și piriformă (sau
periamigdaloidă). În unele publicații recente se propune a reuni ambele zone sub denumire
de cortex piriform.
Cortexul olfactiv primar are multe trăsături comune cu neocortexul, dar spre deosebire
e acesta este construit mult mai simplu, fiind construit numai din trei, dar nu din șase straturi.
Unii autori îl consideră cel mai bătrân în aspect filogenetic sector al cortexului, de unde și
denumirea de palleocortex. Mai mult decât atât, se consideră că cortexul olfactiv a dat
naștere neocortexului în procesul evoluției.
Cortexul olfactiv primar conține, deci, trei straturi de obicei desmnate ca stratul I, II și
III. Stratul I este stratul plexiform superficial, care conține doar corpuri neuronale rar
dispersate. El este compus în cea mai mare parte din axoni orientați tangențial și expansiuni
dendritice ascendente ale celulelor piramidale și semilunare. Stratul plexiform se subdivide
în stratul Ia, o lamină superificală dominată de fibre aferente venite de la bulbul olfactiv și
stratul Ib, o lamină profundă constituită în special de fibre asociative venite din alte părți ale
cortexului olfactiv primar. Stratul II este compus din corpi neuronali plasați foarte compact.
El se subdivide în stratul superficial IIa în care sunt concentrate celulele semilunare și stratul
IIb în care predomină corpi celulelor piramidale. Stratul II este compus din celulle aranjate
într-o densitate moderată. El conține neuroni piramidali, care tind să se concentreze în
porțiunea superficială și neuroni multipolari, care au tendință de a se plasa în porțiunea mai
profundă.
Neuronii cortexului olfactiv primar pot fi clasificați în două tipuri: celulel piramidale
și non-piramidale. Se disting două populații de celule piramidale tipice: celulele piramidale
superficiale, care își au corpii în stratul IIb și celulele piramidale profunde, ai căror corpi se
conțin în stratul III. Toți neuronii piramidali au smocuri dendritice bazale și apicale, în timp
ce lungimea tunchirilor dendritice apicale fiind determinat de profunzimea aflării corpului
lor. Axonii celulelor piramidale descend radial prin stratul III și dau naștere unor numeroase
colaterale. Colateralele scurte se ramifică în toate direcțiile, stabilind sinapse cu neuronii de
ambele tipuri: piramidali și non-piramidali. Colateralele lungi ascensionează spre stratul
plexiform superficial, unde preiau o direcție tangențială. Colateralele lungi ale neuronilor
piramidali situați în partea anterioară a cortexului olfactiv primar trec spre cortexul olfactiv
posterior, care se concentrează în porțiunile superficiale ale substratului Ib, în timp ce
colateralele lungi originare din cortexul olfactiv primar posterior se proiectează predominant
către porțiunile profunde ale substratului Ib. Distribuția conexiunilor sinaptice de-asupra
suprafeței de recepție a neuronilor piramidali ai cortexului olfactiv primar se aseamănă foarte
mult cu distribuția din alte părți ale cortexului: sinapse asimetrice în asociere cu vezicule în
jur sunt concentrate pe fusele dendritice, dar lipsesc pe corpul celular; sinapse simetrice cu
vezicule pleiomorfe se găsesc într-o densitate foarte mare în segnementele axonale inițiale și
într-o densitate moderată pe restul suprafețelor rămase, inclusiv perikarionul și ambele
dendrite apicale și bazale. Axonii celulelor piramidale în cortexul olfactiv primar, ca și din
alte părți ale cortexului, formează sinapse asimetrice tipice cu neuronii-țintă ai lor.
După cum a fost menționat anterior, corpii neuronilor semilunari sunt concentrați în
porțiunea superficială a stratului olfactiv primar II. Aceste elemente eimt dendrite sau
grupuri de dendrite de la polii corpilor neuronali semilunari. Aceste dendrite se extind în
direcție periferică și se ramifică în stratul plexiform. Axonii lor descend radial prin cortex
pentru ca să intre în substanța albă subiacentă. Cu toate că dimensiunile celulelor semilunare
diferă mult de dimensiunile celulelor piramidale ele se consideră a fi celulel piramidale
aberante.
Ca și în alte părți ale scoarței cerebrale, celulele non-piramidale formează un grup
celular heterogen. Majoritatea, dar nu toate din celulele respective posedă dendrite netede,
iar cercetările lui Golgi sugerează că axonii lor nu părăsesc cortexul. Acest grup de neuroni
include celulele orizontale mari, situate exclusiv în substratul Ia; celulele bipolare mici sau
celulele cu două smocuri; celulelel stelate mici cu corpi globulari, caracteristice straturilor I
și II; celulel multipolare mari și de dimensiuni mijlocii, care în cea mai mare măsură sunt
situate în stratul III.
Majoritatea celulelor non-piramidale din cortexul olfactiv primar la fel ca și din
regiunea hipocampală și a neocortexului folosesc GABA în calitate de neurotransmiter, fiind
de natură inhibitorie. O excepție notorie este grupul de neuroni multipolari mari cu dendrite
fuziforme, care sunt de natură excitatorie și folosesc glutamatul în calitate de
neurotransmițători.
Sinopsisul circuitelor și sinaptologia cortexului olfactiv primar se prezintă în
următorul mod:
1. Fibrele asociative extrinsece și intracorticale trec în mod tangențial în subzonele distincte
ale stratului I.
2. Sunt prezente celulele piramidale tipice care au dendrite apicale ce se ramifică în stratul I.
Ramificațiile axonale ale acestor celule se răspândesc în interiorul și exteriorul cortexului
olfactiv bilateral; ambele aceste ramificațiiformează un sistem asociativ extensiv, care
formează conexiuni sinaptice cu celulele piramidale și neuronii din circuitul local.
3. Cortexul olfactiv primar conține circuituri neuronale locale de diverse tipuri. Cea mai
mare parte a acestor elemente este inhibitorie de natură și folosește GABA în calitate de
neurotransmițător. Ele formează o parte din circuite care mediază ambele legături de
inhibiție: directă și inversă din cadrul celulelor piramidale.
Cortexul olfactiv primar recepționează proiecții de la neuronii dopaminergici,
serotoninergici și noradrenergici ai trunchiului cerebral. Aceste proiecții monoaminergice
(printre alte funcții posibile) exercită o influență excitatorie asupra unui grup particular de
interneuroni inhibitori, situați în porțiunea superficială a stratului III.
Multe neuropeptide se află în cortexul olfactiv primar, majoritatea cărora se
colacolizează cu GABA. Astfel peptida vazoactivă intestinală și colecistokinina sunt
prezente în anumite subpopulații de celule bipolare.
Deja s-a menționat că axonii celulelor neurosenzoriale care au receptori odorifici strict
specializați converg spre câțiva glomeruli discreți din bulbul olfactiv, iar „locurile de
convergență” a diferitor (>1.000!) receptori odorifici formează harta „odotopică” a stratului
glomerular. O hartă senzorie similară a fost identificată și în cadrul cortexului olfactiv
primar: neuronii piramidali care recepționează fluxurile de la receptorii odorifici particulari
formează clastere discrete. Câteva celule mitrale aflate în strânsă vecinătate sunt axonal
conectate cu cortexul olfactiv primar.
Două structuri aflate la hotar cu cortexul olfactiv primar (nucleul cortical al amigdalei
și cortexul entorhial) la fel primesc proiecții directe de la bulbul olfactiv. La primate,
proiecțiile olfactive se mărginesc cu porțiunile rostrale ale ambelor acestor structuri. În
cortexul entorhinal fibrele olfactive secundare formează un strat fin subpial.
Cortexul olfactiv primar proiectează către câteva arii „de ordin superior”, dar la fel
dau naștere unui sistem substanțial de fibre asociative, care se extind prin toate centrelec care
recepționează proiecții directe de la bulbul olfactiv. Nucleul olfactiv anterior și cortexul
primar olfactiv sunt interconectați prin fibre care trec prin comisura anterioară. Prin
intermediul aceleiași rute, fibrele originare din nucleul olfactiv anterior se proiectează spre
straturile profunde ale bulbului olfactiv contralateral.
II.4. Proiecțiile de mai departe ale informației olfactive
Cortexul olfactiv primar proiectează spre câteva părți ale encefalului anterior, inclusiv
amigdala, hipocampul, hipotalamusul, talamusul dorsal și neocortexul. Fibrele care trec spre
hipocamp și amigdală iau naștere în special de la cortexul amigdaloid și de la porțiunea
adiacentă rostrală, olfactivă a cortexului entorhinal. Aceste fibre formează o parte din căile
polisinaptice prin care rinencefalul conectează cu septul și hipotalamusul. Fibrele care
conectează cortexul olfactiv primar cu hipotalamusul se unesc la fascicolul medial al
creirului anterior și se termină în cea mai mare parte în partea caudală a ariei hipotalamice
laterale. Aceste proiecții olfactohipotalamice sunt implicate în controlul poftei de mâncare și
a comportamentului nutritiv. Proiecția de la cortexul olfactiv primar spre talamusul dorsal
este relativ mică și se termină în special în porțiunea mediană a nucleului mediodorsal.
Această porțiune a nucleului talamic mediodorsal este reciproc conectată cu câteva arii din
cortexul orbitofrontal posterior și cortexul insular rostral. Aceste arii corticale sunt conectate
prin proiecții monosinaptice și în mod direct cu cortexul olfactiv primar, dezvoltate mult mai
puternic decât cele mediate talamic.
Proiecțiile cortexului olfactiv primar se termină în patru arii insulare și două arii
orbitale. Toate aceste arii corticale sunt agranulare sau disgranulare ceia ce înseamnă că aici
lipsește sau este slab dezvoltat stratul IV. Proiecțiile olfactive neocorticale diferă
considerabil de proiecțiile altor modalități senzoriale. În sistemul somatosensorial, sistemul
senzorial vizual și auditiv informația senzitivă și senzorială ajunge la cortex prin sistemul de
retransmitere talamică, iar fibrele talamo-corticale respective se termină în stratul IV bine
diferențiat. În contrast, ariile olfactive neocorticale recepționează majoritatea fluxurilor
senzoriale direct de la cortexul olfactiv primar, fără a trece prin sistemul de retransmitere
talamică, iar aferențele respective se termină în special în stratul I.
Cortexul orbital prefrontal poate fi divizat în 20 arii arhitectonice diferite, care
interacționează între ele prin intermediul unui set special de conexiuni. Această rețea
intrinsecă recepționează impulsuri venite din alte sisteme senzoriale și senzitive: gustative,
somatosenzoriale, vizuale. Diferite conexiuni cortico-corticale dintre aceste arii sunt
implicate în analiza și integrarea senzațiilor legate de nutriție și controlul nutrițional. Influxul
olfactiv și gustativ care converg spre porțiunea caudală a rețelei orbitale sunt implicate în
generarea senzației de savoare asociată cu diferite mâncăruri. Aferențele viscerale conduc
semnalele după cum ar fi distensiunea stomacului sau nivelul de glicemie care predispun
spre injerarea de alimente sau simțul sațietății. Aceste semnale interne servesc în modularea
comportamentului nutrițional. Activitatea neuronilor gustativi este modulată de foame și
satietate. Semnalele somatosenzitive apar și vin de la proiecția feții și capului din aria
somatosenzitivă corticală. Influxurile somatosenzitive orale localizează savoarea în cavitatea
bucală și o direcționează în „sens oral”, ceia ce face posibilă identificarea unificată a
perceției mirosului, gustului și texturii. Neuronii prezenți în aria care recepționează influxul
vizual determină răspunsul selectiv pentru partea de care se află alimentele. În analogie cu
elementele gustative acești neuroni își reduc activitatea senzorială specifică odată cu apariția
simțului de satietate.
Tehnicile imagistice funcționale au fost utilizate pentru identificarea ariilor corticale
activate de către stimuli olfactivi, în conformitate cu care s-au stabilit următoarele:
1. Activitatea cea mai consistentă referită sistemului olfactiv are loc în cortexul olfactiv
primar și orbito-frontal.
2. Stimulul odorific unilateral activează cortexul olfactiv bilateral grație conexiunilor
comisurale existente în comisura anterioară.
3. Stimularea olfactivă bilaterală provoacă un răspuns mai mare în cortexul orbitofrontal
drept, ceia ce sugerează existența unei asimetrii funcționale în procesarea superioară a
informației olfactive, emisfera dreaptă fiind dominantă în acest sens.
4. Focusarea activității olfactive are loc mult mai rostral decât s-a presupus în studiile
anatomice.
5. Activitatea cortexului orbitofrontal depinde de modificările motivaționale care
acompaniază nutriția.
II.5. Sistemul olfactiv accesor și nervul terminal
Sistemul olfactiv accesor, la fel cunoscut și sub denumirea de sistem vomeronazal cuprinde
organul vomeronazal sau organul lui Jacobson; nervul vomeronazal, o parte specială a
bulbului olfactiv; nucleul medial al complexului amigdaloid; o parte a nucleului cuverturii
striei terminale. Cu toate că sistemul olfactiv principal și sistemul olfactiv accesor
demonstrează multe paralelisme în organizarea lor structurală ele sunt morfologic distincte
șu subservesc funcții diferite. Sistemul olfactiv accesor este primar implicat în reglarea
comportamentului reproductiv determinat de feromoni, care sunt mesageri chimici ai altor
membri din aceiași specie.
Organul vomeronazal reprezintă un tub alungit închis într-o capsulă osoasă, localizat
bilateral de-a lungul bazei septului nazal. Tubul se deschide în direcție anterioară prin
intermediul unui duct îngust de la fundul cavității nazale. Celulele receptoare
chemosenzoriale vomeronazale care se mărginesc cu porțiunea medială a organului respectiv
sunt similare celor din epiteliul olfactiv, cu excepția faptului că conțin microvili în loc de
cili. Axonii fini ai aestor receptori se reunesc formând nervul vomeronazal. După ce trec prin
lama ciuruită a etmoidului ei se termină în bulbul olfactiv accesor.
Bulbul olfactiv accesor de regulă este o protruzie mică pe suprafața mediocaudală a bulbului
olfactiv. Structura lui internă în mare măsură repetă caracteristicele bulbului olfactiv
principal, fiind prezente aceleși șapte straturi. Bulbul olfactiv accesor seproiectează pe
complexul amigdaloid și nucleul cuverturii striei terminale prin intermediul trectului olfactiv
accesor. Ultimul inițial este parte componentă a tractului olfactiv lateral, dar devine separat
la nivel caudal.
Sistemul olfactiv accesor este bine dezvoltat la câteva grupuri de mamifere, inclusiv
marsupiene, insectivore și rozătoare. La utimele joacă un rol foarte important în
comportamentul sexual.
Rolul sistemului olfactiv accesor la omul adult a fost determinat prin studii recente și
se reduce la postulatele care urmează.
1. Există dovezi sociologice și comportamentale referitoare la existența comunicării
feromonice dintre oameni.
2. La omul adult există adânciturile vomeronazale în epiteliul pseudostratificat al cărora sunt
plasate celulele presupuse a fi senzoriale, cu toate că nu a fost niciodată demonstrată reunirea
axonilor acetor celule într-un nerv vomeronazal.
3. Bulbul olfactiv accesor la omul adult lipsește. Posibil că semnalele fromonice la om ajung
în SNC printr-o cale alternativ, după cum ar fi nervul terminal.
Nervul terminal, cunoscut și sub denumirea de nerv zero este prezent la toate
vertebratele, inclusiv și la om. Este un nerv cranian care posedă un ganglion și se întinde de
la nas spre regiunile bazale ale creierului anterior. În interiorul craniului fibrele lui formează
un plex larg de-a lungul părții laterale și mediale ale bulbului și pedunculului olfactiv.
Ramurile lui periferice se asociață cu filele olfactive și vomeronazale și se proiectează pe
mucoasa nazală, realizând terminațiuni nervoase libere în epiteliul olfactiv și non-olfactiv,
precum și plexuri dense din jurul glandelor Bowman. Ramificații terminale ale nervului au
fost observate și în pereții vaselor. În direcție centrală nervul terminal este conectat cu
diverse regiuni ale creierului anterior, inclusiv septul, tuberculul olfactiv, aria preoptică și
eminența mediană. O componentă a acestui nerv inttră în creier în imediata vecinătate a
laminei terminale (de unde provine și denumirea acestei regiuni).
Neuronii care generează fibre ce contribuie la formarea acestui nerv sunt dispersați de-
a lungul traiectului lui sau sunt localizați în careva ganglioni. Cel mai mare dintre aceștea
„ganglionul terminal” este situat ventral de hotarul caudal al bulbului olfactiv. În
componența nervului terminal intră neuroni bipolari (fuziformi) și multipolari. Neuronii
multipolari reprezintă elemntele postganglionare autonome care inervează glandele și vasele
nasului. Celulele bipolare își au originea în placheta olfactivă pentru ca să migreze în interior
în procesul de ontogeneză. Ei sunt o parte din sistemul conductiv centripet care vehiculează
mesajele nervoase (posibil chemosenzoriale) de la epiteliul nazal direct spre cortex. Studiile
imunohistochimice au demonstrat că unele din aceste celule și terminațiunile lor conțin
peptida reproductivă LHRH. Există dovezi experimentale care sugerează că nervul terminal
este implicat în reglarea comportamentului reproductiv.
II.6. Examenul clinic al funcției olfactive
Examenul olfacţiei se efectuează într-un birou liniştit, curat, fără miros şi fum de tutun, în
condiţii de temperatură şi umiditate standard. E de dorit ca persoana examinată să nu fumeze
înainte de examinare. Medicul din timp pregătește un set de sticluțe în care se află soluții
odorante pe bază de produse naturale, care pot fi recunoscute de către cel examinat (esență
de trandafir, lavandă, alcool, cafea etc). Se va evita folosirea substanțelor volatile iritante,
cum ar fi amoniacul, camforul, acidul acetic etc, deoarece ele provoacă excitația
terminațiunilor nervoase libere ale nervului trigemen din componența mucoasei nazale.
Drept control va servi o sticluță cu apă, care nu produce nici un miros. Pentru a evita erorile
sticluțele sunt marcate cu cifre (1, 2, 3 etc), legenda marcajului de regulă fiind plasată pe
partea internă a boxei în care ele se păstrează, astfel ca medicul oricând să se poată
documenta vizual. Pacientului i se explică esența examenului, fiind în prealabil întrebat dacă
nu are intoleranță (reacții alergice) la substanțe odorante și dacă la fel simte „mirosurile” cu
ambele nări. Examenul începe cu narina potențial afectată. Examinatorul plasează sticluța cu
stimulul odorant sub narină, în timp ce cealaltă narină se închide prin comprimarea cu
degetul. Pacientul este invitat să miroase substanța și s-o identifice. Aceiași procedură se
repetă și pentru cealaltă narină. În condiții de campanie se vor folosi substanțele aflate la
îndemână (ciocolata, portocală, etc), pacientul fiind rugat să închidă ochii. Dacă substanța
odorantă este identificată și descrisă, chiar dacă și fără denumirea ei exactă, se poate
considera că analizatorul olfactiv la persoana respectivă este relativ intact.
Cu scopuri științifice, sau mai rar pentru testarea persoanelor care în profesia lor fac
determinări olfactive, cu ajutorul unor aparate și tehnici speciale se realizează olfactometria
subiectivă cantitativă și olfactometria obiectivă.
II.7. Semiologia afectării funcției olfactive
Simptomele de suferinţă a mirosului se pot manifesta clinic sub formă de:
1. Anormalităţi cantitative: hipoosmie, anosmie (diminuarea sau pierderea simţului olfactiv)
sau, mai rar, hiperosmie (exagerarea simţului olfactiv: individul percepe, în mod neplăcut de
puternic, concentrații de substanțe volatile de intensitate redusă).
2. Anormalităţi calitative: perceperea greşită a unui miros drept al miros (disosmia sau
parosmia), o formă particulară fiind cacosmia (mirosuri pervertite, de obicei dezagreabile).
3. Halucinaţii olfactive: percepţii olfactive fără cauză obiectivă generatoare; bolnavilor li se
pare că simt existenţa unor mirosuri, de cele mai multe ori dezagreabile.
4. Agnozia olfactivă: pierderea capacităţii de recunoaştere a mirosurilor cauzate de suferinţa
porţiunii centrale a analizatorului olfactiv.
Tulburările simţului olfactiv pot fi cauzate de:
1. Dezvoltarea insuficientă a căilor olfactive, fapt care poate fi un viciu de dezvoltare al
regiunii bazale a encefalului.
2. Leziuni ale mucoasei olfactive (rinite atrofice, sinuzite, obstrucţii nazale, deviaţii de sept,
hipertrofie de cornet, tumori nazale etc).
3. Traumatisme cranio-cerebrale, cu sau fără fracturi ale bazei craniului, care cuprind sau rup
căile olfactive, în special firişoarele nervului olfactiv la nivelul lamei ciuruite a etmoidului.
4. Distrugerea bulbilor olfactivi şi căilor olfactive în contuzii condiţionate de contralovitură
atunci când subiectul cade pe ceafă. Anosmia uni- sau bilaterală poate fi singurul simptom al
traumatismului regiunii orbitale.
5. Inflamaţia sinusului etmoidal, inflamaţia propriu-zisă a etmoidului, meningite bazale
(tuberculoase sau sifilitice).
6. Tumori ale fosei craniene anterioare (tumori orbitofrontale, meningioame olfactive,
meningioame ale aripii mici a sfenoidului etc.).
7. Leziuni ale lobului temporal anterior şi ale bazei lui (tumori).
8. Forma alcoolică a sindromului Korsakoff.
9. Parkinsonism, scleroza multiplă, boala Alzheimer.
10. Intoxicaţii exogene cronice (tabagism, intoxicaţie cu plumb, prizare de cocaină etc).
11. Hipovitaminoze, îndeosebi hipovitaminoză A.
12. Viroze acute, în special gripă, difterie şi parotidită epidemică.
13. Intoxicaţii endogene (uremie, diabet).
14. Diferite boli de sistem ca arterioscleroza sau ateroscleroza, leucemia, anemiile etc.
Anosmia sau pierderea simțului olfactiv în cazul când este unilaterală poate să nu fie
știută de către pacient. Unii pacienți isterici o scot în evidență concomitent cu anestezia,
cecitatea optică și auditivă omolaterală. Pe de altă parte anosmia bilaterală este o plângere
mai frecventă a pacienților, de obicei fiind însoțită de pierderea simțului gustativ (aguesia).
Acest fenomen demonstrează faptul, că simțul gustativ în mare măsură depinde de
particulele volatile din alimente și băuturi care ajung la receptorii olfactivi prin nazofaringe,
iar savoarea fiind o combinație rezultată din miros, gust și aferențe somestezice (tactilitate,
simț termic, stereognozie etc).
În ceia ce privește bolile nazale responsabile de hipo- sau anosmie bilaterală ele se
reduc la situațiile când hipertrofia sau hiperemia mucoasei nazale împiedică substanțele
volatile să ajungă la celulele receptoare. Tabagismul excesiv este cea mai frecventă cauză a
hiposmiei din practica clinică. Rinitele atrofice cronice; sinusitele alergice, vazomotorii sau
infecțioase; polipoza nazală; abuzul de vazoconstrictori aplicați pe mucoasa nasului sunt alte
cauze frecvente ale acestui fenomen clinic. Biopsia mucoasei nazale în cazul rinitelor
alergice demonstrează că celulele epiteliale senzitive sunt prezente, în timp ce cilii care le
aparțin sunt deformați și de dimensiuni reduse, fiind afundate printre alte elemente ale
mucoasei. Virusurile gripei, herpesului simplu și ale hepatitelor pot conduce la hiposmie sau
anosmie prin distrugerea celulelor receptoare. În cazul când sunt distruse și celulele bazale
dereglările olfactive devin permanente. Aceste celule pot să sufere și în rinita atrofică,
radioterapie locală sau o tumoare foarte rară originară din epiteliul nazal -
estezioneuroblastomul. Aici se adaugă și un alt grup rar de maladii în care congenital lipsesc
celulele bipolare sau lipsesc (sunt subdezvoltate) cilii celulelor receptoare. Una din bolile
acestea este sindromul Kallman: anosmie congenitală și hipogonadism hipogonadotropic. O
situație similară se manifestă în sindromul Turner și la albinoși, din lipsa „pigmentului
olfactiv” sau din cauza altor defecte structurale.
Anosmia care urmează după traumatizarea capului în cea mai mare parte apare din
cauza ruperii filamentelor fine ale celulelor bipolare în locul de traversare a lamei ciuruite,
mai ales când impactul este atât de sever încât provoacă fracturi ale etmoidului. Defectul
poate fi uni- sau bilateral. În traumatismele cranio-cerebrale închise anosmia este relativ rară.
Recuperarea olfacției poate interveni într-o măsură mai mare sau mai mică în aproximativ
1/3 din cazuri în decurs de câteva zile sau luni. La un termen de peste 6-12 luni recuperarea
este imposibilă. Chirurgia craniană, hemoragia subarahnoidiană și inflamația cronică a
meningelor pot produce un efect similar.
La femei acuitatea olfactivă variază pe parcursul ciclului menstrual și poate să se
tulbure în timpul sarcinii. Anosmii tranzitorii rezultate din disfuncții senzoro-neurale se
instalează boli metabolice (carență de tiamină și vitamină A), insuficiență adrenală și tiroidă,
ciroză hepatică și insuficiență renală cronică. Un număr mare de agenți toxici, de cele mai
dese ori - solvenți organici (benzene), metale, prafuri, cocaina, corticosteroizi, metotrexatul,
antibioticele aminoglicozidice, tetraciclinele, opiatele și L-dopa pot deregla integritatea
epiteliului olfactiv.
Un număr mare de pacienți cu maladii neuro-degenerative după cum sunt boala
Alzheimer, Parkinson, Huntington, Pick, sindromul de demență parkinsoniană a lui Guam
prezintă hipo- sau anosmie. Cauza instalării nu este elucidată. O parte din bolnavii cu
sindromul Korsakoff de origine alcoolică manifestă defecte în discriminarea substanțelor
odorante. În acest caz anosmia este cauzată de degenerarea neuronilor din structurile
olfactive de ordin superior, inclusiv din nucleii mediali ai talamusului. Anosmia se manifestă
la o serie de pacienți cu epilepsie de lob temporal, în special la cei supuși lobeectomiei
temporale.
În corelație cu alte modalități senzitive-senzoriale olfacția diminuează odată cu vârsta.
Populația celulelor receptoare se supune depleției și în cazul când pierderea este regională,
epiteliul nervos este treptat înlocuit prin epiteliu respirator, care în mod fiziologic servește în
cavitatea nazală pentru filtrarea, umectarea și încălzirea aerului inspirat. Odată cu vârsta se
reduce și numărul de neuroni din bulbul olfactiv.
Anosmia bilaterală în ultimii ani a devenit și obiect de simulare, deoarece multe
companii de asigurări compensează acest defect senzorial. Pe acest motiv se perfectează și
tehnicile olfactometriei obiective, în special potențialele evocate olfactive.
Epiteliul nazal și nervii olfactivi pot fi deteriorați în granulomatoza Wegener și în
craniofaringeom. Meningeomul de fosă olfactivă poate implica bulbul și tractul olfactiv și
extinzându-se posterior implică nervul optic, uneori provocând atrofia papilei nervului optic;
în cazul când este asociată cu edemul papilei nervului optic din partea opusă fenomenologia
poartă denumirea de sindrom Foster-Kennedy. Anevrismele de dimensiuni mari ale arterei
cerebrale anterioare sau ale artrei comunicante anterioare pod produce o constelație similară
de simptome. În cazurile când tumora este doar de o singură parte anosmia este unilaterală,
nu se conștientizează de către pacient, dar este constată în timpul examenului clinic. Copiii
cu meningoencefalocele anterior de obicei sunt anosmici și pot avea nazolicvoree în anumite
poziționări ale capului. În unele cazuri anosmia se instalează și în sindromul de hipertensiune
intracraniană, fără semne de lezare a bulbilor olfactivi.
Termenul de anosmie specifică este folosit pentru cazurile când subiecții nu pot
distinge/recunoaște unele incitații olfactive ușor recunoscute de persoanele sănătoase.
Situația este similară celei de distincție a culorilor, cauza nu este cunoscută. În orice caz
„cecitatea olfactivă” pentru mosc și urină este o maladie moștenită autosom recesiv.
Hiperosmia adevărată rămâne a fi un obiect de discuții. Persoanele nevrotizate pot să
acuze intoleranța pentru substanțe odorante, dar încă nu există dovezi despre modificarea
pragului de sensibilitate la ei. În timpul atacurilor de migrenă, în unele cazuri de meningite
aspetice pacienții sunt deosebit de sensibili nu numai la lumină și sunete, dar și la unele
substanțe odorante.
Disosmia sau parosmia sunt termeni utilizație pentru desemnarea situațiilor când
iritația olfactivă este percepută, dar interpretată eronat. Parosmia poate apărea în rezultatul
unor circumstanțe nazofaringeale locale, după cum ar fi empiemul sinusurilor nazale și
ozena. În unele situații țesutul anormal poate fi sursa odorantă neplăcută, în alte cazuri are
loc afectarea parțială a bulbului olfactiv, în așa mod parosmia fiind de fapt halucinați de
nivelul bulbului olfactiv. Parosmia poate fi unsimptom neplăcut al personaelor de vțrstă
medie și înaintată în stări depresive, atunci când orice aliment este apreciat cu calități
odorante extrem de neplăcute (cacosmie). De obicei cacosmia este însoțită și de cacogeusie -
gust dezagreabil. Baza acestor stă rămâne obscură, de obicei discrimnare senzitivă fiind
intactă.
Tratmentul parosmiei este dificil. Administrarea de antipsihotice arată rezultate
inpredictibile. Eficiența administrării vitaminelor și zincului nu are dovezi. În unele cazuri
rezultate pozitive au fost obținute după anestezii locale repetate ale mucoasei nazale. În
multe cazuri maladia se vindecă spontan. Un grad mic de parosmie nu este o manifestare
patologică. Persistența mirosului neplăcut pentru câteva ore și „dezbaterea” lui de către un
alt stimul odorant este un lucru cunoscut în practica medicale.
Halucinațiile olfactive sunt întotdeauna de origine centrală. Pacientul pretinde că
simte un miros pe care altă persoană nu-l percepe (phantosmia). De cele mai dese ori este
manifestarea accesului de epilepsie temporală („criză uncinată”), în cadrul căruia
halucinațiile olfactive sunt scurte, sunt însoțite de alterarea conștienței și de alte manifestări
epileptice.
Dacă pacientul este convins de prezența halucinației, atrubuindu-i și referințe
personale, simptomul presupune statutul de deziluzie. Combinația halucinațiilor olfactive și a
deziluziilor de acest tip semnifică prezența unei boli psihiatrice. Frecvent sunt acuze despre o
gamă vastă de senzații olfactive, majoritatea fiind scabroase. În cea mai mare parte de cazuri
pacienții pretind că sursa mirosurilor neplăcute se află în interiorul lor (halucinații intrinseci),
unii consideră că în exterior (halucinații extrinseci). Ambele tipuri variază ca intensitate, dar
au o caracteristică comună – persistența. Se pot combina cu halucinții gustative. În
schizofrenie stimulul olfactiv este de obicei interpretat drept unul extern, fiind indus de
cineva din exterior pentru a-l indispune pe pacient. În depresie sursa este internă și este
foarte copleșitoare. Pacientul încearcă prin orice mod să scape de duhoarea care-l urmărește,
una din cele mai frecvente acțiuni fiind baia în exces și folosirea de deodorante, situații care
pot conduce la retragerea din societate. Există dovezi precum că grupul nucleilor
amigadaloizi este sursa halucinațiilor respective, deoarece după distrugerea lor stereotactică
se reduc atât halucinațiile cât și manifestările psihiatrice propriu-zise.
Halucinațiile olfactive și deziluziile se pot observa și în demența Alzheimer, dar de
fiecare dată în asemnea situație necesită a fi diferențiate de depresia vârstei înaintate.
Ocazional halucinațiile olfactive pot face parte din sindromul de stopare a consumului de
alcool. Reacții specifice olfactive există în unele psihopatii sexuale.
Lipsa discriminării olfactive (agnozia olfactivă)
În final, se consideră dereglare a funcției olfactive dereglarea sau pierderea capacității de a
dsitinge între ele diferite substanțe odorante, în timp ce detecția substanțelor odorante,
adaptarea către ele, diferențierea diferitor intensități este intactă. Recunoașterea calității
substanțelor odorante este redusă sau pierdută. De fapt este vorba de agnozie olfactivă.
Recunoașterea acestui deficit necesită testări speciale, așa cum ar fi potrivirea cu mostra,
identificarea și denumirea unei varietăți de miresme și determinarea faptului dacă două
substanțe odorante sunt identice sau diferite. O asemenea alterație a funcției olfactive este
caracteristică pacienților cu formă alcoolică a psihozei Korsakoff; această dereglare nu este
legată de tulburarea acuității olfactive sau a procesului de învățare și memorare. După cum a
fost menționat mai sus, dereglările olfactive la pacienții respectivi zona leziunii este
localizată nucleul dorso-medial al talamusului și a conexiunilor lui cu cortexul orbito-frontal.
O situație similară a fost raportată la un pacient care a suportat o rezecție extinsă bilaterală a
porțiunii mediale a lobului temporal. În așa mod pare a fi verosimilă ipoteza precum că
ambele porțiuni ale căilor olfactive superioare (lobii temporali mediali și nucleii dorsali
mediali) joacă un rol important în discriminarea și identificarea substanțelor odorante.
BIBLIOGRAFIE SELECTIVĂ
1. Gavriliuc M. Examenul Neurologic. Sirius 2012.
2. Nieuwenhuys R, Voogd J, Huijzen C van. The human Central Nervous System. Springer-
Verlag, (4th edition) 2008.
3. Popoviciu L, Așgian B. Bazele semiologice ale practicii neurologice și neurochirugicale.
București, Editura Medicală, 1991.
4. Ropper A, Samuels M, Klein J. Adams and Victor's Principles of Neurology 10th Edition
Mc-Graw Hill 2014.
5. Swaiman KF, Ferriero DM, Ashwal MD, Schor NF. Swaiman's Pediatric neurology.
Principles and practice. Elsevier (5th edition) 2012. 6. Wilson-Pauwels L, Akesson EJ,
Stewart PA, Spacey SD. Cranial nerves in health and disease. BC Decker Inc 2002.
S-ar putea să vă placă și
- Chong Mai MeridianDocument5 paginiChong Mai Meridianvancioc100% (1)
- 734 Din Ce Este Alcatuit Corpul UmanDocument13 pagini734 Din Ce Este Alcatuit Corpul UmanAAÎncă nu există evaluări
- AcupuncturaDocument4 paginiAcupuncturamarriano22250% (2)
- Cistitele NebacterieneDocument4 paginiCistitele NebacterienevanciocÎncă nu există evaluări
- Curs de MasajDocument1 paginăCurs de MasajLucianroÎncă nu există evaluări
- AuriculoterapiaDocument3 paginiAuriculoterapiaillemarius100% (2)
- Limbajul Secret Al Apei Masaru Emoto PDFDocument13 paginiLimbajul Secret Al Apei Masaru Emoto PDFMikiatlantulÎncă nu există evaluări
- Acupunctura Si Medicina ChinezeascaDocument7 paginiAcupunctura Si Medicina ChinezeascaaurachilomÎncă nu există evaluări
- Meridianul RinichiDocument2 paginiMeridianul Rinichireader_javaÎncă nu există evaluări
- EpifizaDocument2 paginiEpifizaRodica Radu IonescuÎncă nu există evaluări
- Acupunctura Cea Mai Cunoascută Terapie Tradiţională ChinezăDocument15 paginiAcupunctura Cea Mai Cunoascută Terapie Tradiţională ChinezăJanggeum Damaris100% (1)
- Abraham-Hicks - Creatia Se Refera La Tine - Scara EmotiilorDocument7 paginiAbraham-Hicks - Creatia Se Refera La Tine - Scara EmotiilorStalinescu VioricaÎncă nu există evaluări
- Portalul Portii LeuluiDocument5 paginiPortalul Portii Leuluimichaela doriaÎncă nu există evaluări
- Cafeaua Cu CardamonDocument3 paginiCafeaua Cu Cardamontazzman1Încă nu există evaluări
- Mirahorian Atlas Acupunctura - CompressDocument192 paginiMirahorian Atlas Acupunctura - Compressmike mikeÎncă nu există evaluări
- Nervul XDocument3 paginiNervul XNicoleta TurcuÎncă nu există evaluări
- Puncte MERIDIANUL DU MAIDocument6 paginiPuncte MERIDIANUL DU MAIDanaelaÎncă nu există evaluări
- Dr. Codlea - AcupuncturaDocument10 paginiDr. Codlea - AcupuncturavictorstoÎncă nu există evaluări
- Glanda PinealaDocument2 paginiGlanda PinealaCara BolosÎncă nu există evaluări
- Presopunctura Si MicromasajulDocument6 paginiPresopunctura Si Micromasajulateugen100% (1)
- Energia Kundalini Shannon YrizzaryDocument4 paginiEnergia Kundalini Shannon Yrizzarydilema8Încă nu există evaluări
- Medicina Vibrationala Biorezonanta 01 PDFDocument9 paginiMedicina Vibrationala Biorezonanta 01 PDFathena_vintila100% (1)
- Acceptarea Bolilor Si Regasirea Sensului VietiiDocument1 paginăAcceptarea Bolilor Si Regasirea Sensului VietiiCristina DincaÎncă nu există evaluări
- Acupunctura Ioan Ladea 2Document423 paginiAcupunctura Ioan Ladea 2vanciocÎncă nu există evaluări
- Reflexologie in PalmaDocument2 paginiReflexologie in Palmaleonard42100% (1)
- Antichitate La ModernismDocument6 paginiAntichitate La Modernismboboceag_1Încă nu există evaluări
- Auriculoterapia 12.1Document25 paginiAuriculoterapia 12.1ASMR IRINA RELAX STORY100% (1)
- MasajDocument93 paginiMasajcristina_sere2105Încă nu există evaluări
- Glandele EndocrineDocument9 paginiGlandele EndocrineMadalina AndreeaÎncă nu există evaluări
- Chakrele Si Bolile Fizice (Sursa Net)Document7 paginiChakrele Si Bolile Fizice (Sursa Net)Liviu AngelescuÎncă nu există evaluări
- Medicina AlternativaDocument3 paginiMedicina AlternativaChristina GeorgescuÎncă nu există evaluări
- Si Adevarul Va Va Face Liberi, David IckeDocument1 paginăSi Adevarul Va Va Face Liberi, David Ickelenu55Încă nu există evaluări
- Tonuri RifeDocument2 paginiTonuri RifeCarmen DudaÎncă nu există evaluări
- Fluxul Energiei Vitale Qi Prin MeridianeDocument24 paginiFluxul Energiei Vitale Qi Prin Meridianeluminitapristavu100% (1)
- 69 Terapia Prin Presopunctura Si Micromasajul Sunt La Indemana Oricarui Om Care Isi Doreste Un Corp SanatosDocument6 pagini69 Terapia Prin Presopunctura Si Micromasajul Sunt La Indemana Oricarui Om Care Isi Doreste Un Corp SanatosNatascha PetrovnaÎncă nu există evaluări
- TimusulDocument7 paginiTimusulEu NoiÎncă nu există evaluări
- MTCDocument9 paginiMTCsuzzixxÎncă nu există evaluări
- Bts Altfel de BoliDocument230 paginiBts Altfel de BoliGeorgianaÎncă nu există evaluări
- Exercitiul Cocorului NetDocument4 paginiExercitiul Cocorului Netflorina eÎncă nu există evaluări
- Activitatea ReflexaDocument3 paginiActivitatea ReflexapetreosÎncă nu există evaluări
- Curs Anatomie AMFDocument182 paginiCurs Anatomie AMFCorina NeamtuÎncă nu există evaluări
- Acupunctura in AVCDocument10 paginiAcupunctura in AVCDiana BanciuÎncă nu există evaluări
- Medicina ArhaicaDocument43 paginiMedicina ArhaicaAurel IliesÎncă nu există evaluări
- MoxibustieDocument3 paginiMoxibustieDobre CristinaÎncă nu există evaluări
- Homeopatie Medicina CuanticaDocument7 paginiHomeopatie Medicina CuanticaElaÎncă nu există evaluări
- Scriptorium 01Document26 paginiScriptorium 01Coman Daniel100% (2)
- Dezvoltarea SimturilorDocument2 paginiDezvoltarea SimturilorDav Ina100% (1)
- JASMUHIN Despre MeditatieDocument10 paginiJASMUHIN Despre MeditatiesbotaÎncă nu există evaluări
- 4.iertarea - Tehnica Hawaiana Ho Pono PonoDocument1 pagină4.iertarea - Tehnica Hawaiana Ho Pono PonoMihail LambruÎncă nu există evaluări
- Managementul Durerii - Curs 7 - Puncte TriggerDocument17 paginiManagementul Durerii - Curs 7 - Puncte Triggermisha100% (1)
- Diagnostic Prin BiorezonantaDocument4 paginiDiagnostic Prin BiorezonantaChiba Nicolae FlorinÎncă nu există evaluări
- ACUPUNCTURADocument124 paginiACUPUNCTURANicoleta Florentina Ghencian100% (3)
- Ninja de Fier Marele Circuit CerescDocument39 paginiNinja de Fier Marele Circuit CerescMihnea ColtanelÎncă nu există evaluări
- AnalizatoriDocument10 paginiAnalizatoriEmilia AdrianaÎncă nu există evaluări
- Tabel Comparativ Cu AnalizatoriiDocument2 paginiTabel Comparativ Cu AnalizatoriiRamona RaduÎncă nu există evaluări
- Fiziologia Analizatorului VizualDocument10 paginiFiziologia Analizatorului VizualTatiana NaclitchiÎncă nu există evaluări
- Calea OlfactivaDocument1 paginăCalea Olfactivaauras27mateiÎncă nu există evaluări
- BioDocument4 paginiBioanaÎncă nu există evaluări
- Analizatorul OlfactivDocument3 paginiAnalizatorul OlfactivTuyu TufyuÎncă nu există evaluări
- Anatomie AMF IDocument149 paginiAnatomie AMF IadelacosereanuÎncă nu există evaluări
- VIII - AuditivDocument21 paginiVIII - AuditivDiana ZețuÎncă nu există evaluări
- IV. Oculomotori 1Document21 paginiIV. Oculomotori 1Diana ZețuÎncă nu există evaluări
- IV. Oculomotori 1Document21 paginiIV. Oculomotori 1Diana ZețuÎncă nu există evaluări
- Mio Relax An TeleDocument11 paginiMio Relax An TeleDiana ZețuÎncă nu există evaluări
- Coarctația de Aortă: Elaborat De: Zețu Diana M1613Document24 paginiCoarctația de Aortă: Elaborat De: Zețu Diana M1613Diana ZețuÎncă nu există evaluări
- Cazuri Clinice Cardiomiopatii - 17605Document1 paginăCazuri Clinice Cardiomiopatii - 17605Diana ZețuÎncă nu există evaluări