Documente Academic
Documente Profesional
Documente Cultură
F47DD821-7392-464B-9EB9-1E309097B328
Încărcat de
Liviu DinuDrepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
F47DD821-7392-464B-9EB9-1E309097B328
Încărcat de
Liviu DinuDrepturi de autor:
Formate disponibile
Scoala Profesionala Germana Kronstadt
Prof. Barbu Bogdan
SINTEZĂ LA CAPITOLUL
„NOŢIUNI DE TERMODINAMICĂ”
Fenomenele termice sunt fenomene fizice legate de mişcarea permanentă, complet
dezordonată şi dependentă de temperatură, care se manifestă la nivel molecular (agitaţia termică).
Sistemul termodinamic reprezintă un corp sau ansamblu de corpuri bine delimitat.
Parametrii de stare sunt mărimi fizice măsurabile care caracterizează univoc proprietăţile
sistemului termodinamic (au valori unice şi bine determinate în fiecare stare). Exemple: volumul,
presiunea, temperatura, etc.
Mulţimea tuturor parametrilor de stare determină complet starea sistemului termodinamic.
Proces (transformare) de stare – trecerea unui sistem termodinamic dintr-o stare în alta.
Energie internă a sistemului termodinamic,U, este o mărime fizică de stare care măsoară
suma energiilor cinetice ale tuturor moleculelor din sistem, precum şi energiile potenţiale datorate
forţelor intermoleculare sau interacţiei cu câmpurile de forţe exterioare. Sistemele termodinamice
schimbă energie cu mediul extern sub formă de căldură sau de lucru mecanic.
Lucrul mecanic este o mărime fizică de proces care, în cazul unui proces izobar, se
calculează cu expresia: Lif p V f Vi
Atunci când sistemul termodinamic schimbă energie cu mediul extern sub formă de lucru
mecanic apar variaţii ale parametrilor de poziţie. Dacă în timpul schimbului de energie nu apar
variaţii ale parametrilor de poziţie, atunci sistemul schimbă energie cu mediul extern numai sub
formă de căldură. Proces adiabatic – proces în care sistemul poate schimba energie cu mediul
exterior numai sub formă de lucru mecanic (Q=0).
Două sisteme termodinamice se află în echilibru termic atunci când, fiind puse în contact
termic, nu schimbă căldură între ele.
Principiul tranzitivităţii echilibrului termic: dacă sistemele A şi B sunt în echilibru
termic, iar B este în echilibru termic cu C, atunci sistemele A şi C sunt în echilibru termic.
Temperatura empirică t este o mărime fizică de stare care caracterizează stările de
echilibru termic ale sistemelor termodinamice.
[t]SI =1oC
Temperatura absolută, T , este temperatura exprimată în scara Kelvin şi este definită
având ca stare termică de referinţă starea triplă a apei (273,15 K).
T K t o C 273,15
Principiul I al termodinamicii: pentru orice sistem termodinamic închis, variaţia ΔU a
energiei interne în cursul unui proces i→f este dată de relaţia: ΔU=Qif-Lif.
Pentru un sistem termodinamic izolat termic şi mecanic, energia internă are aceeaşi valoare
în orice stare (legea de conservare a energiei unui sistem izolat).
Capacitatea calorică a unui corp, C, este mărimea fizică scalară definită prin relaţia:
Q
C , C SI 1 J K
T .
Căldura molară, Cμ, este mărimea fizică scalară definită de relaţia:
C
Q
T
, C 1 J kmol K
.
Căldura specifică, c, este mărimea fizică scalară definită de relaţia:
Q
c , cSI 1 J (kg K )
m T .
La gaze, coeficienţii calorici depind de transformarea pe care o suferă gazul. Relaţia Robert
– Mayer: Cp Cv R, R=constanta gazului ideal (8314 J/kmol·K).
Corpurile aduse în contact termic ajung, după un anumit timp, la echilibru termic.
Termostatele sunt sisteme cu energie internă infinită care, în urma contactului termic cu alte
corpuri, nu-şi modifică temperatura.
Scoala Profesionala Germana Kronstadt
Prof. Barbu Bogdan
Ecuaţia calorimetrică – atunci când două sau mai multe corpuri cu temperaturi diferite sunt
închise într-o incintă adiabatică, suma căldurilor primite de corpurile reci este egală cu suma
modulelor căldurilor cedate de corpurile mai calde.
Scoala Profesionala Germana Kronstadt
Prof. Barbu Bogdan
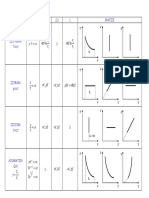
Termodinamica gazului ideal
Legea transformării Graficul transformării
Transf. în temp în coord. în coord. în coord. Q L ΔU
în temp. relativă
absolută (p,V) (p,T) (V,T)
V2 p V2 p
izotermă RT ln RT ln 1 RT ln RT ln 1
V1 p2 V1 p2
(m=ct., p·V=const. 0
V2 p V2 p
T=ct.) 2,3RT lg 2,3RT lg 1 2,3RT lg 2,3RT lg 1
V1 p2 V1 p2
izobară V Vo 1 t C p T f Ti p V f Vi C V T f Ti
V
ct
mc p T f Ti R T f Ti mcV T f Ti
(m=ct., 1
grad 1 T
p=ct.) 273,15 *
izocoră p p o 1 t C V T f Ti C V T f Ti
p
ct
mcV T f Ti mcV T f Ti
(m=ct., 1 0
grad 1 T
V=ct.) 273,15 **
pV p oVo 1 t
generală pV din ecuaţia principiului I: din graficul transformării C V T f Ti
ct
mcV T f Ti
1
(m=ct.) grad 1 T Q=L+ΔU în coordonate (p,V)
273,15
pV ct
adiabată C V T f Ti C V T f Ti
TV 1 ct
mcV T f Ti mcV T f Ti
(m=ct., 0
1
Q=0)
Tp ct ***
*α – coeficient de dilatare izobară;
**β – coeficient de variaţie a presiunii cu temperatura;
C p c p 3R 5R 5R 7R
C V ; C p C V ; C p
*** C V cV - exponent adiabatic. Pentru gazul ideal monoatomic: 2 2 , iar pentru gazul ideal diatomic: 2 2
pV RT m
Ecuaţia termică de stare a gazului ideal: , unde reprezintă numărul de kmoli de gaz. Ecuaţia calorică de stare a gazului ideal:
i
U RT
2 , unde i reprezintă numărul de grade de libertate al moleculelor gazului (3 în cazul gazului monoatomic şi 5 în cazul gazului diatomic)
Scoala Profesionala Germana Kronstadt
Prof. Barbu Bogdan
Principiul al doilea al termodinamicii:
Formularea Thomson: este imposibil de realizat o transformare ciclică monotermă reversibilă care
să aibă ca unic rezultat final transformarea integrală a căldurii absorbite în lucru mecanic.
Formularea Claussius: este imposibil un proces în care căldura să treacă de la sine de la un corp cu
o temperatură dată la un alt corp cu o temperatură mai ridicată.
Motoarele termice sunt dispozitive care transformă în lucru mecanic o parte din căldura
obţinută prin arderea unui combustibil.
Randamentul unui motor termic este definit prin relaţia:
L Q
1 cedat
Q primit Q primit .
Întotdeauna randamentul unui motor termic este subunitar.
Faze ale sistemelor fizice sunt părţi ale unui sistem cu proprietăţi fizice distincte
- faza solidă;
- faza lichidă;
- faza de vapori;
- faza gazoasă.
Topirea este fenomenul de trecere a unei substanţe din stare solidă în stare lichidă.
Solidificarea este fenomenul de trecere a unei substanţe din stare lichidă în stare solidă.
Căldura latentă specifică de topire (solidificare) izotermă este mărimea fizică scalară λt
Q
t
definită prin relaţia: m (căldura necesară unităţii de masă dintr-o substanţă ca să sufere
fenomenul de topire).
Vaporizarea este fenomenul de trecere a unei substanţe din stare lichidă în stare de vapori.
Condensarea este fenomenul de trecere a unei substanţe din stare de vapori în stare lichidă.
Căldura latentă specifică de vaporizare (condensare) este mărimea fizică scalară λV definită
Q
V
prin relaţia: m (căldura necesară unităţii de masă dintr-o substanţă ca să sufere fenomenul de
vaporizare).
Sublimarea este fenomenul de trecere a unei substanţe din stare solidă în stare de vapori.
Desublimarea este fenomenul de trecere a unei substanţe din stare de vapori în stare solidă.
S-ar putea să vă placă și
- Sinteza TermodinamicaDocument8 paginiSinteza TermodinamicaAlex RoznoÎncă nu există evaluări
- Curs 3-Termodinamica 2022Document23 paginiCurs 3-Termodinamica 2022BogdanCureleaÎncă nu există evaluări
- Transformarile Simple Ale Gazului IdealDocument10 paginiTransformarile Simple Ale Gazului IdealVlad Stefan100% (1)
- Curs 3-Termodinamica 2020Document22 paginiCurs 3-Termodinamica 2020Sebs WindÎncă nu există evaluări
- TermodinamicăDocument10 paginiTermodinamicăAndreea AntonÎncă nu există evaluări
- Transformari de Stare Ale Gazului PerfectDocument8 paginiTransformari de Stare Ale Gazului PerfectZavturCorneliuÎncă nu există evaluări
- Aplicatii Ale Principiului I Al Termodinamicii La Gazul Ideal PDFDocument5 paginiAplicatii Ale Principiului I Al Termodinamicii La Gazul Ideal PDFMarcela Dobre0% (1)
- Cap 3 Gaze IdealeDocument26 paginiCap 3 Gaze IdealeSOrinÎncă nu există evaluări
- TermodinamicăDocument8 paginiTermodinamicăIlie Andrei75% (4)
- Petcu George-Denis, Caldura. Coeficienti CaloriciDocument5 paginiPetcu George-Denis, Caldura. Coeficienti CaloriciDenis PetcuÎncă nu există evaluări
- TMT 2020 Curs 3,4Document24 paginiTMT 2020 Curs 3,4EmricaÎncă nu există evaluări
- Termodinamica p1 Adnotari FinalDocument21 paginiTermodinamica p1 Adnotari FinalIonuț CarpÎncă nu există evaluări
- TermodinamicaDocument10 paginiTermodinamicarodycaÎncă nu există evaluări
- Curs 6 - Analiza Termodinamica A Gazelor Ideale Si A Amestecurilor de GazeDocument31 paginiCurs 6 - Analiza Termodinamica A Gazelor Ideale Si A Amestecurilor de GazenicoletabytaxÎncă nu există evaluări
- Curs 9 Fizica 1-1Document24 paginiCurs 9 Fizica 1-1Anca VisoiuÎncă nu există evaluări
- Cursuri AMSFDocument142 paginiCursuri AMSFAndreea Nicole NituÎncă nu există evaluări
- Care Este Obiectul de Studiu Al TermodinamiciiDocument3 paginiCare Este Obiectul de Studiu Al TermodinamiciiRoxana DănăilăÎncă nu există evaluări
- TermodinamicaDocument3 paginiTermodinamicaCristinaa1998Încă nu există evaluări
- Transform Ari Leg A Zulu I IdealDocument11 paginiTransform Ari Leg A Zulu I Idealbalmus.olgaÎncă nu există evaluări
- TermoDocument8 paginiTermoGeorgiana AlecuÎncă nu există evaluări
- Curs 7Document10 paginiCurs 7Ionut IlieÎncă nu există evaluări
- Izocoră V Constant Izobară P Constant Izotermă T Constant Adiabată Q Constan TDocument11 paginiIzocoră V Constant Izobară P Constant Izotermă T Constant Adiabată Q Constan TAndrei MerluscaÎncă nu există evaluări
- Gazul - IdealDocument7 paginiGazul - IdealIonela ZotaÎncă nu există evaluări
- Teorie Fizica TermodinamicaDocument4 paginiTeorie Fizica TermodinamicaLarisaÎncă nu există evaluări
- Curs 4Document44 paginiCurs 4Iulia MicuÎncă nu există evaluări
- Curs 4 Termo 21-22-4Document9 paginiCurs 4 Termo 21-22-4Lorena ionelaÎncă nu există evaluări
- C 7Document32 paginiC 7dan1111112Încă nu există evaluări
- Termodinamica Formule 221130 140935Document3 paginiTermodinamica Formule 221130 140935Panait Elena RobertaÎncă nu există evaluări
- Termodinamica Formule Grafice PDFDocument2 paginiTermodinamica Formule Grafice PDFDumitrescu AndreiÎncă nu există evaluări
- Coman Termotehnica I CursDocument93 paginiComan Termotehnica I CursCrisanViorelÎncă nu există evaluări
- Sinteze TermodinamicaDocument15 paginiSinteze TermodinamicaStefanutskiÎncă nu există evaluări
- TERMODINAMICĂ FormuleDocument2 paginiTERMODINAMICĂ FormuleCatalan OvidiuÎncă nu există evaluări
- Curs 11Document15 paginiCurs 11Constantin DenisaÎncă nu există evaluări
- Instalatii de Frig Si ClimatizareDocument71 paginiInstalatii de Frig Si ClimatizareLaurentiu RosuÎncă nu există evaluări
- Curs2 2017 B PDFDocument54 paginiCurs2 2017 B PDFIon BucatariÎncă nu există evaluări
- Tabel Formule Clasa A 10 A FizicaDocument2 paginiTabel Formule Clasa A 10 A Fizicamadamihaelamadalina79% (39)
- ProdecanDocument4 paginiProdecanSendrescu DorinÎncă nu există evaluări
- Izocoră V Constant Izobară P Constant Izotermă T Constant Adiabată Q ConstantDocument11 paginiIzocoră V Constant Izobară P Constant Izotermă T Constant Adiabată Q ConstantAndrei MerluscaÎncă nu există evaluări
- Aplicatii Principiul 1Document11 paginiAplicatii Principiul 1mariaalexandra ciutaÎncă nu există evaluări
- Termodinamică Clasa A 10 ADocument1 paginăTermodinamică Clasa A 10 Aghiatageorgica20Încă nu există evaluări
- Transformarea Politropa Termodinamica Clasa 10Document4 paginiTransformarea Politropa Termodinamica Clasa 10Dragu AndreiÎncă nu există evaluări
- Curs 5Document13 paginiCurs 5AndreeaÎncă nu există evaluări
- Probleme Rezolvate Principiile TermodinamiciiDocument13 paginiProbleme Rezolvate Principiile TermodinamiciiRobert MaximilianÎncă nu există evaluări
- RedresoareDocument23 paginiRedresoarerotariu rinuÎncă nu există evaluări
- 1.9.efectul Joule ThompsonDocument3 pagini1.9.efectul Joule ThompsonYuigahama NaegiÎncă nu există evaluări
- LAB 7 Fizica UTMDocument4 paginiLAB 7 Fizica UTMIon AxenteÎncă nu există evaluări