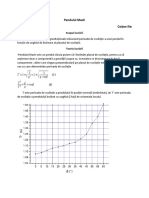
Documente Academic
Documente Profesional
Documente Cultură
2.gazul Perfect + Amestecul de Gaze
Încărcat de
Daniel100%(2)100% au considerat acest document util (2 voturi)
320 vizualizări2 paginiGazul perfect + amestecul de gaze
Titlu original
2.Gazul perfect + amestecul de gaze
Drepturi de autor
© © All Rights Reserved
Formate disponibile
DOCX, PDF, TXT sau citiți online pe Scribd
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentGazul perfect + amestecul de gaze
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
100%(2)100% au considerat acest document util (2 voturi)
320 vizualizări2 pagini2.gazul Perfect + Amestecul de Gaze
Încărcat de
DanielGazul perfect + amestecul de gaze
Drepturi de autor:
© All Rights Reserved
Formate disponibile
Descărcați ca DOCX, PDF, TXT sau citiți online pe Scribd
Sunteți pe pagina 1din 2
2.GAZE PERFECTE.LEGILE GAZULUI PERFECT.
Gazele reprezint principalul
grup de ageni de lucru din mainile i instalaiile termice. Noiunea de gaz
perfect, denumit i gaz ideal, a aprut atunci cnd s-a demonstrat c legile simple
ale gazelor descoperite de Boyle-Mariotte, Gay-Lussac i Charles nu verific toate
strile de echilibru termodinamic ale gazului real. Abaterea comportrii gazelor
reale de la legile simple a determinat definirea unui model de gaz, denumit gaz
perfect. Anumite gaze se comport la temperatura i presiunea atmosferic
aproape la fel ca i un gaz perfect, ceea ce justific utilizarea legilor gazului
perfect la studiul proceselor din mainile i instalaiile termice n limitele unor
aproximaii admisibile. Abateri importante ale gazelor reale de la legile gazului
perfect apar la presiuni mari i temperaturi sczute, n special n apropierea
strilor lor de lichefiere. Aadar, modelul de gaz perfect a fost definit ca urmare a
stabilirii prin cercetri experimentale a legilor privind comportarea gazelor la
presiuni apropiate de presiunea atmosferic.Legile transformrilor simple ale
gazului perfect stabilesc relaii ntre doi parametri de stare, n condiiile meninerii
constante a celui de-al treilea. Legea Boyle-Mariotte exprim legtura dintre
presiunea i volumul unei cantiti de gaz perfect ntr-o transformare izoterm.
Aceast lege afirm c ntr-o transformare izoterm produsul dintre presiunea i
volumul unui gaz perfect rmne constant. Pentru dou stri ale gazului, expresia
p1v1 pv const .
matematic a acestei legi este: Valoarea constantei depinde de
temperatura i natura gazului.Legea Gay-Lussac stabilete legtura dintre
temperatura i volumul unei cantiti de gaz perfect ntr-o transformare izobar, i
anume: la presiune constant volumul unui gaz perfect este proporional cu
temperatura absolut v/v0=T/T0=v/T=const. Valoarea constantei depinde de
presiunea i natura gazului. Legea lui Charles stabilete legtura dintre
temperatura i presiunea unei cantiti de gaz perfect ntr-o transformare izocor:
ntr-o transformare izocor presiunea gazului perfect este proporional cu
temperatura lui p/p0=T/T0=p/T=const. Valoarea constantei depinde de volumul i
natura gazului.ECUAIA TERMIC DE STARE A GAZULUI PERFECT. Exprim
relaia dintre parametrii de stare ai unui gaz perfect ntr-o transformare oarecare.
Pentru a deduce aceast relaie se consider un gaz perfect care parcurge dou
transformri succesive, i anume o transformare izoterm 1-0 i o transformare
izobar 0-2. Pe baza legilor simple Boyle-Mariotte i Gay-Lussac se poate scrie:-
p1v1 p0v0 T1 T0
pentru transformarea 1-0: ( ); pentru transformarea 0-2:
p0 p2
v0/v2=T0/T2( ). Din cele dou ecuaii rezult:
p1v1/T1=p2v2/T2=pv/T=const; Valoarea constantei nu depinde de starea gazului,
ci numai de proprietile lui, fiind caracteristic fiecrui gaz. Ea se numete
constant caracteristic, R. Prin urmare, ecuaia termic de stare a gazului
pv RT
perfect, numit i ecuaia lui Clapeyron, se poate scrie sub forma: ;
pV mRT
R=pv/T [J/khK]. Pentru o mas m de gaz ecuaia devine: ; Pentru 1 kmol
pv RT pVM RM T
de gaz perfect, ecuaia termic de stare devine: sau , n
care: RM reprezint constanta universal a gazului perfect, care nu depinde de
natura gazului, dup cum nici V M, la aceeai presiune i temperatur nu depinde
de natura gazului. Constanta universal a gazului perfect se poate determina din
ecuaia de stare corespunztoare condiiilor fizice normale, p N=101325 N/m2,
TN=273,15 K, VMN=22,4136 m3N/kmol: R M = pN V MN /T N = 101325*22,4136 /
273,15 =8314,34 J/kmolK. Constanta caracteristic a gazelor perfecte devine:R=
R M /M=8314,34/M.
AMESTECURI DE GAZE PERFECTE. Majoritate covarsitoare a agentilor termici de
lucru sunt reprezentati de amestecuri formate din diverse substante. In cazul in
care aceste amestecuri sunt in stare gazoasa, li se poate aplica modelul
amestecurilor ideale de gaze perfecte.Amestecul in ansamblu respecta
caracteristica modelului de gaz ideal.Exista amestecuri de gaze cu componenta
stabila, pentru care au fost realizate tabele si diagrame de proprietati
termodinamice si termofizice.Pentru amestecul de gaze perfecte se pot defini
concentratiile: gravimetrica; contentratia molara; concentratia
volumetrica.DESEN7. Legile amestecurilor de gaze perfecte.Agenii
termodinamici din mainile i instalaiile termice sunt amestecuri de gaze, de
exemplu: aerul (N2, O2), gazele rezultate din arderea unui combustibil (CO 2, H2O,
SO2, N2, O2, CO).Amestecurile de gaze se realizeaz prin difuzia componenilor.
Gazele componente nu interacioneaz chimic. Un amestec de gaze perfecte
reprezint un sistem cu proprieti termofizice diferite de cele ale componenilor,
dar determinate de proprietile acestora. De asemenea, un amestec de gaze
perfecte formeaz tot un gaz perfect, care se supune legilor gazelor perfecte.
Legea lui Dalton DESEN8 stabilete legtura dintre presiunea p a unui amestec
de gaze perfecte i presiunile pariale p i ale gazelor componente, aflate la
temperatura T i volumul V ale amestecului. ntr-un amestec de gaze format din
mai muli componeni care nu interacioneaz chimic, aflat n echilibru
termodinamic, fiecare gaz component se rspndete n ntregul volum ocupat de
amestec exercitnd o presiune parial egal cu presiunea pe care ar exercita-o
dac ar ocupa singur ntregul volum al amestecului, cnd toi componenii au
temperatura egal cu temperatura amestecului. Legea se enun astfel: presiunea
total a unui amestec de gaze este egal cu suma presiunilor pariale ale gazelor
n
componente. p= pi , unde: pi=miRiT/V reprezint presiunea parial a
i=1
componentului i. Legea lui Amagat DESEN9 exprim relaia dintre volumul V al
unui amestec de gaze perfecte i volumele pariale V i ale gazelor componente,
considerate la temperatura T i presiunea p ale amestecului. Ea se enun astfel:
volumul ocupat de un amestec de gaze perfecte este egal cu suma volumelor
n
pariale ale gazelor componente. V= Vi , unde: Vi=miRiT/p reprezint volumul
i=1
parial al componentului i.
S-ar putea să vă placă și
- Chimie CursDocument154 paginiChimie CursDavid Ila100% (1)
- Legile GazelorDocument3 paginiLegile Gazelorhostil2Încă nu există evaluări
- Lectie - Masurarea TemperaturiiDocument14 paginiLectie - Masurarea TemperaturiiSuflea Amalia GeorgianaÎncă nu există evaluări
- Pendul Gravitaţional - ADocument10 paginiPendul Gravitaţional - AGabi PSÎncă nu există evaluări
- Determinarea Coeficientului AdiabaticDocument4 paginiDeterminarea Coeficientului AdiabaticPavelÎncă nu există evaluări
- 4.1. Capacitatea Calorica La Volum Şi La Presiune PDFDocument5 pagini4.1. Capacitatea Calorica La Volum Şi La Presiune PDFMariana CalinÎncă nu există evaluări
- Coman Termotehnica I CursDocument93 paginiComan Termotehnica I CursCrisanViorelÎncă nu există evaluări
- Principiul Al 2-Lea Al Termodinamici - Lazar Maria AlinaDocument4 paginiPrincipiul Al 2-Lea Al Termodinamici - Lazar Maria AlinaAlin MusatÎncă nu există evaluări
- Coeficientul de CompresibilitateDocument8 paginiCoeficientul de Compresibilitateal_mmDÎncă nu există evaluări
- MF Partea - 1 PDFDocument18 paginiMF Partea - 1 PDFdandreescu_1Încă nu există evaluări
- Formule MecanicaDocument2 paginiFormule MecanicaGeorge MihăilăÎncă nu există evaluări
- PROBLEME - Legile GazelorDocument4 paginiPROBLEME - Legile GazelorCortojan IoanÎncă nu există evaluări
- Test Transformari Faza1Document1 paginăTest Transformari Faza1Andreea CiocanelÎncă nu există evaluări
- 05gaz Perfect TransformariDocument20 pagini05gaz Perfect TransformariLebada NeagraÎncă nu există evaluări
- Seria BalmerDocument5 paginiSeria BalmerJoshua12Încă nu există evaluări
- Aliaje Rezistente La RadiatiiDocument13 paginiAliaje Rezistente La RadiatiiNeculae Liviu Cristian100% (2)
- Legile de Deplasare Ale Lui Wien - WikipediaDocument3 paginiLegile de Deplasare Ale Lui Wien - WikipediaIoana DiaconeasaÎncă nu există evaluări
- Temperatura. Scari de Temperatura. Parametrii de Stare. Ecuatia Termica de StareDocument11 paginiTemperatura. Scari de Temperatura. Parametrii de Stare. Ecuatia Termica de StareLiliana BalanÎncă nu există evaluări
- Studiul Efectului Termoelectric - CoroiuDocument4 paginiStudiul Efectului Termoelectric - CoroiuBodor David-OliverÎncă nu există evaluări
- Curs 7Document18 paginiCurs 7Andreea MazereÎncă nu există evaluări
- Agenţi Termodinamici Şi Modele Folosite În Studiul TurbomaşinilorDocument13 paginiAgenţi Termodinamici Şi Modele Folosite În Studiul Turbomaşinilordanioachim1945Încă nu există evaluări
- Curs-6-3 Ingineria Reactiilor Si ReactoareDocument6 paginiCurs-6-3 Ingineria Reactiilor Si ReactoareClaudiu Antoniu BudeanuÎncă nu există evaluări
- Test TermodinamicaDocument2 paginiTest TermodinamicaEmilianAlexeÎncă nu există evaluări
- Amestecuri de GazeDocument2 paginiAmestecuri de GazeRoxana ElenaÎncă nu există evaluări
- Legea Energiilor (Particularizare Pentru Modelul Curentului Unidimensional de FluidDocument7 paginiLegea Energiilor (Particularizare Pentru Modelul Curentului Unidimensional de Fluidflorin_oprea_4Încă nu există evaluări
- 2 Legile ElectrolizeiDocument5 pagini2 Legile ElectrolizeiAndrei SolomonÎncă nu există evaluări
- TermodinamicaDocument12 paginiTermodinamicaPara CataÎncă nu există evaluări
- Lucrare de Laborator IzotermaDocument2 paginiLucrare de Laborator IzotermaDragos CazacuÎncă nu există evaluări
- Variatia Entropiei Cu Parametrii de StareDocument9 paginiVariatia Entropiei Cu Parametrii de StareNicolae CameliaÎncă nu există evaluări
- Efectul SEEBECKDocument7 paginiEfectul SEEBECKCojocarete BogdanÎncă nu există evaluări
- Mecanica LiceuDocument3 paginiMecanica LiceuGULA MIHAELA -LAURAÎncă nu există evaluări
- Probleme AmestecuriDocument3 paginiProbleme AmestecuriMariniuc DanÎncă nu există evaluări
- L2-Conductia Prin Pereti Plani ParaleliDocument13 paginiL2-Conductia Prin Pereti Plani Paralelifree22ady100% (1)
- 7 Variatia Cu TemperaturaDocument5 pagini7 Variatia Cu TemperaturaAnonymous GmUbEhBknUÎncă nu există evaluări
- Optica+Conventia de SemneDocument24 paginiOptica+Conventia de SemnedumitrascuÎncă nu există evaluări
- 16 Probleme, Concursuri, OlimpiadeDocument23 pagini16 Probleme, Concursuri, OlimpiadecostelneicuÎncă nu există evaluări
- Procese de Cracare Termica - Baze TeoreticeDocument22 paginiProcese de Cracare Termica - Baze TeoreticedcaÎncă nu există evaluări
- Se Aruncă Un Zar de Două OriDocument1 paginăSe Aruncă Un Zar de Două OriAndrei TerziÎncă nu există evaluări
- Mecanica Fluidelor 1Document35 paginiMecanica Fluidelor 1Ioana Ioana100% (1)
- Modelul Curentului Unidimensional de FluidDocument3 paginiModelul Curentului Unidimensional de Fluidflorin_oprea_4Încă nu există evaluări
- Pendulul MachDocument2 paginiPendulul Machcoitan ilieÎncă nu există evaluări
- Referat Energie RegenerabilaDocument8 paginiReferat Energie Regenerabilarazvan0885Încă nu există evaluări
- CO Cu Grupe Funct Mixte-S8Document2 paginiCO Cu Grupe Funct Mixte-S8Ioana Aurora PaslaruÎncă nu există evaluări
- Termo - Curs 14Document33 paginiTermo - Curs 14Rauta Robert Stefan100% (1)
- Pile ElectrochimiceDocument12 paginiPile ElectrochimiceHojdaIulianCristianÎncă nu există evaluări
- Procese de Electrod PDFDocument9 paginiProcese de Electrod PDFAndreea DobreÎncă nu există evaluări
- Laborator Legea Inductiei ElectromagneticeDocument4 paginiLaborator Legea Inductiei ElectromagneticePitzi GamingÎncă nu există evaluări
- Calculul Consumului de AburDocument10 paginiCalculul Consumului de AburAlisa ManoloiuÎncă nu există evaluări
- PHWRDocument23 paginiPHWRIrenne IadyraÎncă nu există evaluări
- Lucrare de Laborator Nr2Document6 paginiLucrare de Laborator Nr2oecldhmqÎncă nu există evaluări
- Studiul Ciocnirilor FrontaleDocument5 paginiStudiul Ciocnirilor FrontaleadminchemÎncă nu există evaluări
- Clasa 11 A - TermodinamicaDocument2 paginiClasa 11 A - Termodinamicanina gamanjiÎncă nu există evaluări
- My ProectDocument24 paginiMy ProectЗаработок в Интернете100% (1)
- ALCHILAREADocument8 paginiALCHILAREAMarina Denisa IlinaÎncă nu există evaluări
- Curs3 TermoDocument10 paginiCurs3 TermoPreda SilviuÎncă nu există evaluări
- Curs 3 Termo 21-22-2Document8 paginiCurs 3 Termo 21-22-2Lorena ionelaÎncă nu există evaluări
- 12 Gazul Perfect: 12.1 Legile Gazelor PerfecteDocument8 pagini12 Gazul Perfect: 12.1 Legile Gazelor PerfecteSqueezy ChannelÎncă nu există evaluări
- BTT I Cap 3 Rev 1.2Document42 paginiBTT I Cap 3 Rev 1.2Alexandru Marian BucurÎncă nu există evaluări
- Rezolvare Subiecte ChimieDocument18 paginiRezolvare Subiecte ChimiegheorghesimedrumaxxÎncă nu există evaluări
- Curs 3. Starea Gazoasă Şi Legile Gazelor: Legea Transformării Generale (Clapeyron-Mendeleev)Document6 paginiCurs 3. Starea Gazoasă Şi Legile Gazelor: Legea Transformării Generale (Clapeyron-Mendeleev)Sorin ConduracheÎncă nu există evaluări
- Consum EnergieDocument2 paginiConsum EnergieDanielÎncă nu există evaluări
- AP. PT Reglare DebitDocument2 paginiAP. PT Reglare DebitDanielÎncă nu există evaluări
- 3.masini TermiceDocument5 pagini3.masini TermiceDanielÎncă nu există evaluări
- ConductieDocument6 paginiConductieDanielÎncă nu există evaluări
- ConvectiaDocument8 paginiConvectiaDanielÎncă nu există evaluări
- RadiatieDocument2 paginiRadiatieDanielÎncă nu există evaluări