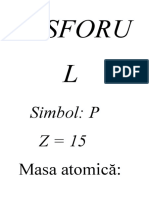Documente Academic
Documente Profesional
Documente Cultură
Note 2
Încărcat de
Daniel MogildeaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Note 2
Încărcat de
Daniel MogildeaDrepturi de autor:
Formate disponibile
P si compusii /caracteristici
argumentarea
utilizarea
P - valenta posibila III V
Grad de oxidare -5 +3 +5
In natura se gaseste sub forma de epatite si fosforite, in organismele vii ( ATP,
oase, tesutul muscular, creier, acizi nucleici) forme autropice:
fosfor alb substanta alba galbuie cu miros de usturoi. Lumineaza in intuneric
Insolubil in apa
Foarte toxic
Fosfor rosu sau violet. Substanta solida fara miros, nu lumineaza noapte, insolubil
in apa, la temperatura se sublima si se transforma in fosfor alb.
Fosfor negru are luciu metalic asemanator cu grafitul, insolubil in apa, poate fi
folosit ca semi-conductor nu este toxic
Obtinerea: Ca3(PO4)2+5C+3SiO2=2P+5CO+3CaSiO3 (oxido-reducere)
Proprietati chimice
1. oxidant
2P+3Ca=Ca3P2
2P+3H2=2PH3(toxic)
2. Reducator
4P+3O2=2P2O3
P+O2=2P2O5
P+CaClO3=CaCl+P2O5(aprinderea unui tzarnik)
Importanta vitala
Fosforul e un element vital
Si contine in tesuturile vietatilor( muschi creier, oase) in forma de Ca3(PO4)2
Intra in componeta acizilor nucleici(ADN si ARN)
Producerea chibritueilor
sinteza acidului fosforic
Sinteza ingrazamintelor minerale
Sinteza compusilor organici cu importanta vitala
In metalurigie in obtinerea unor aliaje
P2O5 -
Proprietati fizice
Cristale albe ce se transforma in vapori, temperatura de topire 560 grade
Temberatura de fierbere 600 grade
Proprietati chimice
P2O5+H2O--
P2o5+CaOH)2--
P2O5+CaH--
Uscarea gazelor si lichidelor
Producerea acidului fosforic
Sinteza in chimia organica
H3PO4 acid mediu acid fosforic
Metode de obtinere
P2O5+H2O=H2PO4
Ca3(PO4)2+H2SO4=CaSO4+H3PO4
Proprietati chimice
H3PO4 disociaza in
H3PO4+Na=
H3PO4+CaO=
H3PO4+MGOH)2
H3PO4+CaCl2
Reactii de identificare(calitative)
H3PO4+AgNO3=Ag3PO4(precipitat de culoare galbena intens)+HNO3
Producerea ingrasamintelor minerale
Curatarea ruginii de pe obiecte metalice
In comoneta fraunului(congelatoare industriale)
Aditiv alimentar E338
Pentru dedurizarea apei
S-ar putea să vă placă și
- SULFDocument20 paginiSULFGeorgeta Marioara100% (1)
- Acid FosforicDocument16 paginiAcid Fosforictabaraalin777Încă nu există evaluări
- FosforulDocument7 paginiFosforulRoxana Axinte100% (1)
- Oxizii Şi Oxiacizii FosforuluiDocument6 paginiOxizii Şi Oxiacizii FosforuluiIoanaToader100% (1)
- Acidul FosforicDocument9 paginiAcidul Fosforicdiana fenichiuÎncă nu există evaluări
- Fosforul PDocument12 paginiFosforul Pnicucazacu0% (1)
- Referat FosforulDocument4 paginiReferat FosforulAnaMariaÎncă nu există evaluări
- Acidul FOSFORICDocument19 paginiAcidul FOSFORICcristina100% (1)
- FluorulDocument12 paginiFluorulAndreea DemianÎncă nu există evaluări
- Fosforul PDocument19 paginiFosforul PEne Violeta Alina100% (1)
- Metabolismul LipidelorDocument251 paginiMetabolismul Lipidelorgvmeareason78% (9)
- Importanta Nemetalelor in Organismul UmanDocument8 paginiImportanta Nemetalelor in Organismul Umanmike100% (1)
- Curs Nr. 6 Chimie Farmaceutica (A) PDFDocument37 paginiCurs Nr. 6 Chimie Farmaceutica (A) PDFPierre LandryÎncă nu există evaluări
- FosforDocument15 paginiFosforAlexandra CismasÎncă nu există evaluări
- FosforulDocument6 paginiFosforultobi92100% (3)
- Acid FosforicDocument4 paginiAcid FosforicLorry Ank100% (2)
- FOSFORULDocument6 paginiFOSFORULvioletabadanÎncă nu există evaluări
- Fosforul FinalDocument4 paginiFosforul Finalpetreionutz87Încă nu există evaluări
- FosfOr (76543464567)Document9 paginiFosfOr (76543464567)Dumitru BuzduganÎncă nu există evaluări
- Pentaoxid de FosforDocument7 paginiPentaoxid de FosforAna-Maria TurcuÎncă nu există evaluări
- Curs 9 P As SB BiDocument14 paginiCurs 9 P As SB BiMadalina RusuÎncă nu există evaluări
- Chimie Grupa 5Document11 paginiChimie Grupa 5just meÎncă nu există evaluări
- FOSFORDocument4 paginiFOSFORdianaionelav23Încă nu există evaluări
- Acidul - Fosforic Cl. 9Document19 paginiAcidul - Fosforic Cl. 9Fuştei YolandaÎncă nu există evaluări
- FosforulDocument2 paginiFosforulNicholas Owens67% (3)
- ChibritulDocument8 paginiChibritulCatalinaÎncă nu există evaluări
- ChibritulDocument8 paginiChibritulCatalinaÎncă nu există evaluări
- C6-Chimie Anorganica - GR 15Document38 paginiC6-Chimie Anorganica - GR 15dia_didu_14Încă nu există evaluări
- Curs 7 - Grupa A 15-A, Oxizi, Oxoacizi P, As - SB, BiDocument25 paginiCurs 7 - Grupa A 15-A, Oxizi, Oxoacizi P, As - SB, BiBianca OlteanuÎncă nu există evaluări
- Fisă de Lucru FosforulDocument1 paginăFisă de Lucru FosforulAlina BugaÎncă nu există evaluări
- Ingrasaminte Cu Fosfor Usor Solubile in Apa.Document5 paginiIngrasaminte Cu Fosfor Usor Solubile in Apa.No BodyÎncă nu există evaluări
- Fosforul ReferatDocument20 paginiFosforul ReferatArdelean LiudmilaÎncă nu există evaluări
- Chimie Organica CursDocument35 paginiChimie Organica CursRoxana AlinaÎncă nu există evaluări
- Acidul FosforicDocument1 paginăAcidul FosforiciLyyysÎncă nu există evaluări
- AndreeaDocument3 paginiAndreeaRazvan VornicuÎncă nu există evaluări
- Fosfor ChimieDocument11 paginiFosfor ChimieGabriel RusuÎncă nu există evaluări
- AGROCHIMIE 11 Ing Chim Cu FosforDocument2 paginiAGROCHIMIE 11 Ing Chim Cu FosforoanaÎncă nu există evaluări
- Referat ChimieDocument4 paginiReferat ChimieAndrei Florin PopîrdaÎncă nu există evaluări
- FluorulDocument5 paginiFluorulSorina M. TeiusanuÎncă nu există evaluări
- FosforDocument11 paginiFosforCris QualityÎncă nu există evaluări
- Acid FosoricDocument2 paginiAcid FosoricАнна КраевскаяÎncă nu există evaluări
- Ferocianura de SodiuDocument7 paginiFerocianura de SodiuSimona SticletÎncă nu există evaluări
- FluorulDocument4 paginiFluorulcatikakiÎncă nu există evaluări
- Elementele Din Grupa 15 - Chimie AnorganicaDocument55 paginiElementele Din Grupa 15 - Chimie AnorganicaAlina TanaseÎncă nu există evaluări
- Nemetale Istorie)Document7 paginiNemetale Istorie)Daniel DanÎncă nu există evaluări
- Fierul Si Aplicatiile SaleDocument2 paginiFierul Si Aplicatiile Salenyx hydrangeaÎncă nu există evaluări
- Presentation 7-8Document15 paginiPresentation 7-8Cristinutza CristinaÎncă nu există evaluări
- WWW - Referate.ro-Rolul Nemetalelor in Viata Omului 18287Document9 paginiWWW - Referate.ro-Rolul Nemetalelor in Viata Omului 18287Karol Ionas100% (1)
- Curs 7Document24 paginiCurs 7Cristina NegreaÎncă nu există evaluări
- Curs 1-Generalitati + Halogeni PDFDocument0 paginiCurs 1-Generalitati + Halogeni PDFAndreea Denisa RaducanuÎncă nu există evaluări