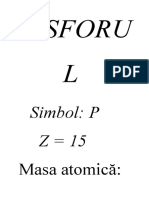Documente Academic
Documente Profesional
Documente Cultură
Fosforul P
Încărcat de
Ene Violeta AlinaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Fosforul P
Încărcat de
Ene Violeta AlinaDrepturi de autor:
Formate disponibile
FOSFORUL SI
IMPLICATIILE LUI
BIOLOGICE
Univ. Ovidius Constana
Facultatea de Farmacie
Specializarea Farmacie
Student:Ene Violeta Alina
Anul:I, Grupa:IV
2013-2014
CARACTERISTICILE GENERALE ALE GRUPEI
Din grupa a 15-a fac parte elementele:Azot(N),Fosfor(P),Arsen(As),Stibiu(Sb)
si Bismut(Bi).
In aceasta grupa caracterul nemetalic scade de la azot la bismut,deoarece si
in mod corespunzator scade si electronegativitatea atomilor,in acelasi sens
scade si polarizabilitatate si deci carcaterul covalent al legaturilor chimice pe
care le formeaza.
Toate aceste elemente in afara de bismut exista in mai multe forme alotropice
dintre care o forma nemetalica(singura la azot) si mai multe forme
metalice.Stabilitatea formei nemetalice scade odata cu electronegativitatea
elementului.
Razele covalente si ionice prezinta variatii regulate cu Z si explica formarea
legaturilor ionice si covalente.
Tendinta electronilor de a forma legaturi ionice creste cu Z ,in acelasi sens
scade si capacitatea lor de a forma legaturi covalente,caracteristica azotului
si fosforului.
Configuratia periferica electronica a atomilor acestor elemente este deci
ns2np3,ce imprima caracteristicile elementelor din blocul.
CARACTERISTICA GENERALA A ELEMENTULUI
Fosforul(din "phos"= lumin, "pherein"= a purta) este un element
din tabelul periodic avnd simbolul P i numrul atomic 15.
Fosforul a fost descoperit n anul 1669 de ctre alchimistul
german Hennig Brand din Hamburg. Acesta a supus nite
reziduuri de urin la un proces de calcinare n retort, n absena
aerului. Fosfaii din urin au suferit un proces de reducere sub
influena carbonului format prin pirogenarea resturilor organice
coninute. Hennig a descoperit proprietatea fosforului de a lumina
n ntuneric cu lumin albastr, numindu-l foc rece. Denumirea
de fosfor provine de la termenul de origine greac
phosphorus, ce nseamn purttor de lumin. Ulterior,
J.Kunckel n Germania i R.Boyle n Anglia redescoper procesul
de obinere. A. Lavoisier intuiete pentru prima dat c fosforul
este un element chimic. I.Gahnn (1770), iar apoi Scheele (1777)
semnaleaz prezena elementului n oase.
STARE NATURALA
Fosforul nu poate exista liber n natur deoarece are o mare afinitate pentru oxigen.
Se gsete numai sub form de compui, mai ales fosfai.
Fosforul apare in natura in compusi ai acidului ortofosforic:
Fosforitul sau difosfat tricalcic Ca
3
(PO
4
)
2
-este un amestec de:
hidroxil-apatita: 3Ca
3
(PO
4
)
2 *
Ca(OH)
2
carbonato-apatita: 3Ca
3
(PO
4
)
2*
Ca(HCO
3
)
2
OH
Apatit: Ca
3
(PO
4
)
2 *
Ca(F,Cl)
2
mineral format din cristale ce contin anioni sulfat(cel
mai important mineral)
Se gaseste si ca :
Fosfati de Fier:Vivianita Fe
3
(PO
4
)
2
*8H
2
O
Fosfati de Aluminiu:Wowelita 4AlPO
4
*2Al(OH)
3
*9H
2
O
Fosfati de Magneziu:-Wagnerita Mg
3
(PO
4
)
3*
MgF
2
-Stuvita NH
4
MgPO
4*
6H
2
O
Fosfati ai Pamanturilor rare:-Monazita (La,Ce)PO
4
-Xenotina YPO
4
Zacaminte importante de fosfor se gasesc in SUA,Maroc,Vietnam,Nordul
Africii,tara noastra n-avand zacaminte exploatabile de fosfor.
Principalul mineral care conine fosfor este apatita. Se intalneste in organismele
umane in par,dinti,oase sub forma de carbonat-apatita si hidroxil-apatita .Intra in
compozitia lipidelor si nucleoproteinelor.
PROPRIETATI FIZICE
In stare solida fosforul este
incolor si transparent,flexibil si
moale.Sub influenta luminii se
transforma intr-o masa opaca si
alba.Prin sublimare din solutii
de disulfura de carbon fosforul
alb se depune in stare
cristalina.Fosforul alb este
foarte toxic.
ALOTROPIA FOSFORULUI
Fosforul prezinta mai multe modificatii alotropice:alb,rosu,violet si negru.
Fosforul alb este toxic,are un miros neplacut(asemanator usturoiului),se
prezinta sub forma unei mase alb-galbuie de consistenta cerii,este insolubil in
apa,alcool si este solubil in eter,benzen si CS
2.
Fosforul rosu poate fi obtinut prin incalzirea la o temperatura de 400C a
fosforului alb,in prezenta luminii.Structura posibila a fosforului rosu ar putea fi
considerata ca fiind alcatuita din doua tuburi tetragonale unite intre printr-un
atom de fosfor .Fosforul rosu are densitatea 2,31 g/cm
3
,este insolubil in
sulfura de carbon CS
2
nu are miros si nu este toxic.Temperatura de sublimare
la presiune atmosferica a fosforului rosu este de 699 K.
Fosforul violet a fost obtinut prin dizolvarea fosforului alb in plumb topit si
lasandu-l sa cristalizeze.Se dizolva apio metalul in acid azotic sau se separa
prin electroliza.
Forma alotropica cea mai stabila termodinamic este cea a fosoforului
negru.Aceasta se obtine din fosfor alb la temperatura si presiune inalta in
prezenta catalizatorilor.Este dur si casant insolubil in sulfura de carbon CS
2
dar prezinta o reactivitate mai mare decat fosforul rosu.
PROPRIETATI CHIMICE
Spre deosebire de azot fosforul prezinta o mare
reactivitate.El formeaza o serie de compusi in care
numarul maxim de covalente este cinci,iar oxizii si
oxoaczizii sunt de regula combinatii externe.Forma cea
mai reactiva este cea de fosfor alb care-si manifesta,in
principal functia nemetalica fata de metale,hidrogen si
nemetale cu electronegativitate mai mica.Este un
oxidant.Pe langa functia de oxidare fosforul mai prezinta
si proprietati reducatoare pe care le manifesta fata de
nemetale cu electronegativitate mai mare sau fata de alte
substante cu caracter oxidant.
Fata de oxigen,halogeni,sulf sau combinatii ale
nemetalelor si metalelor cu caracter oxidant,se manifesta
drept agent reducator.
P
4
+5O
2
=P
4
O
10
P
4
+6Cl
2
=4PCl
3
P
4
+10 Cl
2
=4PCl
5
COMBINATIILE FOSFORULUI
Compusii fosforului cu Hidrogenul
Se cunosc doua combinatii ale fosforului cu hidrogenul:
-Hidrogenul fosforat gazos PH
3
(fosfina)
-Hidrogenul fosforat lichid(Difosfina)
Combinatiile fosforului cu halogenii
Fosforul formeaza :-halogenuri de tipul:
-Pentahalogenurile : PF
5
-gaz,PCl
5
si PBr
3
sunt solide
-Trihalogenurile :PF
3
este un gaz,PCl
3
si PBr
3
-lichide,iar PI
3
-solid cu punct de
topire coborat.
Halogenuri mixte
PFCl
PCl
3
Br
2
PBr
3
Cl
2
Oxihalogenuri mixte
Oxifluorura de fosfor POF
3
Oxitriclorura de fosfor este POCl
3
Oxitribromura de fosfor POBr
3
.
Oxizii fosforului.
-Trioxidul de difosfor P
2
O
3
(si
forma polimera P
4
O
6
)
-Dioxidul de fosfor PO
2
-Pentaoxidul de difosfor P
2
O
5
anhidrida fosforica
Oxoacizii fosforului
-Acidul Hipofosforos H
3
Po
2
-Acidul fosforos H
3
PO
3
-Acidul ortofosforic H
3
PO
4
Acidul peroxomonofosforic
H
3
PO
5
Metaacizii fosoforului
-Acidul metafosforos HPO
2
Acidul metafosforic HPO
2
Diacizii Fosforului
-Acidul
difosforos(pirofosforos)H
4
P
2
O
6
-Acidul hipofosforos
-Acidul pirofosforic H
4
P
2
O
7
-Acidul peroxodifosforic(H
4
P
2
O
8)
COMBINATIILE FOSFORULUI CU ALTE
ELEMENTE
Combinatiile fosforului cu sulful
sulfuri:
-Trisulfura de tetrafosfor: P
4
S
3
-Heptasulfura de tetrafosfor P
4
S
7
-Pentasulfura de difosfor P
2
O
6
tioacizi:
-H
3
PS
3,
-H
4
P
2
S
6,
-H
4
PS
4.
Acizii tiofosforici:
-acidul triofosforos H
3
PS
3
tiohalogenuri:
-PSF
3,
-PSCl
3,
-PSBr
3.
Combinatiile fosforului cu
azotul
Ca si in cazul altor omologi ca de
exemplu:oxigen-sulf,halogeni si in
sistemul azot-fosfor o serie de
legaturi chimice de mare
importanta.
Tiramida fosforoasa P(NH
2
)
3
Nitril fosforos PN
Clorura de fosfonitril PNCl
2
UTILIZARE GENERALA
Fosforul se utilizeaza la
fabricarea chibriturilor, a caror
introducere, catre mijlocul
secolului trecut, a reprezentat un
mare progres fata de metodele
mai vechi de aprins focul.
Primele chibrituri contineau in
gamalia lor fosfor alb si se
aprindeau prin frecare pe orice
suprafata aspra. Acestea au fost
parasite din cauza toxicitatii lor si
inlocuite cu asa- numitele
chibrituri suedeze". Gamalia
acestora, continand clorat de
potasiu si sulfura de antimoniu,
usor inflamabile, se aprinde
numai prin frecare pe o pasta
continand fosfor rosu
Fosforul are un rol foarte
important in procesul de
crestere a plantelor,
influentand favorabil procesul
de fructificare a cerealelor,
legumelor, pomilor fructiferi,
vitei- de -vie, precum si
depunerea zaharurilor in fructe,
sfecla si cartofi. Impreuna cu
potasiul si calciul fosforul
mareste rezistenta plantelor la
boli si intemperii, grabeste
coacerea fructelor.
In cazul unei cantitati
insuficiente de fosfor, plantele
se opresc din crestere,
frunzele raman mici si se
rasucesc, iar semintele nu se
mai formeaza
ROLUL FOSFORULUI IN ORGANISM UMAN
Fosforul este al doilea mineral abundent ca raspandire dupa calciu
in organism,aflandu-se in orice tesut.
In general, acesta este legat de calciu formand fosfatul de calciu
necesar cresterii oaselor, precum si mentinerii integritatii oaselor si
dintilor. De asemenea, fosforul are rol in buna functionare a
sistemului nervos, a inimii si a enzimelor (fermentilor). Fosforul din
organism provine din alimente care contin mari cantitati din acest
mineral ca: lapte, branza, oua, icre, creier, carne.
Fosforul joaca un rol important in sistemul tampon,care mentine
echilibrul acid/baza(pH) in interiorul organismului.
Fosforul mai intervine in scaderea tendintei de acidifiere a lichidelor
biologice din organism,provocata de produsii rezultati din
metabolismul celular.Se previne in acest fel alterarea functionalitatii
sistemului nervos si a cordului.
Prezinta un rol si in reglarea absortiei si in transportul substantelor
minerale,motiv pentru care mentine si pe aceasta cale o stare de
nutritie buna a individului.
Ca element fundamental in structura
membranelor biologice,fosforul participa
in transferul de substante ce au loc intre
celulele si mediu extracelular .Acest
element mineral intra in structura
compusilor care asigura stocarea si
eliberarea de energie a organismului.Cel
mai important dintre acestia este ATP-ul
(acidul adenozintrifosforic).O legatura
energetica ,din cele doua prezente in
molecula de ATP elibereaza 8000 de
kcal de energie,care este uitilizata in
scopul mentinerii activitatilor biologice
fundamentale.
Aceste celule sunt prezente in toate
celulele oraganismului,oricare din
activitatile vitale necesitand cantitati
variabile de energie care sunt eliberate
de catre ATP.
APLICATII BIOMEDICALE
Acid hipofosforos (Acidum hypophosphorosum)HPO
2
O
2
Acid fosforic(acid ortofosforic)H
3
PO
4
Acid fosforic concentrat(acidum phosphoricum
concentratum)
Acid fosforic diluat (acidum phosphoricum dilutum)
Hidrogenodifosfat de disodiu(dinatrii
hidrogenophosphas)Na
2
HPO
4
*12 H
2
O
Fosforul 32
TOXICITATE
Fosforul alb este foarte toxic pentru organism doza letala pentru
un adult fiind de 0.05 mg/m
3
aer.Ca antidot se rocomanda oxid
de magneziu sau o solutie apoasa de sulfat de cupru care da
fosfura inofensiva fiind totodata si vomitiv.
Fosforul rosu si negru nu sunt toxici.
Cele mai grave efecte secundare ale unei hiperfosfatemii
(cresterea peste nivelurile normale a cantitatii de fosfor din
sange) se manifesta prin calcifierea tesuturilor nonscheletice,
acest fapt petrecandu-se, in special, la nivelul rinichilor.
Depozitele de fosfat de calciu afecteaza mai ales rinichii, pentru
ca acestia sunt foarte eficienti in eliminarea fosfatilor in exces.
Hiperfosfatemia alimentara se poate manifesta doar in cazul
pacientilor cu insuficienta renala cronica. De asemenea, trebuie
retinut ca alimentele bogate in grasimi rafinate determina
dezechilibrul fosfor calciu, din cauza ca aceste grasimi, nu
numai ca sunt sarace in calciu, dar contin cantitati mari de fosfor,
iar excesul de fosfor, mai departe, inhiba absorbtia magneziului.
Solutii injectabile:
AREDIA SOLUTIE
INJECTABILA
Indicatii:Metastaze
osoase, predominant
osteolitice, mielom
multiplu, tumori care
induc hipercalcemie,
boala Paget osoasa
PRODUSE FARMACEUTICE PE BAZA DE ACID
FOSFORIC COMERCIALIZATE SI PE PIATA
Tablete:
OPTIMA FORTE
COMPRIMATE
Indicatii:Hipovitaminoza,
demineralizare, stres, oboseala,
convalescenta, anorexie,
imunodeficienta. Se recomanda
pentru cresterea rezistentei
persoanelor active fizic si
intelectual.
Unguente
ELOCOM CREMA UNGUENT
LOTIUNE
Indicatii: Numai pentru uz
dermatologic. Elocom crema,
unguent si lotiune 0,1 % sunt
indicate pentru ameliorarea
manifestarilor inflamatorii si
pruriginoase ale dermatozelor
care raspund la tratamentul
corticosteroid, precum
psoriazisul si dermatitele
atopice. Elocom lotiune poate
fi aplicat si in leziunile
scalpului.
S-ar putea să vă placă și
- FosforDocument15 paginiFosforAlexandra CismasÎncă nu există evaluări
- Circuitul Fosforului in NaturaDocument6 paginiCircuitul Fosforului in NaturaAnca Elena100% (1)
- Agrochimie Curs 1Document29 paginiAgrochimie Curs 1Sebastian NechiforÎncă nu există evaluări
- Fosforul PDocument12 paginiFosforul Pnicucazacu0% (1)
- Acidul FosforicDocument9 paginiAcidul Fosforicdiana fenichiuÎncă nu există evaluări
- Surse de Poluare A Solului - PetrolulDocument9 paginiSurse de Poluare A Solului - PetrolulMelanie100% (1)
- Poluanti Organici PersistentiDocument45 paginiPoluanti Organici PersistentiDobrutchi VeronicaÎncă nu există evaluări
- C1. Notiuni Introductive. Clasificare SoluriDocument24 paginiC1. Notiuni Introductive. Clasificare SoluriCîrîc DanielÎncă nu există evaluări
- Poluarea Cu Metale Grele A Ecosistemelor Marine Costiere Din Zona Litoralului Romanesc Al Marii NegreDocument17 paginiPoluarea Cu Metale Grele A Ecosistemelor Marine Costiere Din Zona Litoralului Romanesc Al Marii NegreIoana Gîlcă100% (1)
- Clasificarea SolurilorDocument9 paginiClasificarea Solurilorgenari.pla100% (1)
- PesticideDocument5 paginiPesticideDr Diana EnachescuÎncă nu există evaluări
- L6 IeaDocument6 paginiL6 IeaSerbanCorneliuÎncă nu există evaluări
- Poluarea SoluluiDocument6 paginiPoluarea SoluluiSymona LÎncă nu există evaluări
- Potasiul in SolDocument7 paginiPotasiul in Solistratulat_4Încă nu există evaluări
- 2.3 Cartarea Ecologic. 2.4. Recoltarea Ambalarea Transportarea AnalizaDocument5 pagini2.3 Cartarea Ecologic. 2.4. Recoltarea Ambalarea Transportarea AnalizaCristian StavilaÎncă nu există evaluări
- Determinarea PesticidelorDocument16 paginiDeterminarea PesticidelorGeorgiana Ivan100% (1)
- Curs Chimie EcologicaDocument569 paginiCurs Chimie Ecologicao_profaÎncă nu există evaluări
- Vasilache - Cornelia - Biodegradarea Biologica A PetroluluiDocument18 paginiVasilache - Cornelia - Biodegradarea Biologica A PetroluluiAndreea Liliana100% (1)
- Analiza HPLC A MicotoxinelorDocument57 paginiAnaliza HPLC A MicotoxinelorAleceandraÎncă nu există evaluări
- Cultivarea Plantelor Floricole in SereDocument7 paginiCultivarea Plantelor Floricole in SereGradina Lui MihaiÎncă nu există evaluări
- 1 CaracteristicileSoluluiDocument20 pagini1 CaracteristicileSoluluixhuljaÎncă nu există evaluări
- Poluarea Apei-Vlad ŞerbanDocument22 paginiPoluarea Apei-Vlad Şerbannely popÎncă nu există evaluări
- Amonificarea Și Asimilarea Amoniacului de Către MicroorganismeDocument10 paginiAmonificarea Și Asimilarea Amoniacului de Către MicroorganismeAngel Cosmyn ChiricaÎncă nu există evaluări
- Dendrologie 2Document161 paginiDendrologie 2stefanahantar088Încă nu există evaluări
- Raport Stiintific Iazuri Decantare PDFDocument62 paginiRaport Stiintific Iazuri Decantare PDFAna SimionovÎncă nu există evaluări
- Usamvbt 2Document4 paginiUsamvbt 2Paul BacheșÎncă nu există evaluări
- 0 HB Curs 5 6 (1) .Ape AreDocument19 pagini0 HB Curs 5 6 (1) .Ape AreAnNuSa07Încă nu există evaluări
- Ingrasaminte Complexe NPKDocument11 paginiIngrasaminte Complexe NPKEmilian IcleanuÎncă nu există evaluări
- Tutunul-Proiect ApssDocument13 paginiTutunul-Proiect ApssAndrei TutunaruÎncă nu există evaluări
- Humusul Si Taxonomia SoluluiDocument5 paginiHumusul Si Taxonomia SoluluiCalin-Iulian FratilaÎncă nu există evaluări
- Tipuri de SolDocument9 paginiTipuri de SolAndrei AvdeevÎncă nu există evaluări
- 5 Hidrocarburi Aromatice Polinucleare 2015-02-24 VFDocument71 pagini5 Hidrocarburi Aromatice Polinucleare 2015-02-24 VFVasiloni Ioan PaulÎncă nu există evaluări
- A Solurilor Contaminate Cu CadmiuDocument14 paginiA Solurilor Contaminate Cu CadmiuGeorgiana DeciuÎncă nu există evaluări
- Faza de Lumina A FotDocument22 paginiFaza de Lumina A FotIorgu GeorgianÎncă nu există evaluări
- Poluarea Solului Cu PesticideDocument9 paginiPoluarea Solului Cu PesticideIrinaÎncă nu există evaluări
- HumusulDocument12 paginiHumusulmechanics9007Încă nu există evaluări
- Rezistenta Plantelor La SalinitateDocument2 paginiRezistenta Plantelor La SalinitateAlexAntociÎncă nu există evaluări
- Stiinta SoluluiDocument111 paginiStiinta SoluluiLidia TironÎncă nu există evaluări
- Interactiuni Ale Plantelor Cu Metale GreleDocument19 paginiInteractiuni Ale Plantelor Cu Metale GreleAna100% (1)
- Proiect IngrasaminteDocument4 paginiProiect IngrasaminteCiulei SebastianÎncă nu există evaluări
- Compusi Organici VolatiliDocument13 paginiCompusi Organici VolatiliLauraElenaÎncă nu există evaluări
- Molibdenul - Metalele in Epoca Actuala - Ovidiu Hatarascu. This Is Yet Another Gift For The WWW - Scribd.com Community of The Readers From WWW - Eastern-Software-CreativeDocument3 paginiMolibdenul - Metalele in Epoca Actuala - Ovidiu Hatarascu. This Is Yet Another Gift For The WWW - Scribd.com Community of The Readers From WWW - Eastern-Software-CreativeEurasiansÎncă nu există evaluări
- AGROCHIMIEDocument11 paginiAGROCHIMIEOana BanuÎncă nu există evaluări
- Det Suma Cationilor Bazici Met KappenDocument3 paginiDet Suma Cationilor Bazici Met KappenPetre Constantin100% (1)
- Clasificarea Metodelor de Depoluare A SoluluiDocument12 paginiClasificarea Metodelor de Depoluare A SoluluiMirceaÎncă nu există evaluări
- Nitriţii Şi NitraţiiDocument8 paginiNitriţii Şi NitraţiiLiana MihutÎncă nu există evaluări
- Prelevare Probe SolDocument6 paginiPrelevare Probe SolstefaniaÎncă nu există evaluări
- E-Suport de Curs SMDocument416 paginiE-Suport de Curs SMHorvat NorbertÎncă nu există evaluări
- Carbonaţii Alcalino PamantosiDocument6 paginiCarbonaţii Alcalino PamantosiBianca GuțuiÎncă nu există evaluări
- Notiuni de Agricultura curs-CIOBANU ANDIDocument363 paginiNotiuni de Agricultura curs-CIOBANU ANDIfloriÎncă nu există evaluări
- Referat Eficienta Economica Si Energetica A RapiteiDocument10 paginiReferat Eficienta Economica Si Energetica A RapiteiG PaulÎncă nu există evaluări
- Lucrari Stiintifice Zootehnie NR 50 2007Document822 paginiLucrari Stiintifice Zootehnie NR 50 2007MrGaffa100% (1)
- Contaminarea Produselor Alimentare Cu MercurDocument22 paginiContaminarea Produselor Alimentare Cu MercurCernat AlexandraÎncă nu există evaluări
- Determinarea PlumbuluiDocument3 paginiDeterminarea PlumbuluiadinusaÎncă nu există evaluări
- Nutritia Plantelor Cu AzotDocument4 paginiNutritia Plantelor Cu AzotGavrilă Denisa Alexandra100% (1)
- FosforulDocument6 paginiFosforultobi92100% (3)
- FosfOr (76543464567)Document9 paginiFosfOr (76543464567)Dumitru BuzduganÎncă nu există evaluări
- Fosforul FinalDocument4 paginiFosforul Finalpetreionutz87Încă nu există evaluări
- FosforulDocument2 paginiFosforulNicholas Owens67% (3)
- FOSFORULDocument6 paginiFOSFORULvioletabadanÎncă nu există evaluări