Documente Academic
Documente Profesional
Documente Cultură
Barem Clasa 12 Proba Teoretica 2023
Barem Clasa 12 Proba Teoretica 2023
Încărcat de
Alexandru RoinitaTitlu original
Drepturi de autor
Formate disponibile
Partajați acest document
Partajați sau inserați document
Vi se pare util acest document?
Este necorespunzător acest conținut?
Raportați acest documentDrepturi de autor:
Formate disponibile
Barem Clasa 12 Proba Teoretica 2023
Barem Clasa 12 Proba Teoretica 2023
Încărcat de
Alexandru RoinitaDrepturi de autor:
Formate disponibile
OLIMPIADA NAŢIONALĂ DE CHIMIE
DEVA, 2-7 aprilie 2023
Ediţia a LVI-a
Barem de evaluare şi de notare
Proba teoretică
Clasa a XII–a
Se punctează orice modalitate de rezolvare corectă a cerinţelor.
Subiectul I (20 de puncte)
1 C; 2 B; 3 E; 4 D; 5 E; 6 B; 7 B; 8 D; 9 A; 10 C.
Fiecare răspuns corect primeşte 2 puncte
Subiectul al II-lea (20 de puncte)
II.1) 4 p distribuite astfel:
‐ ‐
‐ 2 2 2 ‐
2x
0,059
2 2 ‐ 1p
Q/QH
2
‐
2 2 2 2p
II.2) 2 p:
‐
‐ | | | , , , | 2p
II.3) 4 p distribuite astfel:
0,059
/ / 0,059 / 0,059
2
+
pH=-lg[H ]
2p
‐
[Q]=[QH2]
‐ / 0,059 0,059
/ 0,696 0,246 0,45 2p
II.4) 2 p:
E=E0-0,059·pH 2p
II.5) 2 p:
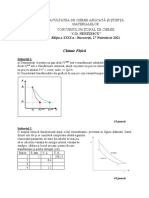
pH(1) = 3,8; pH(2) = 4,15; pH(3) = 4,38; pH(4) = 4,57. 2p
,
Olimpiada Naţională de Chimie 2023 Pagină 1 din 7
Barem de evaluare şi de notare – proba teoretică
Clasa a XII-a
II.6) 6 p:
Soluţia conţine 0,01 0,1 10‐3
-3
Fie V=x mL = 10 ·x L soluţie NaOH adăugată
nNaOH = CM·VS=10-4·x moli NaOH adăugat
CH3COOH + NaOH → CH3COONa + H2O
2p
reacţionat format 10
adăugat
-3 -4 -4
Sistemul tampon conţine: (10 - 10 ·x) = 10 ·(10-x) mol CH3COOH nereacţionat
10-4·x mol sare CH3COONa formată
VS= (100+x) mL soluţie după adăugarea NaOH
10‐4 10 10
10 ‐4
10
x = 1 mL soluţie NaOH adăugat 3,8 4,754
x = 2 mL soluţie NaOH adăugat 4,15 4,752
2p
x = 3 mL soluţie NaOH adăugat 4,38 4,748
x = 4 mL soluţie NaOH adăugat 4,57 4,746
4,75
4
4,75 10‐ 10‐ ,
1,78 10‐5
2p
Subiectul al III-lea (20 de puncte)
III.1) 2p distribuite astfel:
2x
S, S
1p
III.2) 1p:
22 = 4 1p
III.3) 4p distribuite astfel:
4x
1p
Olimpiada Naţională de Chimie 2023 Pagină 2 din 7
Barem de evaluare şi de notare – proba teoretică
Clasa a XII-a
III.4) 2p:
2p
III.5) 1p:
Toluen – este produs secundar de hidrogenoliză 1p
III.6) 6p distribuite astfel:
3x
2p
III.7) 4p distribuite astfel:
4x
1p
Olimpiada Naţională de Chimie 2023 Pagină 3 din 7
Barem de evaluare şi de notare – proba teoretică
Clasa a XII-a
Subiectul al IV-lea (40 de puncte)
IV.A) 6p distribuite astfel:
‐1
0,78 28 0,21 32 0,01 40 28,96 1p
‐1
. 0,6985 20,23 1p
1 0,264
32 16 20,23 0,736 1p
26,4 ; 22,4 1 1,18
1p
73,6 ; 3,29
CH4(g) + 2 O2(g)→ CO2(g) + 2 H2O (l)
1 mol 2 moli 1 mol 1p
0,59 1,18 0,59 mol
După oxidarea metanului şi răcirea amestecului la 0 °C rămân 3,29 moli de gaz (0,59 moli
CO2, (3,29 - 0,59) moli CH4), noua presiune, după neglijarea volumului apei, va fi
p = 0,736 atm. 1p
1,18 + 3,29 = 4,47 moli ... ... ... 1 atm
3,29 moli ... ... ... x atm (x = 0,736 atm)
IV.B) 14p distribuite astfel:
IV.B.1) 1,5 p:
Folosind ecuaţia polinomială, pentru T = 281,3 K corespunde Cp = 75,3 J mol-1 K-1. 1,5 p
IV.B.2) 9,5 p distribuite astfel:
l = 2 cm => Volumul 8 cm3, ρ = 1 g/cm3 => m = 8 g,
8 0,5 p
ţă ‐1
0,44
18
Energia necesară ca gheaţa să devină lichidă:
1,5 p
‐1 ‐1 ‐1
0,44 37,4 273 268 6010
2727
‐1 ‐1 1p
2727 2 75,3 50 31,9 304,9
Temperatura la care ajunge apa după ce întreaga cantitate de gheaţă a devenit lichidă.
ă 31.9 0
1,5 p
2 31,9 0,44 unde tech – temperatura de echilibru
26,1o 299,1
Olimpiada Naţională de Chimie 2023 Pagină 4 din 7
Barem de evaluare şi de notare – proba teoretică
Clasa a XII-a
Δsublimare, 273KH = Δtopire, 273KH + Δvaporizare, 273KH
Δtopire, 273KH = Δsublimare, 273KH - Δvaporizare, 273KH 1p
= 51,10 kJ mol-1 - 45,09 kJ mol-1 = 6,01 kJ mol-1
,
ţă ţă 1p
. ‐1
ţă 0,44 37,4 75,3 13,0 - entropia crește la
1p
topirea gheţii
, , ‐1
ă ă 2 75,3 11,6 - entropia scade la
1,5 p
răcirea apei
‐1 ‐1 ‐1
13 11,6 1,4 - per total variaţia entropiei este pozitivă
0,5 p
(crește)
IV.B.3) 3 p distribuite astfel:
Volum total de apă 36 ml + 8 ml = 44 ml (2,44 moli) 0,5 p
‐1 ‐1
44 ‐1
2,44 8,314 140,1
44 10‐3
0 393 140,1 ‐1
55059 55,1 2,5 p
proces izoterm =>ΔH = 0
Precizare: - nu este importantă unitatea de măsură pentru volum
IV.C) 20 p distribuite astfel:
IV.C.1) 2 p distribuite astfel:
+ + 2x
- N N -
O O O O 1p
Precizare: Se acceptă şi forma: N
O O cu acordarea a jumătate din punctaj (1p)
IV.C.2) 1 p:
2 1p
IV.C.3) 6 p distribuite astfel:
Mecanismul prezintă o suită de etape succesive, aşadar etapa lentă va fi etapa determinantă
1p
de viteză pentru întregul proces.
Olimpiada Naţională de Chimie 2023 Pagină 5 din 7
Barem de evaluare şi de notare – proba teoretică
Clasa a XII-a
Etapa (2) nu poate fi etapă lentă deoarece implică recombinare a radicalilor liberi (energie
1p
de activare zero).
Una dintre etapele (1) sau (3) ar putea fi lentă.
Dacă etapa (1) ar fi cea lentă:
_Viteza de reacţie ar fi - expresie plauzibilă (reacţie bimoleculară) 1p
Dacă etapa (3) ar fi cea lentă:
_În sistem s-ar acumula HNO2 format din reacţia rapidă (1) => viteza întregului proces ar
1p
depinde de o reacţie bimoleculară lentă de descompunere a HNO2
_În situaţia acumulării HNO2 în sistem, cantitatea de apă rezultată din etapa (3) ar fi
semnificativ mai mică decât cea a Br2 format din succesiunea a două etape rapide: (1) şi 1p
(2), fapt infirmat de datele experimentale (cantităţi aproximativ egale de H2O şi Br2).
În concluzie, varianta ce concordă cel mai bine cu datele experimentale ar fi:
_etapa (1) - lentă (determinantă de viteză) => viteza întregului proces:
_etapa (2) - foarte rapidă 1p
_etapa (3) - rapidă
IV.C.4) 2 p distribuite astfel:
. . .
Pentru experimentele 1 şi 2: <=>
. .
. 1p
.
<=>2.45 2.5 1 => 1
.
. . .
Pentru experimentele 2 şi 3: <=>
. .
. 1p
.
<=>1.59 1 1.67 => 1
.
=> ; ecuaţie de viteză confirmată
IV.C.5) 3 p distribuite astfel:
=>
La 127oC (400K):
oricare dintre variantele:
‐1
. 0.85
0.021
4 10
. .
‐1 0.75
. 2.08
0.021 p
10 10
. .
‐1
. 1.31
0.022
10 6
. .
Olimpiada Naţională de Chimie 2023 Pagină 6 din 7
Barem de evaluare şi de notare – proba teoretică
Clasa a XII-a
La 107oC (380K):
‐1
. 3.18 0.75
0.016
20 10 p
. .
‐1 ‐1 0.5 p
scrierea unităţii de măsură a constantei de viteză de ordinul 2:
calculul Ea:
sau =>
0.021
8.31 0.016 17 1p
1 1 1 1
380 400
IV.C.6) 3p:
Etapa (1) a mecanismului (determinantă de viteză) are o energie de activare mică
(sub 20 kJ/mol) datorită caracterului de radical liber al NO2 (conform structurilor limită) ce
3p
favorizează atacul radicalic asupra HBr (cu punerea în libertate a radicalului Br·) fără a mai
necesita o etapă de iniţiere (caracteristică unui mecanism radicalic înlănţuit).
IV.C.7) 3p:
Conform stoechiometriei: 2 , în experimentul (2) NO2 este
în exces (de două ori mai mult decât HBr), aşadar mai rămâne fracţiunea 1/2 din cantitatea
iniţială de NO2 atunci când s-a consumat tot HBr, adică la sfârşitul reacţiei, ceea ce din 3p
punct de vedere teoretic reprezintă timpul infinit => ⁄ ∞
Precizare: datorită valorii, acest timp nu mai poate avea unitate de măsură :)
Olimpiada Naţională de Chimie 2023 Pagină 7 din 7
Barem de evaluare şi de notare – proba teoretică
Clasa a XII-a
S-ar putea să vă placă și
- OLAV 9-10 BAREM Varianta 1Document2 paginiOLAV 9-10 BAREM Varianta 1Alexandru Roinita0% (1)
- Fisa AlcheneDocument8 paginiFisa AlcheneMaria Cristina Constantin100% (1)
- Subiecte Chimie AnorganicăDocument2 paginiSubiecte Chimie AnorganicăMaria ȚagaÎncă nu există evaluări
- Energia Si Reactiile ChimiceDocument9 paginiEnergia Si Reactiile ChimiceVartolomeiDumitruÎncă nu există evaluări
- 2010 Curs 9 Tipuri Electrozi Partea IIDocument6 pagini2010 Curs 9 Tipuri Electrozi Partea IIDorin PopescuÎncă nu există evaluări
- TezaDocument1 paginăTezaGrama Adriana0% (2)
- 2023 Barem Baraj TERMODocument3 pagini2023 Barem Baraj TERMOVictor TrocanÎncă nu există evaluări
- Subiecte Proba Practica de Chimie Anorganica A Concursului National de Chimie "C. D. Nenitescu", Editia 2004Document4 paginiSubiecte Proba Practica de Chimie Anorganica A Concursului National de Chimie "C. D. Nenitescu", Editia 2004ChemmonÎncă nu există evaluări
- Oj CH2008Document3 paginiOj CH2008Beatrice Maria BalaceanuÎncă nu există evaluări
- ONCh 2013, Clasa A IX-a, Proba Practica, Subiecte Si BaremeDocument7 paginiONCh 2013, Clasa A IX-a, Proba Practica, Subiecte Si BaremeChemmonÎncă nu există evaluări
- Judet PDFDocument29 paginiJudet PDFDobos OvidiuÎncă nu există evaluări
- NENITESCU Nov 2017 Chimie Anorg SubiecteDocument2 paginiNENITESCU Nov 2017 Chimie Anorg SubiecteLarisa PopÎncă nu există evaluări
- 2010 Chimie Etapa Locala Subiecte Clasa A X-A 0Document3 pagini2010 Chimie Etapa Locala Subiecte Clasa A X-A 0anime80Încă nu există evaluări
- Tema 3Document5 paginiTema 3Simona SileaÎncă nu există evaluări
- OJChimie Clasa 9 2022 Subiecte LRODocument3 paginiOJChimie Clasa 9 2022 Subiecte LRORose PaioviciÎncă nu există evaluări
- Afis Chimie FINAL PDFDocument1 paginăAfis Chimie FINAL PDFAlexandru RoinitaÎncă nu există evaluări
- 2013 Chimie Locala Sibiu Clasa A Ixa Subiecte Si BaremeDocument3 pagini2013 Chimie Locala Sibiu Clasa A Ixa Subiecte Si BaremeennaeÎncă nu există evaluări
- 2023 Subiect Baraj TERMODocument2 pagini2023 Subiect Baraj TERMOVictor TrocanÎncă nu există evaluări
- Subiecte Excelenta+barem Chimie Prahova 2018Document4 paginiSubiecte Excelenta+barem Chimie Prahova 2018Liliana DieaÎncă nu există evaluări
- Subiecte Chimie 2019 Facultatea de MedicinaDocument29 paginiSubiecte Chimie 2019 Facultatea de MedicinaVali Panait100% (1)
- Olimpiada Judeteana de Chimie 2006 - Subiecte, Clasa A X-ADocument2 paginiOlimpiada Judeteana de Chimie 2006 - Subiecte, Clasa A X-AChemmonÎncă nu există evaluări
- Echilibrul Chimic FisaDocument1 paginăEchilibrul Chimic FisaMadalina PopescuÎncă nu există evaluări
- Barem Ojch Clasa 8 4 Martie 2017 PDFDocument2 paginiBarem Ojch Clasa 8 4 Martie 2017 PDFAna-MariaÎncă nu există evaluări
- Subiecte Clasa 9Document2 paginiSubiecte Clasa 9Ana Sara HohanÎncă nu există evaluări
- Fişă de Lucru: SOLUŢII - Concentraţia Molară Şi Procentuală A SoluţiilorDocument1 paginăFişă de Lucru: SOLUŢII - Concentraţia Molară Şi Procentuală A Soluţiilordanila jojoÎncă nu există evaluări
- c7 Eteri Ciclici 2015 2016Document12 paginic7 Eteri Ciclici 2015 2016Ioana CrînganuÎncă nu există evaluări
- Def 010 Chimie P 2022 Var 03 LRODocument3 paginiDef 010 Chimie P 2022 Var 03 LROdpÎncă nu există evaluări
- 2004 Chimie Nationala Subiecte Clasa A IX-A 1Document2 pagini2004 Chimie Nationala Subiecte Clasa A IX-A 1Alex SlavoiaÎncă nu există evaluări
- F 01Document23 paginiF 01antandeeaÎncă nu există evaluări
- Curs 1 - Compusi CarboxiliciDocument28 paginiCurs 1 - Compusi CarboxiliciCezara AxinteÎncă nu există evaluări
- Reactii Formare de Combinatii ComplexeDocument5 paginiReactii Formare de Combinatii ComplexeRareș DinuÎncă nu există evaluări
- Reactii ProtoliticeDocument13 paginiReactii ProtoliticeBaran MihaiÎncă nu există evaluări
- Derivati Functionali 2Document22 paginiDerivati Functionali 2Alex AndruÎncă nu există evaluări
- Subiecte + Bareme Concursul National de Chimie C. D. Nenitescu, Proba Practica de Chimie AnorganicaDocument4 paginiSubiecte + Bareme Concursul National de Chimie C. D. Nenitescu, Proba Practica de Chimie AnorganicaChemmonÎncă nu există evaluări
- Termochimie 1Document3 paginiTermochimie 1grigor_stoyanovich100% (1)
- 2019 Chimie Judet Clasa X SubiectDocument4 pagini2019 Chimie Judet Clasa X SubiectAntonio CăciularuÎncă nu există evaluări
- 2016 Chimie Judeteana Clasa A Xia SubiectebaremDocument7 pagini2016 Chimie Judeteana Clasa A Xia SubiectebaremOvidiu TeleianuÎncă nu există evaluări
- Subiecte Chimie Anorganica 15variante 2019 2016 PDFDocument75 paginiSubiecte Chimie Anorganica 15variante 2019 2016 PDFOvidiu Cornel CioclovÎncă nu există evaluări
- 2018 Chimie Judet Clasa A IX Subiect V 1Document3 pagini2018 Chimie Judet Clasa A IX Subiect V 1DM XyzÎncă nu există evaluări
- Barem Clasa Ix Proba Practica PDFDocument2 paginiBarem Clasa Ix Proba Practica PDFion barboiÎncă nu există evaluări
- 0 TestalcooliDocument1 pagină0 Testalcoolielena isachiÎncă nu există evaluări
- Subiect Petru Poni Clasa 10 15 Martie 2014Document2 paginiSubiect Petru Poni Clasa 10 15 Martie 2014Cornelia CorneliaÎncă nu există evaluări
- E D Chimie Organica 2017 Bar Simulare LRODocument2 paginiE D Chimie Organica 2017 Bar Simulare LROAnonymous GzRc2mww4Încă nu există evaluări
- 2011 Chimie Etapa Nationala Subiecte Clasa A XI-A 0Document4 pagini2011 Chimie Etapa Nationala Subiecte Clasa A XI-A 0Andreea BobuÎncă nu există evaluări
- 14 - Retele CristalineDocument12 pagini14 - Retele CristalineVeronica DrgÎncă nu există evaluări
- Marta PetrovanuDocument2 paginiMarta PetrovanuVlada CovalciucÎncă nu există evaluări
- ProblemeChimieOrganicaVolumulI PDFDocument301 paginiProblemeChimieOrganicaVolumulI PDFFloriÎncă nu există evaluări
- Hidrocarburi Nesaturate: AlchineDocument66 paginiHidrocarburi Nesaturate: AlchinepetreosÎncă nu există evaluări
- IzomeriaDocument4 paginiIzomeriaLiliana Vizitiu CoșlețÎncă nu există evaluări
- Grasimi - Săpunuri. DetergențiDocument3 paginiGrasimi - Săpunuri. DetergențiAlessia Morar100% (1)
- Probleme ZaharideDocument2 paginiProbleme Zaharideoctavian docanÎncă nu există evaluări
- Subiect Grad II Chimie Universitatea Babes Bolyai ClujDocument1 paginăSubiect Grad II Chimie Universitatea Babes Bolyai ClujSoponaru Tarta Cristina0% (1)
- 2010 - Chimie - Concursul 'Magda Petrovanu' (Iasi) - Clasa A IX-a - SubiecteDocument2 pagini2010 - Chimie - Concursul 'Magda Petrovanu' (Iasi) - Clasa A IX-a - SubiectefilipiucrazvanelÎncă nu există evaluări
- C1 Introducere in Chimia Organicasia PDFDocument30 paginiC1 Introducere in Chimia Organicasia PDFAlexandra IoanÎncă nu există evaluări
- Subiecte Proba Teoretică Chimie Fizică Concurs C. D. NenițescuDocument3 paginiSubiecte Proba Teoretică Chimie Fizică Concurs C. D. NenițescuChemmon100% (1)
- ccs2020 s2Document26 paginiccs2020 s2Madalina LunguÎncă nu există evaluări
- E D Chimie Organica 2020 Test 10 PDFDocument3 paginiE D Chimie Organica 2020 Test 10 PDFAna-MariaÎncă nu există evaluări
- PDF Scanner 191023 9.51.40Document5 paginiPDF Scanner 191023 9.51.40Alexandru RoinitaÎncă nu există evaluări
- PDF Scanner 25-09-22 10.31.47Document1 paginăPDF Scanner 25-09-22 10.31.47Alexandru RoinitaÎncă nu există evaluări
- Admisi MDDocument7 paginiAdmisi MDAlexandru RoinitaÎncă nu există evaluări
- CamScanner 11-14-2022 20.54Document1 paginăCamScanner 11-14-2022 20.54Alexandru RoinitaÎncă nu există evaluări
- Tumorile Țesutului Hematopoietic Și Melanoformator.Document124 paginiTumorile Țesutului Hematopoietic Și Melanoformator.Alexandru RoinitaÎncă nu există evaluări
- Taxe UMFCD 2023 2024Document3 paginiTaxe UMFCD 2023 2024Alexandru RoinitaÎncă nu există evaluări
- Scan 13 Sept. 23 14 35 30Document1 paginăScan 13 Sept. 23 14 35 30Alexandru RoinitaÎncă nu există evaluări
- Lista Studentilor Beneficiari-: Tabere Studentesti-August 2022Document1 paginăLista Studentilor Beneficiari-: Tabere Studentesti-August 2022Alexandru RoinitaÎncă nu există evaluări
- 2014 Chimie Nationala Clasa A Xa Proba Practica SubiectebaremDocument3 pagini2014 Chimie Nationala Clasa A Xa Proba Practica SubiectebaremAlexandru RoinitaÎncă nu există evaluări
- Funcţia de Conducere A Măduvei Spinării-Căile Lungi de Proiecţie-Oiegar EmanuelaDocument5 paginiFuncţia de Conducere A Măduvei Spinării-Căile Lungi de Proiecţie-Oiegar EmanuelaAlexandru RoinitaÎncă nu există evaluări
- 2018Document3 pagini2018Alexandru RoinitaÎncă nu există evaluări
- Medicină GeneralăDocument2 paginiMedicină GeneralăAlexandru RoinitaÎncă nu există evaluări
- RedistribuireDocument1 paginăRedistribuireAlexandru RoinitaÎncă nu există evaluări
- Ix Rezultate FinaleDocument5 paginiIx Rezultate FinaleAlexandru RoinitaÎncă nu există evaluări
- Program UbsuDocument7 paginiProgram UbsuAlexandru RoinitaÎncă nu există evaluări
- Barem Clasa X Proba PracticaDocument1 paginăBarem Clasa X Proba PracticaAlexandru RoinitaÎncă nu există evaluări
- Revista: de Ce?Document42 paginiRevista: de Ce?Alexandru RoinitaÎncă nu există evaluări
- 63df6cf293032 20230204154357356 Redacted PDFDocument1 pagină63df6cf293032 20230204154357356 Redacted PDFAlexandru RoinitaÎncă nu există evaluări
- Medicină GeneralăDocument2 paginiMedicină GeneralăAlexandru RoinitaÎncă nu există evaluări
- Rezultate Finale 2023Document4 paginiRezultate Finale 2023Alexandru RoinitaÎncă nu există evaluări
- Chimie Anorganica SubiectDocument2 paginiChimie Anorganica SubiectAlexandru RoinitaÎncă nu există evaluări
- AHL 10 Barem PDFDocument2 paginiAHL 10 Barem PDFAlexandru RoinitaÎncă nu există evaluări
- Chimia Organica - 0 PDFDocument2 paginiChimia Organica - 0 PDFAlexandru RoinitaÎncă nu există evaluări
- Afis Chimie FINAL PDFDocument1 paginăAfis Chimie FINAL PDFAlexandru RoinitaÎncă nu există evaluări
- Haimovici Judet Uman 2017 Subiect Clasa 10 PDFDocument1 paginăHaimovici Judet Uman 2017 Subiect Clasa 10 PDFAlexandru RoinitaÎncă nu există evaluări
- Chimie Fizică: Facultatea de Chimie Aplicată Și Știința Materialelor Concursul Național de Chimie "C.D. Nenițescu"Document5 paginiChimie Fizică: Facultatea de Chimie Aplicată Și Știința Materialelor Concursul Național de Chimie "C.D. Nenițescu"Alexandru RoinitaÎncă nu există evaluări
- Chimie Anorganică: Facultatea de Inginerie Chimică Şi Biotehnologii Concursul Național de Chimie "C.D. Nenițescu"Document3 paginiChimie Anorganică: Facultatea de Inginerie Chimică Şi Biotehnologii Concursul Național de Chimie "C.D. Nenițescu"Alexandru Roinita100% (1)
- Clasa XI Subiect Etapa 2 PDFDocument5 paginiClasa XI Subiect Etapa 2 PDFAlexandru RoinitaÎncă nu există evaluări
- AHL Subiect 10 PDFDocument1 paginăAHL Subiect 10 PDFAlexandru RoinitaÎncă nu există evaluări